1997年McPherron等从小鼠骨骼肌cDNA文库中克隆到一个新的因子,该基因编码376个氨基酸的蛋白质。结构上分析这个因子具有转化生长因子-β(transforming growth factor-β,TGF-β)超家族成员结构上共同的特点:①在带有信号肽的N-端区附近,有一氨基酸残基构成的疏水前体蛋白质核心;②肌生成抑制素蛋白质中部靠C-端区,有一个保守的蛋白酶解加工信号(RSSR,263~266位氨基酸);③C-端区有9个半胱氨酸残基形成“Cys K not”结构。因此将其列为TGF-β超家族中的一类新因子,即生长分化因子8(growth and differentiation factor-8,GDF-8)。该基因主要在骨骼肌中表达,基因敲除鼠的骨骼肌是正常野生型小鼠的3倍以上,根据GDF-8因子对骨骼肌生长具有抑制作用的功能,后将它正式定名为Myostatin(肌肉抑制素)。TGF-β超家族成员主要包括TGF-β、活化素(activin)、抑制素(inhibin)、骨形态发生蛋白(bone morphogenetic protein,BMP)、生长分化因子(growth differentiation factor,GDF)和抗米勒管激素(anti-Müllerian hormone,AMH)等亚家族。
1998年Gonzalez-Cedavid等克隆了人的Myostatin基因组基因,人Myostatin基因全长7.7kb,由3个外显子和2个内含子构成,内含子1和内含子2分别为1.8kb和2.4kb。三个外显子编码的氨基酸长度分别为125、124和126个氨基酸。
就像TGF-β家族的其他成员一样,Myostatin也要经过两次加工才能由无活性的前体变为成熟具有生物活性的蛋白。第一次加工是将分泌所需的N端24个氨基酸构成的信号肽移除;第二次是在RSRR位点切割成N端和C端两个肽段。初始翻译产物经历两次蛋白酶切加工过程,产生氨基端的潜伏相关肽(latency associated peptide,LAP)和羧基端由同源二聚体组成的潜伏态成熟myostatin蛋白,并形成潜伏态可激活的复合体,这种复合体与其他myostatin结合蛋白结合后储存于细胞膜表面,只有当LAP被一种称为BMP-1/tolloid蛋白酶水解后,处于潜伏态的成熟myostatin蛋白才被激活而具有生物学活性。在体内究竟由哪种酶完成第二次切割还没有报道,在体外可以由Furin来完成。切割后的C端具有生物学活性,它们形成二聚体作用于受体。而N端也具有重要的作用,其功能主要是与C端以非共价键结合,抑制其活性,并在靶细胞处解离出来(图2-13-1)。
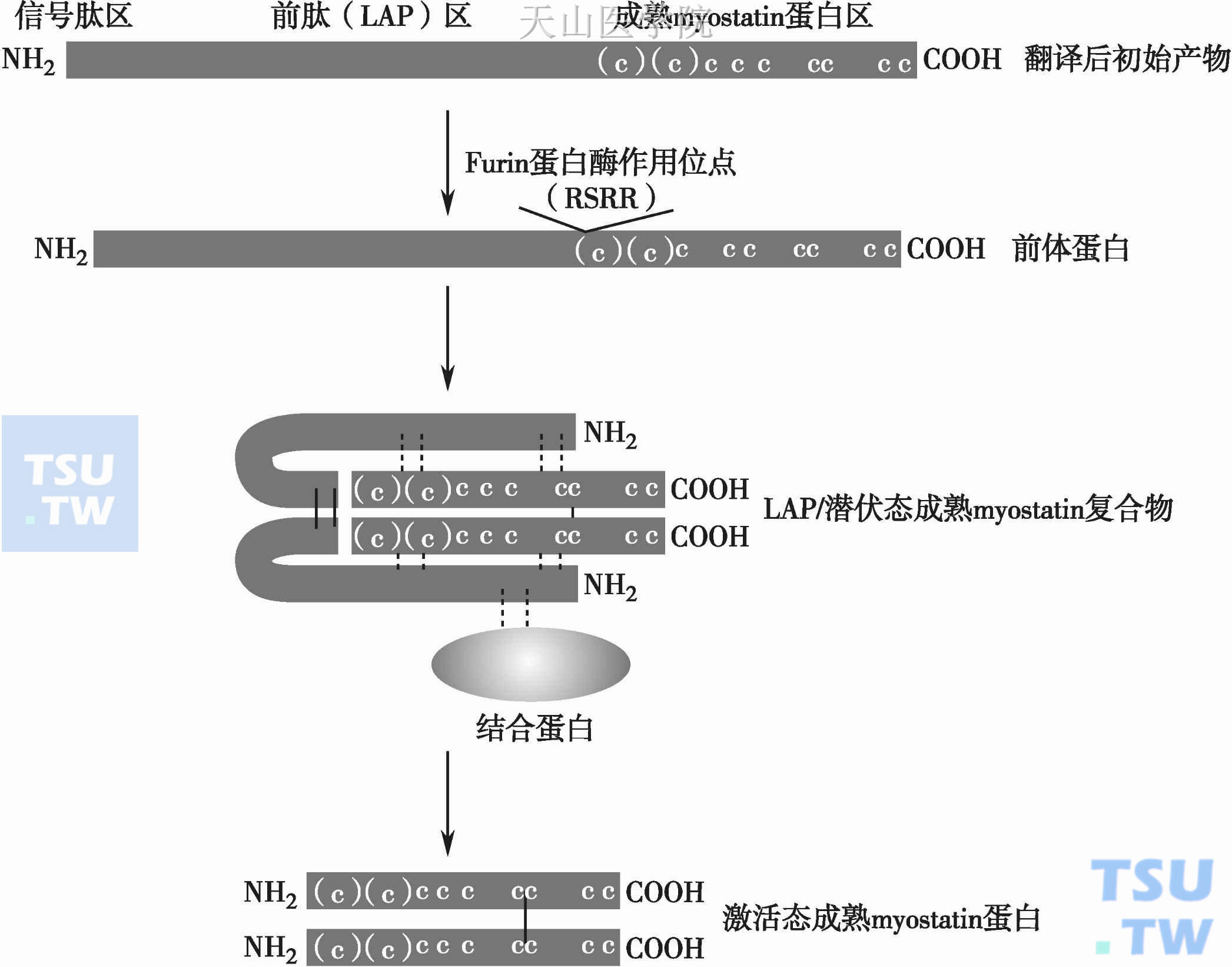
图2-13-1 Myostatin的加工成熟过程
