病例与思考
患者,男性,39岁,2013年9月5日因“咳嗽喘憋3个月,厌食伴恶心1个月”为主诉入院。2013 年6月初患者无诱因出现咳嗽、喘憋、呈进行性加重,左侧胸痛,无咳痰,无咯血,未予重视。8月2日于我院门诊查胸部CT提示左肺下叶占位,纵隔多发淋巴结肿大;遂行CT引导下穿刺活检,病理:左肺下叶小细胞肺癌。近一月患者情绪极度低落,抑郁倾向,出现厌食伴恶心,体重降低约15kg。体格检查:身高:170cm;体重:50kg;脉搏:76次/分;呼吸:18次/分;血压:96/64mmHg;ECOG:2分。患者皮肤干燥、苍白,无黄染,双眼凹陷,皮肤褶皱明显,皮下脂肪明显减少,左锁上淋巴结可触及肿大、质硬、活动差、无压痛,左肺下部呼吸音明显减弱,心律齐,心率76次/分,左侧第5、6肋压痛(+),肋骨分明,可见心尖搏动,肝脾未触及肿大,腹部压痛(-),双下肢无水肿。
- 除对左肺小细胞肺癌的治疗外,我们还应针对给予患者何种治疗?
- 试述大麻素治疗肿瘤恶液质的机制?
- 大麻素临床应用的前景如何?受到哪些因素的限制?
概述
大麻素(cannabinoids),又称大麻类物质,是大麻植物中含有烷基(alkylresorcinol)和单萜基团分子(terpenophenolics)结构的一类化合物。根据大麻素的来源可将大麻素类物质分成三类:一类是从植物中提取的活性成分,数量很多,其中最重要的是Δ9-THC (THC,tetrahydrocannabinol,屈大麻酚);二是内源性大麻素配体;三是人工合成的大麻素,包括一些大麻素受体-1(cannabinoid receptor1,CBl受体)和大麻素受体-2(cannabinoid receptor2,CB2受体)激动剂和拮抗剂。THC能够通过哺乳动物大脑中的CB1和免疫细胞中的CB2受体,行使诸如调节免疫功能、止痛、镇静、镇吐等多种功能。
三分之二以上的晚期肿瘤患者存在厌食和恶液质。厌食或进食减少是肿瘤恶液质重要的先兆之一。普遍认为食欲及体重增加是大麻素及其衍生物治疗有效的标志,其活性成分为屈大麻酚。屈大麻酚 (在美国)和大麻隆 (nabilone,在加拿大)用于治疗肿瘤患者化疗相关严重呕吐已多年,很多研究证实了THC治疗化疗诱导的恶心呕吐的疗效。两个开放性研究结果显示THC可改善患者情绪及食欲,但体重无显著增加。一项在139例艾滋病恶液质患者中对口服THC2.5mg 一日两次与安慰剂进行的随机、对照研究表明屈大麻酚可显著改善食欲、心情并减少恶心症状,但无体重增加。有关屈大麻酚在临床上治疗肿瘤恶液质的研究尚需前瞻性、双盲对照的大型临床试验。
内源性大麻素系统及其作用机制
内源性大麻素系统简介
大麻素受体与其内源性激动剂和拮抗剂共同构成了内源性大麻素系统。内源性大麻素递质系统包括多种受体。其中有两种大麻素受体已经被肯定,分别是CB1受体和CB2受体。基因克隆研究发现CB1和CB2受体有44%的氨基酸序列同源。人类与大鼠的CB1受体氨基酸序列有97.3%同源,相对分子质量大约为52 800左右。CB1、CB2受体都是G蛋白偶联受体。过去认为,CB1受体主要位于脑、脊髓与外周神经系统中,脑内CB1受体主要分布于基底神经节(黑质、苍白球、外侧纹状体)、海马CA锥体细胞层、小脑和大脑皮层。而CB2受体主要分布于外周,如脾脏边缘区、免疫细胞、扁桃体等。然而,最新研究发现大脑内也有CB2受体,在外周组织中也有CB1受体发挥功能。
内源性大麻素与食物摄入
内源性大麻素是脂质介质,作用于膜G蛋白偶联受体CB1。外源性大麻素的主要成分屈大麻酚可激活CB1。通过酶分解膜磷脂前体、卵磷脂及磷脂酰乙醇胺可获得内源性大麻素。中枢系统大麻素合成于突触后轴突末梢,作用于突触前轴突末梢的CB1受体。通过这种方式,内源性大麻素系统调节离子通道活性和神经递质的释放,进而调控突触效能,产生显著的生理变化包括食欲刺激。
近年来发现内源性大麻素及其受体CB1参与能量摄入。下丘脑内源性大麻素及其CB1受体通过瘦素介导的神经通路调节体内能量平衡。啮齿类动物及人类的内源性大麻素系统可刺激食欲及食物摄入。在大脑中,大麻素与阿片介导的奖赏通路存在相互作用,例如选择性CB1受体拮抗剂SR141716和阿片受体拮抗剂纳洛酮对食物摄入具有协同作用。此外,大麻素类物质具有镇痛作用。目前认为大麻素调节食物摄入的作用仅通过中枢大麻素信号系统。Osei Hyiaman等研究显示内源性大麻素系统可通过外周代谢作用影响磷脂代谢及体内能量平衡。
内源性大麻素治疗肿瘤恶液质机制
肿瘤恶液质标志性变化包括细胞因子和脂质代谢因子产生增加以及蛋白质水解增多。大麻素通过下丘脑的瘦素神经通路刺激食欲和食物摄入(图10-10-1)。研究发现大麻素能够刺激脂肪生成。肝脏内源性大麻素水平在接受高脂饮食的啮齿类动物中显著升高,并伴随脂肪酸合成活性增加。因此,内源性大麻素可能是增加肿瘤恶液质患者食欲及外周能量储备的完美治疗方法。
研究显示CB1受体激活剂HU210或植物性屈大麻酚通过激活CB1受体活化转录因子SREBP1c、上调脂肪合成酶ACC1和FAS表达。有趣的是,脂连素(adiponetcin)是一种由脂肪组织产生的抗炎肽激素,它能够与受体结合通过AMP激活的蛋白激酶途径(AMP-activated protein kinase,AMPK)来刺激肌肉的葡萄糖利用和游离脂肪酸的氧化,增加糖摄取及肌细胞乳酸生成并抑制肝糖原生成。脂连素介导的葡萄糖分解代谢可降低体内葡萄糖水平,增加靶组织的胰岛素敏感性。此外,脂连素刺激脂肪酸氧化,抑制新生脂肪细胞分化。目前认为,SREBP1c调节脂连素合成,大麻素刺激SREBP1c基因表达并抑制AMPK。内源性或外源性大麻素激活CB1受体通过直接调节脂连素水平影响代谢。我们知道与脂肪组织比较,肝脏在调节脂肪再生成中起着更重要的作用。肝细胞表达功能性CB1受体,活化的CB1受体刺激脂肪合成基因(如编码SREBP1c、ACC1和 FAS的基因)的表达并增加脂肪酸再合成。此外,现认为下丘脑脂肪酸合成(FAS)抑制是导致厌食的原因,CB1受体激活可上调脂肪生成基因的表达。因此,CB1受体激活不仅刺激食欲,而且促进脂肪生成和能量储备。
大麻素在肿瘤患者中的应用
止吐
1972年研制的大麻隆是一种人工合成的大麻素,具有止吐作用。两项研究表明大麻隆具有抑制细胞毒性化疗药物引起的呕吐作用,但是大麻隆具有显著的精神类不良反应,因此限制了其临床应用。左南曲朵(Levonantradol)是另一种人工合成大麻素,具有止吐作用,同样开放性研究表明精神类不良反应及低血压是其限制性毒性。屈大麻酚通过激活CB1受体发挥止吐作用。目前,一项大型临床研究表明屈大麻酚具有抑制化疗诱导恶心呕吐的作用。1972年大麻素被批准应用于止吐治疗。屈大麻酚可抑制化疗引起的中度呕吐,但对高剂量顺铂引起的呕吐效果欠佳。屈大麻酚对于接受中度致吐化疗的患者疗效优于低剂量盐酸甲氧氯普胺。屈大麻酚因在老年患者中经常引起生理及精神方面不良反应,所以在年轻人中可能发挥更好的止吐作用。大麻素与甲氧氯普胺合用可能降低大麻素的不良反应并增加疗效。目前推荐屈大麻酚2.5~5mg口服用于治疗化疗引起的恶心及呕吐。由于新型止吐药物的出现,大麻素仍为四线止吐药物。
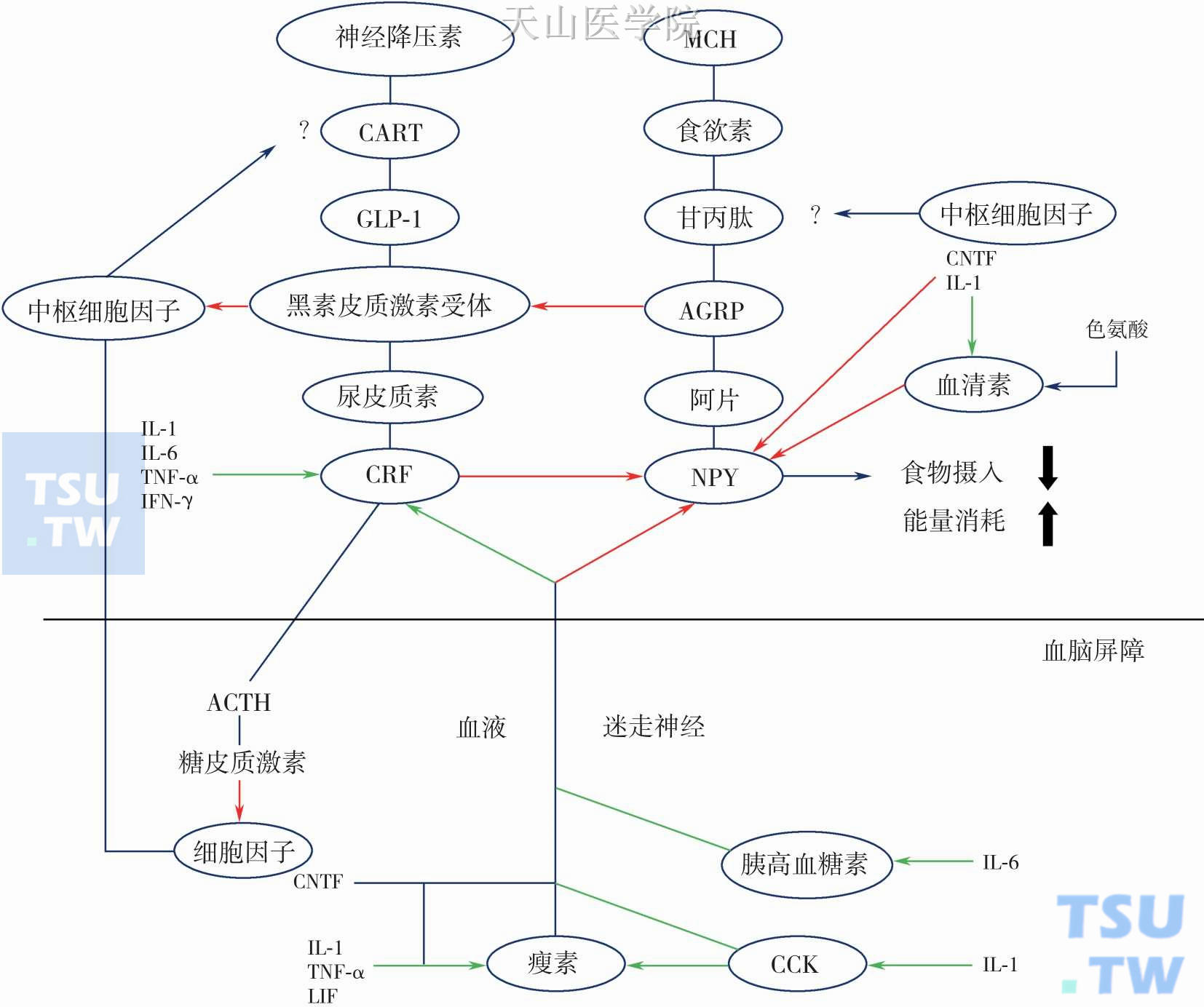
图10-10-1 下丘脑神经肽通路对癌症厌食-恶液质的反应模型
瘦素是维持脂肪持续储存的反馈环的一部分,作为下丘脑神经肽通路的下游调节食物摄取和能量消耗。负瘤状态下,影响恶液质因素如细胞因子(结构类似瘦素)的释放影响体内能量平衡,这些介质作用于下丘脑导致厌食和抑制体重增加。(绿色箭头表示促进,红色箭头表示抑制)AGRP,Agoutirelated peptide,刺豚鼠相关肽;MCH,melanin-concentrating hormone,黑色素聚集激素;CART,cocaine-and amphetamine-related transcript,可卡因-苯丙胺调节转录肽;GLP-1,glucagon-like peptide-1(7-36)amide,胰高血糖素样肽-1(7-36)酰胺;(CCK,cholecystokinin,胆囊收缩素;IL-1,interleukin-1,白细胞介素-1;IL-6,interleukin-6,白细胞介素-6;TNF-α,tumor necrosis factor-alpha,肿瘤坏死因子-α;IFN-γ,Interferongamma,干扰素-γ;CNTF,ciliaryneurotrophic factor,睫状神经生长因子;ACTH,adrenocorticotropichormone,促肾上腺皮质激素
刺激食欲
关于大麻素刺激食物摄入的报道很多,其中3项研究(表10-10-1)评估了进展期肿瘤相关厌食患者口服屈大麻酚对食欲的影响。在一项屈大麻酚的双盲研究中,9例住院患者(平均年龄54岁)被分入三个治疗剂量组以便评价食欲、体重增加及毒性。最低剂量(0.1~0.12mg/kg,一日四次)是唯一可耐受而无精神方面剂量限制性不良反应的剂量。另一项屈大麻酚开放性平行研究显示18例可评估患者(平均年龄64岁)中13例患者食欲增加,其中屈大麻酚2.5mg、一日三次、饭后1小时口服(60岁以上患者起始剂量为一日二次,若耐受良好则2日后增加至一日三次)。其中4例出现精神方面不良反应,食欲增加与药物引起的欣快感无关。其他研究认为低剂量和定时给药是预防显著不良反应的关键。屈大麻酚的止吐作用在一项AIDS患者中的随机、双盲、安慰剂对照研究中得到印证。
表10-10-1 屈大麻酚相关食欲研究
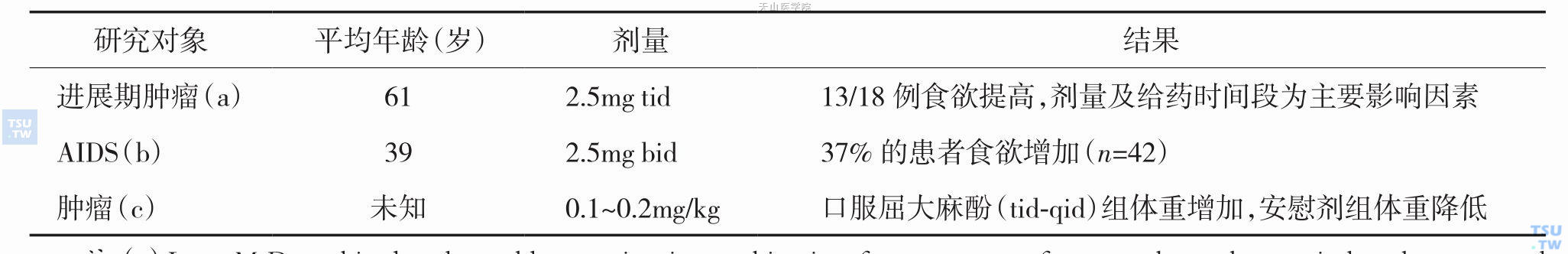
注:(a) Lane M.Dronabinol and prochlorperazine in combination for treatment of cancer chemotherapy-induced nausea and vomiting. (b) Beal JA. Appetite effect of dronabinol.(c) Regelson W.Delta-9-THC as an effective antidepressant and appetite-stimulating agent in advanced cancer patients
镇痛
一项慢性癌性疼痛的双盲研究比较了单独口服屈大麻酚10mg和20mg与可待因(60mg和120mg)的镇痛效果,发现20mg屈大麻酚口服与可待因(60mg和120mg)镇痛效果相当。
情绪影响
一项晚期肿瘤患者的抗抑郁/食欲研究显示,中等剂量屈大麻酚(15mg/d)对某些心理参数有积极作用,并且除1例被认为患有神志失常的患者外并未发现新的不良反应(表10-10-2)。
表10-10-2 进展期肿瘤患者服用屈大麻酚的不良反应

大麻素的安全性
急性不良反应
快感后伴随困倦,与屈大麻酚代谢物11-羟基屈大麻酚(11-hydroxy-THC)水平呈正相关。精神不良反应变异很大,并且在吸食大麻的患者中更为明显。
慢性不良反应
在牙买加(大麻吸食合法并广泛应用)的一项研究中对比30例大麻吸食者与30例非吸食者,两组患者未发现显著的生理异常。另一项在哥斯达黎加(存在大麻滥用)工厂关于74例大麻食用者与149例对照患者生产力的研究未发现差异。平均食用年限为10年,每周至少3次。希腊一项针对滥用hashish(大麻提取物)研究,平均吸食23年、2~6ghashish、2~3次/日,显示研究组(n=40)和对照组(n=40)的支气管炎、肺气肿、牙齿破损、血压、心脏停搏、中枢/外周神经系统异常、心电图及第三脑室大小无显著差异;仅研究组38%患者出现精神异常,而对照组只发生了17%,存在差异。
目前,大麻素在肿瘤恶液质患者中的应用暂无统一标准,存在很多不同的观点,在临床上的应用还有待于大规模循证医学研究提供可靠数据支持。
思考题答案
大麻素急性不良反应首先为心律持续增快,但血压保持稳定或轻度降低。此外,还观察到关节变红和肌力降低。但对瞳孔大小、呼吸频率及深肌腱反射无影响。精神方面不良反应呈双相,即初期欣
1. 患者目前存在厌食、食欲降低、恶心呕吐、抑郁倾向症状,需针对上诉症状给予治疗。为减少患者服药种类,最好选择对上述症状均有效的药物,故可考虑给予患者大麻素类药物。
2. 大麻素通过下丘脑的瘦素神经通路刺激食欲和食物摄入。CB1受体激活剂HU210或植物性屈大麻酚通过激活CB1受体活化转录因子SREBP1c、上调脂肪合成酶ACC1和FAS表达。脂肪细胞来源的激素-脂连素通过AMPK(AMP-activated protein kinase)途径的活化,增加糖摄取及肌细胞乳酸生成并抑制肝糖原生成。脂连素介导的葡萄糖分解代谢可降低体内葡萄糖水平,增加靶组织的胰岛素敏感性。此外,脂连素刺激脂肪酸氧化,抑制新生脂肪细胞分化。目前认为,SREBP1c调节脂连素合成,大麻素刺激SREBP1c基因表达并抑制AMPK。内源性或外源性大麻素激活CB1受体通过直接调节脂连素水平影响代谢。肝细胞表达功能性CB1受体,活化的CB1受体刺激脂肪合成基因(如编码SREBP1c、ACC1和 FAS的基因)的表达并增加脂肪酸再合成。此外,现认为下丘脑脂肪酸合成(FAS)抑制是导致厌食的原因,CB1受体激活可上调脂肪生成基因的表达。因此,CB1受体激活不仅刺激食欲,而且促进脂肪生成和能量储备。
3. 大麻素类药物具有止吐、刺激食欲、镇痛及调节情绪的作用,而上述症状正是治疗肿瘤恶液质要亟待解决的问题。因此,大麻素有较好的临床应用前景。但是,自20世纪70年代至今,大麻素并没有广泛应用于临床,其主要限制因素为精神方面的不良反应。
(高伊娜 陈公琰)
