肿瘤作为宿主体内的真性寄生物,需依赖其宿主而生长,并在生长过程中与宿主竞争有限的蛋白质。由于肿瘤独特的代谢特点,即使外源性蛋白质供给不足,或机体合成蛋白质过程受限,肿瘤仍能在蛋白质利用方面优先于其他组织。若肿瘤对蛋白质的要求超出内源性及外源性供给,则会出现低蛋白血症、负氮平衡、恶液质等。
肿瘤患者肌肉减少的主要原因是肌纤维蛋白,尤其是肌球蛋白重链的加速降解,其次是蛋白质合成的减少。这其中,蛋白质降解主要通过泛素-蛋白酶体途径。靶蛋白与泛素共价结合,泛素化的蛋白被转运至蛋白酶体,随即依次被水解成短肽和游离氨基酸。炎性因子如TNF-α、IL-6,激素如皮质醇、血管紧张素、活性氧等均可促进泛素-蛋白酶体途径蛋白质降解的发生发展。实验表明,在健康大鼠体内注入TNF-α,编码泛素的基因表达上调,游离泛素及结合泛素的含量同时增高,蛋白质水解进程加快。在人体实验中也发现相似结果。在肿瘤发生过程中,TNF-α表达增加,与TNF-α受体结合后激活下游通路,导致NF-κB的激活,iNOS蛋白生成随之增加,iNOS在代谢过程中释放出NO,而可诱导产生肌肉减少的多个途径均为NO依赖型。提示TNF-α在肿瘤肌肉减少中起着重要的促进作用。除TNF-α外,另有细胞因子IL-6、IL-gama亦参与了泛素基因的表达上调。除蛋白质方面的改变外,肿瘤状态时肌细胞DNA降解亦加速,导致了凋亡的肌细胞数量增多。
肿瘤导致的肌肉减少症,在很大程度上可归结为恶液质导致的肌肉减少。恶液质是与原发疾病密切相关的,表现为明显的肌肉减少,伴或不伴脂肪减少的代谢综合征。大部分恶液质患者可描述为肌肉减少症,而大部分肌肉减少症患者并不属于恶液质,两者的关系见图6-1-5。
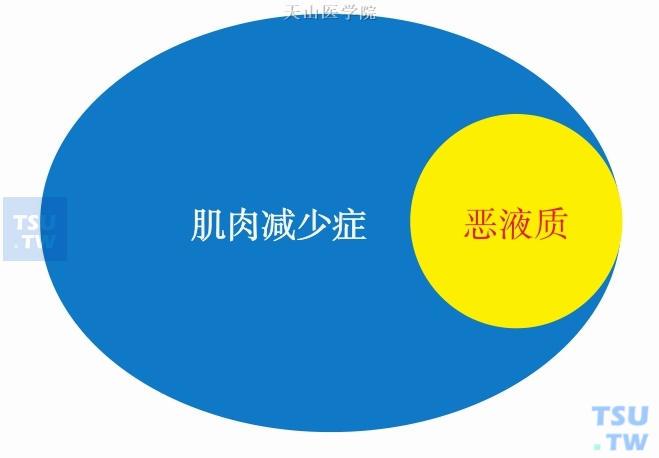
图6-1-5 肌肉减少症与恶液质的从属关系
恶液质的诊断标准如表6-1-4所示。
表6-1-4 恶液质的诊断标准

区分恶液质与其他类型的肌肉减少症,其核心在于探明导致肌肉减少的因素是否以炎症为主,也就是说,炎性反应在恶液质的发生中起到了举足轻重的作用。恶液质的发生是源于促炎因子的过量释放,而这些促炎因子可加速肌肉蛋白的分解,从而导致肌肉减少。在其他类型的肌肉减少症中,如长期卧床引起的肌肉减少,虽然其症状相似,但失用性肌肉减少由于缺乏相应的促炎因子的过量释放,并不伴随明显的肌肉蛋白分解加速,而是表现为肌肉蛋白的合成减缓。
