再喂养综合征(refeeding syndrome,RFS)最早于20世纪40年代由Burger等人定义,他们报道了第二次世界大战时期战俘和集中营幸存者,部分人在摄入高糖饮食之后迅速出现水肿、呼吸困难和致死性心力衰竭。20世纪70年代发现部分接受全肠外营养(total parenteral nutrition,TPN)的患者出现类似的症状,随后观察到慢性营养不良病例,如糖尿病高渗状态、神经性畏食、酗酒、营养不良老年患者,在营养治疗的早期阶段也出现类似的临床表现。
流行病学
RFS发病率在所有成年住院患者为0.8%,恶性肿瘤患者为24.5%,TPN治疗患者为42%。Flesher等调查了51例住院时间9个月以上的肠内营养患者,治疗期间低磷或低钾或低镁血症发生率在高危人群为93%,普通人群则为74%,可见识别RFS的高危人群具有实际意义。观察发现当患者合并以下情况时,营养治疗过程中容易发生RFS。这些危险因素都与营养代谢异常有关,包括:
- 营养物质摄入减少,如长期低热饮食或禁食或绝食、神经性畏食、异嗜症、偏食、老年抑郁;
- 营养物质吸收障碍,如酗酒、吸收不良综合征、吞咽障碍、炎性肠病,以及采用十二指肠转流术治疗肥胖;
- 营养物质代谢障碍,如病态肥胖、难治性糖尿病;
- 营养物质消耗增多,如恶性肿瘤(特别是化疗阶段)、腹部手术、艾滋病、肺结核,体重下降(1个月内下降>5%,或3个月内下降>7.5%,或6个月内下降>10%);
- 其他,如长期呕吐、腹泻、胃肠减压、利尿剂治疗、肺部疾病如肺炎。上述危险因素当中,以长期饥饿患者RFS发生率最高,饥饿状态超过7~10天,就有可能发生RFS。
饥饿和营养治疗时期的代谢特征
RFS的定义就是机体经过长期饥饿或营养不良,重新摄入营养物质导致以低磷血症为特征的电解质代谢紊乱及由此产生的一系列症状。饥饿时期,碳水化合物摄入减少,胰岛素分泌相应下降,同时伴随胰岛素抵抗,分解代谢多于合成代谢,导致机体磷、钾、镁和维生素等微量元素的消耗,然而此时血清磷、钾、镁浓度可能正常。重新开始营养治疗,特别是补充大量含糖制剂后,血糖升高,胰岛素分泌恢复,胰岛素作用于机体各组织,导致钾、磷、镁转移入细胞内,形成低磷血症、低钾血症、低镁血症;糖代谢和蛋白质合成的增强还消耗维生素B1。RFS的这种代谢特征,通常在营养治疗后3~4天内发生。
低磷血症
低磷血症是RFS的主要特征,而补磷是RFS的主要治疗手段。对于RFS而言,低磷血症的定义是指血液中的无机磷浓度低于0.5mmol/L。饥饿期间,细胞内磷酸盐浓度下降;RFS发病过程中,磷在胰岛素作用下向细胞内转移,实际上使细胞内的磷含量及其产物增加,例如再喂养过程中心肌和骨骼肌ATP、ADP、磷酸肌酸激酶(creatinephosphokinase,CPK)含量并未下降,而且尚无报道单纯的血磷降低对机体有任何影响,那么低磷血症通过什么机制导致RFS症状呢?笔者认为包含以下方面:①磷是细胞遗传物质和糖代谢中间产物、高能磷酸键产物的组成部分,营养治疗期间细胞增殖、糖代谢恢复,对磷的需求增加,导致细胞内磷酸盐浓度在营养治疗期间进一步下降,合成磷脂减少,影响细胞膜的稳定性,临床上表现为肌膜崩解、横纹肌溶解,以及红细胞脆性增加、溶血性贫血。②胰岛素促进细胞摄磷主要发生在肝脏,其次是骨骼肌,而磷进入红细胞依赖血磷浓度形成的梯度,低磷血症使得红细胞内磷及2,3-二磷酸甘油酸酯(2,3-diphosphoglycerate,2,3-DPG)消耗殆尽,血红蛋白氧和曲线左偏,影响心肌、神经等组织供氧。③严重低磷血症如果不通过饮食或骨质吸收补充磷,就会导致代谢性酸中毒,后者可以消耗细胞内的ATP、2,3-DPG,并促使磷向细胞外移动。
低磷血症是RFS的主要病理生理特征,据Subramanian等报道,42%的低磷血症患者未得到相应的治疗,说明有必要提高临床工作者对这一疾病认识。
低钾血症
低钾血症是RFS致死的主要原因。钾是细胞内主要的阳离子,维持细胞膜电位。饥饿期间,机体总钾含量通过尿液排泄逐渐消耗;营养治疗期间,胰岛素和葡萄糖通过Na+-K+-ATP泵使钾离子向细胞内转移,导致低钾血症和部分细胞内钾离子和负电荷增多,细胞膜超极化,表现为神经肌肉系统出现瘫痪、麻痹、呼吸抑制、肌无力症状,消化道出现肠麻痹、便秘症状。营养治疗使细胞内ATP浓度增高,导致复极化钾外向电流(ATP敏感性钾通道)减弱,细胞不应期延长,诱发房性期前收缩或室性期前收缩,甚至心搏骤停而导致患者死亡。细胞复极化延迟和部分细胞内(如快收缩肌纤维)低钾状态的持续抑制了钾的释放,使得肌肉细胞收缩时血管扩张和供血不足,与红细胞供氧能力下降一并导致横纹肌溶解。
低镁血症
镁也是细胞内主要的阳离子之一,机体骨骼外镁储量的99%位于细胞内。除了胰岛素和葡萄糖,氨基酸也可促使镁进入细胞,所以即使严格控制营养的总能量,RFS低镁血症发生率仍高达60%。细胞内镁离子积聚,抑制钙离子进入细胞:①导致心肌和血管收缩能力降低,使营养治疗患者发生低血压、充血性心力衰竭;②抑制心肌细胞的电传导,与低钾血症共同诱发心律失常如室性心动过速和QT间期延长;③导致神经突触释放乙酰胆碱减少,出现肌无力症状。细胞内镁离子浓度升高还可促进钾离子内流(通过Na+-K+-ATP泵)并抑制外流,加剧细胞的超极化和肌无力等症状。细胞外镁离子的突然下降可致血管一过性舒张,然后进入持续性收缩状态,这一过程加剧低钾血症导致的血管收缩和组织缺血缺氧。
维生素B1(VitB1)缺乏
机体处在饥饿条件下,细胞内VitB1逐渐消耗。营养治疗期间,补充葡萄糖后,因缺乏VitB1,丙酮酸不能进入三羧酸循环,导致乳酸大量生成;补充氨基酸后,因缺乏VitB1,蛋白合成受阻,血支链氨基酸增多,其生酮、氧化途径亦增强,在缺乏VitB1双磷酸盐(thiamine diphosphate,TDP)条件下,酮体脱羧、脱氢反应受阻,加剧乳酸的积聚和代谢性酸中毒,导致呼吸衰竭、充血性心力衰竭和内侧丘脑功能受损。VitB1是胆碱酶抑制剂,营养治疗阶段,机体对VitB1需求增多(主要是肝脏摄取)、储量消耗,导致神经系统VitB1缺乏,乙酰胆碱分解增多,神经传导受阻,表现为上升性对称性感觉、运动、反射障碍和记忆障碍,如麻痹、肌痛、Wernicke脑病。
循环充血
饥饿期间,长期低血容量、细胞内ATP耗竭导致心脏萎缩、心动过缓、搏出量降低。营养治疗期间,高血糖、高胰岛素血症、低磷血症、代谢性酸中毒、补液过度导致水钠潴留、循环充血,然而由于磷总量消耗、心肌细胞ATP合成相对不足,心功能失代偿,出现体循环和肺循环衰竭的症状。
综上所述,RFS的代谢特征可以简洁地概括为:重新进食后血糖升高,胰岛素分泌增加,导致的“四低一高”综合征,即:低磷血症、低镁血症、低钾血症、低维生素B1、高组织灌流,与胰岛素分泌、电解质转移和合成代谢增强有关(图11-5-1)。
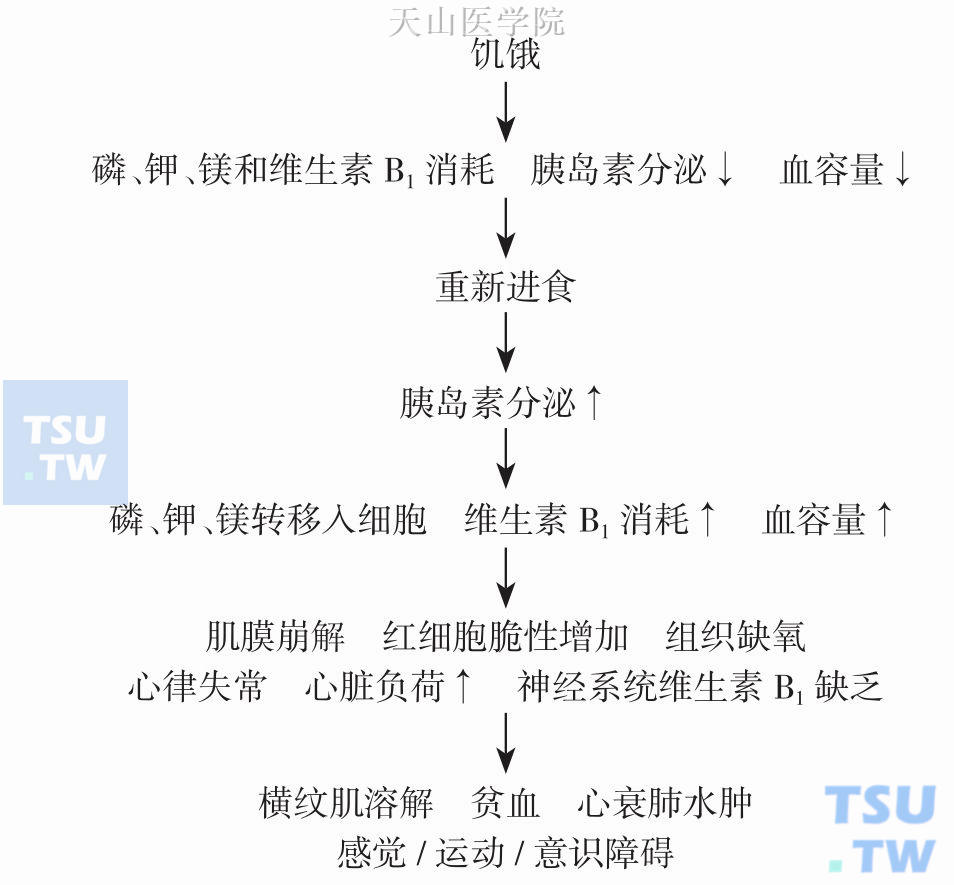
图11-5-1 RFS发病机制
临床表现、诊断和鉴别诊断
RFS的电解质代谢紊乱和心血管系统并发症通常在再喂养开始一周内发生,而神经症状通常在这些变化之后出现。主要症状:①循环系统,心律失常、急性心力衰竭、心搏骤停、低血压及休克;②呼吸系统,呼吸肌无力、呼吸困难,甚至呼吸衰竭。③神经系统,麻痹、瘫痪、手足抽搐、震颤、深肌腱反射抑制、谵妄、幻觉及Wernicke脑病;④消化系统,腹泻、便秘及肝功能异常;⑤血液系统,血红蛋白氧和能力增高、脓毒症(继发于白细胞功能障碍)、出血倾向及溶血性贫血;⑥代谢系统,代谢性酸中毒;⑦泌尿系统,急性肾小管坏死(继发于横纹肌溶解);⑧运动系统,肌痛、肌无力及横纹肌溶解。笔者搜集近年RFS病例报道,这些症状按发生率排列依次为:肌无力(19例)、腹泻(16例)、感觉异常(11例)、心动过速(6例)、轻度的呼吸困难(3例)、肝功能异常(2例)、肢体麻痹(2例)、谵妄(2例)、横纹肌溶解(2例)、肌痛(1例)、便秘(1例)、四肢瘫痪(1例)、辅助通气时间延长(1例)、心搏骤停(1例)。可以看出,RFS症状缺乏特异性,临床工作中常被忽视。
诊断RFS的关键在于鉴别出前述的RFS高危人群,其营养不良应持续1周以上。当这些患者在营养治疗期间发生前述列举的循环系统、呼吸系统、神经系统症状时,就应行血生化检查,血磷浓度<0.50mmol/L即可做出诊断并开始补磷等治疗,当血CPK活性超过正常上限的1.5倍,可以诊断横纹肌溶解。此外,还应进行心电图检查、神经系统检查以评估病情、协助诊断。
RFS鉴别诊断:很多疾病也会合并低磷、低钾、低镁、维生素B1缺乏,如未控制的糖尿病、碱中毒、脓毒症、酗酒、手术、腹泻、呕吐、肝硬化、皮质激素、胰岛素、β受体拮抗剂、利尿剂等药物使用、高钙血症、Fanconi综合征。其中很多疾病是RFS的高危因素,可与RFS同时存在。
防治方法
根据欧洲临床营养杂志2007年发表的指南及其他文献报道,营养治疗时期可采取以下预防措施减少RFS发生率(表11-5-1)。
表11-5-1 RFS预防方案

续表

如果营养治疗期间出现RFS电解质代谢紊乱,可以按照Amanzadeh及欧洲指南提供的方案治疗(表11-5-2),能量、液体量、复合维生素、维生素B1补充量同表11-5-1第4~6天。
表11-5-2 RFS治疗方案

因成人血磷的正常范围较小(0.8~1.4mmol/L),补磷时应注意副作用,包括低钙血症和抽搐、低血压、高磷血症、高钾血症(使用磷酸钾时)、高钠血症(使用磷酸钠时)、转移性钙化、腹泻(口服时发生较多),其中低钙血症报道较多。据Amanzadeh报道,血磷水平在0.3mmol/L以下患者静脉补磷酸盐0.32mmol/(kg•12h)或15mmol/h,血磷水平在0.5~0.6mmol/L之间患者静脉补磷酸盐45mmol/24h 或15mmol/2h是安全而且有效的。欧洲指南制订剂量的范围较大,为静脉补磷酸盐30~50mmol/12h,磷酸盐制剂浓度<0.6mmol/L。补钾期间应检测心电图,补镁期间应注意膝腱反射。
总结
某些研究认为发生低磷血症的老年患者住院期间,其住院时间将延长,住院期间死亡率增加3倍,长期生存率也将下降。但是许多医生对RFS的重视还是很不够,而且到目前为止,在国际上还没有制定出相应的治疗指南。所以,在治疗潜在出现RFS的高危人群时,尤其是当持续营养不良超过1周以上,我们应该进行必要的检查,通过补磷、补充维生素B1等方法预防和治疗往往可以取得很好的效果。
(孙冠青 石汉平 薛聪龙)
