总抗氧化能力检测
在较低pH值环境下,三价铁复合物Fe3+-三吡啶三吖嗪(ferric-tripyridyl-triazine,Fe3+-TPTZ)可被还原剂还原为二价铁形式,呈现出明显的蓝色,并在593nm具有最大光吸收。这一反应中,众多的抗氧化剂可以作为还原剂。在Fe3+-TPTZ过量的情况下,检测蓝色产物的生成映可以反映待测样品的还原能力,也就是总抗氧能力。根据本法的测定原理,测定结果以FRAP(ferric reducing ability of plasma)表示。
总抗氧化能力检测所使用的仪器为分光光度计。
试剂
- 0.3mol/L醋酸盐缓冲液(pH3.6):称取3.1g C2H3NaO2•3H2O,用适量双蒸水溶解,加入16ml冰乙酸,定容至1L。
- 10mmol/L TPTZ(2,4,6-trpyridyl-s-triazine):用40mmol/L HCl配制。
- 20mmol/L FeCl3。
- FRAR工作液:用前临时配制。将25ml醋酸盐缓冲液、2.5ml TPTZ溶液、2.5ml FeCl3溶液混合。
- 0.1~1mmol/L FeSO4标准液。
步骤
- 将300μl新鲜配制的FRAR的工作液预温至37℃,于593nm读取吸光度值(M1)。
- 加入10μl待测样品、30μl双蒸水,混匀。
- 准确反应4min后,测定593nm吸光度值(A)。
- 各吸取10μl不同浓度的FeSO4标准液,替换样品液依上述步骤操作,测定各管的吸光度值。
结果计算
- 各管净吸光度变化值的计算:ΔA=A-M1。
- 以FeSO4标准液的浓度(也是Fe2+的浓度)为X轴,以对应的ΔA值为Y轴,绘制标准曲线,计算直线回归方程。
- 将样品测定值(ΔA)代入直线方程或直接由标准曲线求得对应的Fe2+浓度。
注意事项
- 本法操作简便,测量过程迅速,结果较为稳定(显色后30min内吸光度值无下降),适用于测定程序的自动化。
- 由于测定体系中Fe3+过量,且样品制备过程中加入过量的EDTA等螯合剂,样品中的Fe并不对测定结果造成影响。
- 不同的抗氧化成分在FRAR测定体系中的反应时间不同,为使反应较为完全,一般选择测定反应时间为4min。
- 本法与其他测定抗氧化能力的方法一样,由于是在体外进行测定,故结果不一定能够反映精液(精浆)的抗氧化能力。
超氧化物歧化酶检测(SOD)(黄嘌呤氧化酶-NBT还原法)
氯化硝基四唑氮蓝(NBT,简称氮蓝四唑)可被O2-•还原为蓝紫色的甲腙,在560nm处呈现最大光吸收。在SOD存在的条件下,O2-•因发生歧化反应而减少,对NBT的还原作用被减弱。因此,用比色法测定NBT还原产物可以间接地反映SOD的酶活力。本方法采用黄嘌呤氧化酶催化黄嘌呤底物作为O2-•产生体系,比色测定SOD对NBT的还原的抑制,并根据抑制率计算样品SOD的活力。
仪器也采用分光光度计。
试剂
- 0.2mol/L磷酸氢二钾溶液(甲液):称取9.13g K2HPO4•3H2O,双蒸水溶解并定容至200ml。
- 0.2mol/L磷酸二氢钾溶液(乙液):称取1.36g KH2PO4,用50ml双蒸水溶解。
- 0.2mol/L磷酸钾缓冲液(pH7.8):取甲液183ml,加乙液17ml混合而成。
- 0.4mol/L EDTA-NaOH缓冲液(pH7.8):称取乙二胺四乙酸(EDTA)1.49g,加双蒸水2~3ml,再加1mol/L NaOH溶液5ml,水浴加热溶解,最后定容至10ml。
- 10mol/L黄嘌呤,溶于0.1mol/L NH4OH内。
- 7.5mmol/L NBT,溶于20%乙醇。
- 混合底物缓冲液:各取上述3液135ml,4液0.188ml,5液4.5ml,6液3.75ml混合,最后加双蒸水补足至240ml。
- 黄嘌呤氧化酶,用时以50mmol/L磷酸钾缓冲液(pH7.8)配成0.04U/ml的溶液。
- SOD标准液:用20%乙醇配制成1mg/ml的储存液,用前稀释为10μg/ml。
步骤
- 未受SOD抑制管、测定样品管和SOD标准管均加入2.4ml混合底物缓冲液;其后待测样品液加入测定样品管;其后10μg/mlSOD标准液加入SOD标准管;再分别在未受SOD抑制管、测定样品管和SOD标准管加入双蒸水0.5ml、0.35ml、0.4ml。
- 各管加样后,置25℃恒温水浴预温5~10min,同时将黄嘌呤氧化酶溶液预温。
- 各留置25℃水浴中,每隔30s依次向各管加入预温的黄嘌呤氧化酶(0.04U/ml)0.3ml,各管于25℃水浴内作用12min后取出。
- 选定测试波长为560nm,以底物缓冲液校正零点,读取各管吸光度值。
SOD酶活力计算
- 单位定义:在以上规定条件下,NBT还原被SOD抑制50%所需的酶量为1U。
- SOD活性(μg/mg蛋白)=(AO-AU)/(AO-AS)×10×1/Cpr
- A0:未受SOD抑制的吸光度
- AU:测定样品的吸光度
- AS:SOD标准管的吸光度
- 10:SOD标准液的浓度10μg/ml
- Cpr:样品液的蛋白质浓度(mg/ml)
注意事项
- 若样品对NBT还原的抑制范围在35%~65%之间,基本上可按上式计算SOD的酶活力,超过此范围可适当浓缩或稀释样品液,再行测定。
- 测定过程中加入黄嘌呤氧化酶12min后,反应到达平台,在以后的30~60min内吸光度值无明显变化,故选取12min测定吸光度值。
- 温度对本法测定有影响,温度越高,到达对NBT还原抑制50%所需的SOD量越多,反应速率加大,吸光度值增加;而温度过低,测定的灵敏度下降。
- 用20%乙醇配制的SOD标准液,于4℃可保存1个半月。
- 待测样品不可混浊。NBT反应还受组织中其他蛋白质等杂质影响,因此测定生物组织样品中的SOD含量,其结果会受到影响。
谷胱甘肽检测
还原型谷胱甘肽(GSH)的含量,是机体细胞(包括精子)抗氧化能力的一个重要指标,测定GSH的含量在多数氧化与抗氧化研究中十分必要。GSH的氧化产物是氧化型谷胱甘肽(GSSG),GSSG的增多也间接地说明氧化应激的存在。实际上,常用GSH/GSSG的比值来衡量组织或细胞氧化损伤的程度。常用Beutler改良法。
原理:DTNB能被-SH基团还原,产生等克分子2-硝基-5-巯基苯甲酸。硝基巯基苯甲酸阴离子呈黄色,在可见光412nm波长处有吸收峰,可用于测定巯基。
仪器:分光光度计
试剂
- 5%三氯醋酸
- 0.1mol/L磷酸盐缓冲液,pH8.0
- 1%柠檬酸钠
- 1mmol/L GSH
- DTNB试剂:0.04%,用1%柠檬酸钠配制。
步骤
- 绘制标准曲线:分为0、20、40、60、80、100梯度,依次加入1mmol/L GSH、双蒸水、0.1mol/L磷酸盐缓冲液、DTNB试剂,混匀,5min内412nm比色,以双蒸水调零。以标准GSH溶液浓度为X轴,相应的吸光度为Y轴,绘制标准曲线,并求得回归方程。
- 组织样品提取:取新鲜的睾丸组织,用0℃生理盐水漂洗,滤纸吸干水分,称重,按组织:5%三氯醋酸(0℃)(1∶5)的比例制成匀浆,3000g×15min离心,收集上清液待测。
- 测定:在测定管和空白管中分别加入0.1ml上清液,其后在测定管中加入DTNB试剂0.5ml,最后空白管加入0.5ml双蒸水,混匀,5min内,412波长处读光密度。
结果计算
将测得的样品液吸光度值代入直线回归方程,可计算出样品液的GSH浓度,或由标准曲线上查的样品GSH含量。对于组织而言,单位以μg/100mg组织表示。
注意事项
- GSH标准曲线重复性很好,可重复使用。
- GSH可以与包括蛋白质巯基在内的所有含巯基物质反应。用5%三氯醋酸制取组织匀浆的目的在于使蛋白质变性沉淀,并经离心除去,离心后的上清液中所含的巯基为非蛋白质巯基。因此在样品制备过程中应注意对组织蛋白的沉淀,并控制离心条件以保证得到澄清的上清液,避免蛋白质巯基对测定的干扰。
- 当pH低于8.0时,测定反应产生黄色的深浅会随pH值不同而变化,而当pH在8.0~9.0之间时,显色较为稳定,因此反应管内混合液体的最终pH值必须保证在8.0以上。
- GSH可经酶促氧化成GSSG,因此未经去蛋白处理的组织不宜存放。组织取材后应尽快制成匀浆,进行去蛋白处理,组织匀浆上清液在-20℃可存放3d。GSH标准品也是易氧化物质,平时应密封置冰箱保存,使用时取出后应在室温下回温至试剂瓶外壁不吸附水蒸气后方可开盖。
- DTNB要在有效期内使用,并按要求保存。DTNB显色液较为稳定,4℃可以保存1个月。GSH浓度低时,显色较快,消退较快,浓度高时,显色较慢,消退较慢。
维生素C的含量测定(2,4-二硝基苯肼比色法)
总抗坏血酸包括还原型、脱氢型和二酮古乐糖酸,样品中还原型抗坏血酸经活性炭氧化为脱氢抗坏血酸,再与2,4-二硝基苯肼作用生成红色脎,其呈色强度与总抗坏血酸含量呈正比,可进行比色定量。
试剂
- 4.5mol/L硫酸:量取250ml浓硫酸小心加入700ml水中,冷却后用水稀释至1000ml。
- 85%硫酸:小心加900ml浓硫酸于100ml水中。
- 2%2,4-二硝基苯肼:溶解2,4-二硝基苯肼2g于100ml 4.5mol/L硫酸中,过滤。不用时存于冰箱内,每次使用前必须过滤。
- 2%草酸溶液。
- 1%草酸溶液。
- 1%硫脲溶液:溶解1g硫脲于100ml 1%草酸溶液中。
- 2%硫脲溶液:溶解2g硫脲于100ml 1%草酸溶液中。
- 1mol/L盐酸:取100ml盐酸,加入水中,并稀释至1200ml。
- 抗坏血酸标准溶液:称取100mg纯抗坏血酸溶解于100ml 2%草酸溶液中。
- 活性炭:将100g活性炭加到750ml 1mol/L盐酸中,回流1~2h,过滤,用水洗数次,至滤液中无铁离子(Fe3+)为止,然后置于110℃烘箱中烘干。
仪器:恒温箱或电热恒温水浴锅、分光光度计。
实验步骤(全部实验过程应避光)
- 称取0.1ml精浆(睾丸组织匀浆)倒入100ml容量瓶,用1%草酸溶液稀释至刻度,混匀。过滤,滤液备用。
- 样品还原型抗坏血酸的氧化处理:量取25.0ml上述滤液,加入2g活性炭,振摇1min,过滤,弃去最初数毫升滤液。吸取10.0ml此氧化提取液,加入10.0ml 2%硫脲溶液,混匀,此试样为稀释液。
- 呈色反应:①取3支试管,各加入4ml经氧化处理的样品稀释液。基中一支试管作为空白,向其余两试管加入1.0ml 2%2,4-二硝基苯肼溶液,将所有试管放入37℃±0.5℃恒温箱或恒温水浴中,保温3h。②3h后取出,除空白管外,将所有试管放入冰水中。空白管取出后使其冷到室温,然后加入2%2,4-二硝基苯肼溶液1.0ml,在室温中放置10~15min,后放入冰水内。其余步骤同试样。
- 85%硫酸处理:当试管放入冰水冷却后,向每一试管(连同空白管)中加入85%硫酸5ml,滴加时间至少需要1min,需边加边摇动试管。将试管自冰水中取出,在室温放置30min后比色。
- 样品比色测定:用1cm比色皿,以空白液调零点,于500nm波长测定吸光值。
- 标准曲线绘制:
①加2g活性炭于50ml标准溶液中,振动1min后过滤。吸取10.00ml滤液放入500ml容量瓶中加5.0g硫脲,用1%草酸溶液稀释至刻度。抗坏血酸浓度20μg/ml。吸取5,10,20,25,40,50,60ml稀释液,分别放7个100ml容量瓶中,用1%硫脲溶液稀释至刻度,使最后稀释液中抗坏血酸的深度分别为1,2,4,5,8,10,12μg/ml,为抗坏血酸标准使用液。
②分别吸取4ml各不同深度的抗坏血酸标准使用液,于7个试管中,吸取4ml水于试剂空白管,各加入1.0ml 2%2,4-二硝基苯肼溶液,混匀,将全部试管放入37±5℃恒温箱或恒温水浴中,保温3h。3h后将8个试管取出,全部放入冰水冷却后,向每一试管中加入5ml 85%硫酸,滴加时间至少需要1min,边加边摇。将试管自冰水中取出,在室温放置30min后,以试剂空白管调零,并比色测定。以吸光值为纵坐标,抗坏血酸含量(mg)为横坐标绘制标准曲线或计算回归方程。
结果计算
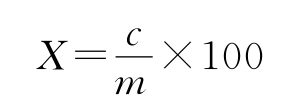
式中 X——样品中总抗坏血酸含量[mg/100g];
c——由标准曲线查得或由回归方程算得试样测定液总抗坏血酸含量(mg);
m——测定时所取滤液相当于样品的用量(g)。
计算结果表示到小数点后两位。
注意事项及说明
- 利用普鲁士蓝反应可对铁离子存在与否进行检验:将2%亚铁氰化钾与1%盐酸等量混合,将需检测的样液滴入,如有铁离子则产生蓝色沉淀。
- 硫脲的作用在于防止抗坏血酸的继续被氧化和有助于脎的形成。
- 加硫酸显色后,溶液颜色可随时间的延长而加深,因此,在加入硫酸溶液30min后,应立即比色测定。
- 检测过程中,测定样的吸光值不落在标准曲线上,可重新调整测定样品的量或标准曲线的浓度范围。
- 本实验法在1~12μg/ml抗坏血酸范围内呈良好线性关系,最低检出限为0.1μg/ml。
辅酶Q10测定
辅酶Q10(Coenzyme Q10,CoQ10)又称泛醌,是一种重要的脂溶性物质,存在于以人类为主的高级动、植物线粒体的内膜中,在呼吸链中起着传递氢体作用。它对许多酶具有激活作用,并能增加机体的免疫力。CoQ10同时也是机体内一种重要的抗氧化物质,具有天然的抗自由基氧化,防止细胞膜脂质过氧化反应、保持膜流动性的功能。CoQ10在氧化条件下可以醌的形式存在,在无氧条件下又可变成对苯二酚。通过这种氧化还原性结构的变换,CoQ10能阻止脂和蛋白质的氧化,清除自由基,抵抗外界氧化因子对生物体组织氧化性破坏,保护生物膜结构的完整性,是机体内自发生成的抗氧剂。当生殖道中细胞受到过氧化损伤时,生物体便应激产生更多的CoQ10,以自发调节抵抗脂质过氧化反应对细胞的损伤。
CoQ10的测定方法主要为分光光度法,该方法的灵敏度和特异性都不够理想,一般难于应用于生物样品中微量CoQ10的测定。近年来,具有较高准确度的高效液相色谱分析方法(HPLC)已开始应用于血浆等生物样品中CoQ10含量测定。
仪器:高效液相色谱仪系统,漩涡混合器。
试剂:
辅酶Q10储备液(1g/L):精确称取辅酶Q10对照品10mg,加少许正己烷溶解后,精确定容至10ml,摇匀,置4℃冰箱保存。工作液用流动相稀释配制。
辅酶Q9储备液(400mg/L):精确称取辅酶Q9对照品2mg,加少许正己烷溶解后,精确定容至5ml摇匀,置4℃冰箱保存。工作液用流动相稀释配制。
试验步骤:
避光处精确移取精浆1.0ml置于10ml具塞尖底离心管中,加入60μl CoQ9内标溶液(5mg/L),摇匀。加入2ml甲醇,加盖涡漩混合30s淀蛋白后加入5ml正己烷,涡漩混合提取5min,3000r/min离心5min。取正己烷层4ml移至安瓿,45℃下以氮气流吹干。残渣加100μl异丙醇充分溶解后,按以下色谱条件进样测定。
色谱条件:色谱柱:Lichrospher C18高效液相色谱分离柱150.0×4.6mmlD。流动相:异丙醇∶甲醇∶四氢呋喃(55∶39∶6),使用前以0.45μm滤膜减压过滤。检测波长:275nm。流速:1.0ml/min。定量管体积20μl。
李克等采用HPLC法报道正常生育男性精浆Q10浓度为371.1±12.2μg/L,不育男性精浆Q10浓度为48.5±20.4μg/L。
