在细胞内众多信号转导途径中,ⅠA型PI3K和其下游分子丝氨酸/苏氨酸蛋白激酶(proteinserine-threonine kinase,Akt)或蛋白激酶B(protein kinase B,PKB)所组成的信号通路是细胞内重要的信号转导通路之一,其广泛存在于细胞中,调控细胞增殖、凋亡及分化等功能,并且近年来研究发现,PI3K/Akt信号通路与细胞的恶性转化、肿瘤细胞的增殖迁移及肿瘤血管生成等密切相关。
在PI3K/Akt信号通路中,PI3K被G蛋白耦联受体和(或)蛋白酪氨酸激酶受体激活或被Ras蛋白激活后,在细胞膜上产生第二信使PIP3,PIP3进一步与细胞内含有PH结构域的信号蛋白分子Akt(也称为蛋白激酶B,PKB)和磷酸肌醇依赖性蛋白激酶1 (phosphoinositide-dependent kinase-1,PDK1)结合,诱导无活性的Akt和PDK1从细胞质移位到细胞膜,并获得催化活性。转位于细胞膜的Akt与PDK1相互靠近,PDK1通过催化Akt蛋白第308位上的苏氨酸位点磷酸化而引起Akt的部分活化,PDK2(如整合素连接激酶ILK)再对Akt第473位上的丝氨酸位点磷酸化,最后导致Akt的完全活化。
Akt/PKB 是一种相对分子质量约为60 000的丝/苏氨酸蛋白激酶,约由480个氨基酸残基组成,与蛋白激酶A(protein kinase A,PKA)和蛋白激酶C(protein kinase C,PKC)高度同源,是PI3K的主要下游效应分子之一,通过直接磷酸化多种转录因子,参与多种生命活动的调节。Akt分子的氨基酸组成由N端到C端依次为PH结构域、中心催化结构域和短的羧基端调节结构域。PH 结构域约含100 个氨基酸残基,介导Akt活化后的膜转位过程;催化结构域含ATP结合位点,结构域内部Thr308的磷酸化为Akt活化所必需;C端调节域富含脯氨酸,并有Akt活化所必需的另一个磷酸化位点Ser473。目前发现的Akt家族成员有三种亚型:Akt1/PKB、Akt2/PKB和Akt3/PKB,分别由3个不同基因编码,但蛋白质高级结构基本相同,广泛地在各种组织中表达。
Akt/PKB是PI3K的主要下游效应分子之一,处于多条信号通路的重要交叉点,可调节细胞因子、生长因子和癌基因的激活等,在真核生物的调控网络中普遍存在,同时Akt也能被细胞内多种物质(如激素、生长因子、细胞间基质等) 刺激活化。Akt/PKB作为PI3K/Akt信号通路的关键分子,活化的Akt可引起下游一系列磷酸化级联反应和靶蛋白之间的相互作用,如通过磷酸化作用激活或抑制下游靶蛋白mTOR、Bcl-2 家族、E2F、糖原合成酶3 (glycogensynthase kinase 3,GSK3)、Bad、caspase-9、叉头转录因子(forkhead-relatedtranscription factor,FKHR)、 p21Cip1、p27 Kip1和S6 蛋白激酶等,对细胞周期、凋亡和血管新生等产生调节作用 (见图2-7-1)。其中p27 可作用于细胞周期蛋白/细胞周期依赖性蛋白激酶,抑制细胞周期依赖性蛋白激酶(CDK)活性,使细胞不能顺利通过M期而导致细胞周期发生M期阻滞。
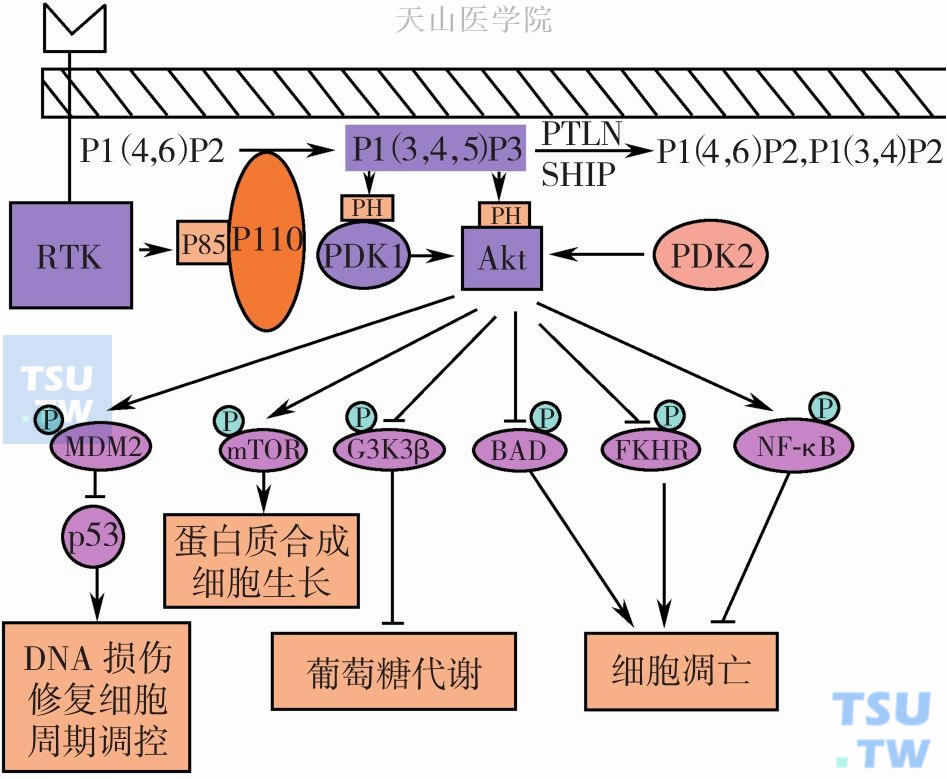
图2-7-1 PI3K-Akt信号通路
