在肿瘤患者体内脂肪组织不断分解和释放脂肪,以及血脂升高同时,肿瘤细胞内主要表现脂肪酸从头合成和其他脂类合成增强。研究发现脂肪细胞内脂肪酸从头合成增加与细胞脂类水平无关,其原因还不清楚,这可能与肿瘤细胞不断增殖需要合成大量膜脂有关,并且与肿瘤细胞恶性表型(侵袭和迁移等)有关。
脂肪酸从头合成部位在细胞质,合成脂肪酸所需要的重要构件分子之一就是乙酰CoA,其主要来源有两个途径(图3-3-5):其一,主要来自TCA,线粒体基质中乙酰CoA与草酰乙酸缩合生成柠檬酸,后者出线粒体进入胞质并在柠檬酸裂解酶催化裂解为乙酰CoA和草酰乙酸。肿瘤细胞中谷氨酰胺水解是增强的,其重要作用是补充消耗的草酰乙酸,加快乙酰CoA从线粒体中运出。其二,肿瘤细胞直接从胞外摄取乙酸,在胞质中乙酸在乙酰CoA合酶催化生成乙酰CoA。支持这一点的证据是发现癌症患者血清中乙酸水平明显低于健康对照者。
肿瘤细胞脂肪酸合成增加与脂肪酸合成相关酶,如脂肪酸合酶(FAS)、柠檬酸裂解酶(ACL)和乙酰CoA羧化酶(ACC)和Spot14(Thyroid hormone response protein,THRP)等表达增加有关。FAS最初在鉴定为乳腺癌相关蛋白OA-519,实际上FAS在许多种癌细胞中高表达。FAS是多功能酶,它催化乙酰CoA和丙二酰CoA通过多次缩合和还原循环方式合成棕榈酸,FAS是催化糖转变成脂肪过程中的关键酶。正常情况下,FAS主要在肝脏细胞表达,肝脏借此合成脂肪并输出至脂肪组织储存和为其他组织器官供能。因此,许多组织器官主要依赖血循环中的脂类,而不表达FAS。许多肿瘤,尤其是侵袭性强的肿瘤细胞中FAS表达水平显著提高。同时,FAS表达是肿瘤发生和发展过程中的早期事件,并且其表达水平可指示肿瘤发展从早期向晚期的转变,与肿瘤预后密切相关。FAS表达受复杂网络调控,已经明确激素依赖的肿瘤如乳腺癌、前列腺癌和子宫内膜癌中类固醇激素可诱导其表达,这涉及MAPK、MEK1/MEK2和PI3K/Akt信号通路。其中PI3K/Akt信号通路在脂肪合成中发挥重要作用(图3-3-5)。活化的PI3K/Akt通过激活类固醇激素反应元件结合蛋白1并促进其入核而促进脂肪合成相关基因表达。最新研究发现骨肉瘤中Akt磷酸化与FAS表达之间形成正反馈,且在骨肉瘤恶性发展中起着重要作用。PI3K/Akt还可直接激活ACL促进脂肪酸合成,同时可通过下调肉毒碱棕榈酰基转移酶1A(CPT1A)抑制脂肪酸β-氧化。在乳头状甲状腺癌亚型中,脂肪酸合酶表达可激活PI3K/Akt信号通路,而抑制脂肪酸合酶可阻止肿瘤细胞生长和诱导死亡。此外,HIF-1可诱导许多脂类合成酶系表达,肿瘤恶液质脂代谢紊乱中也发挥重要作用。
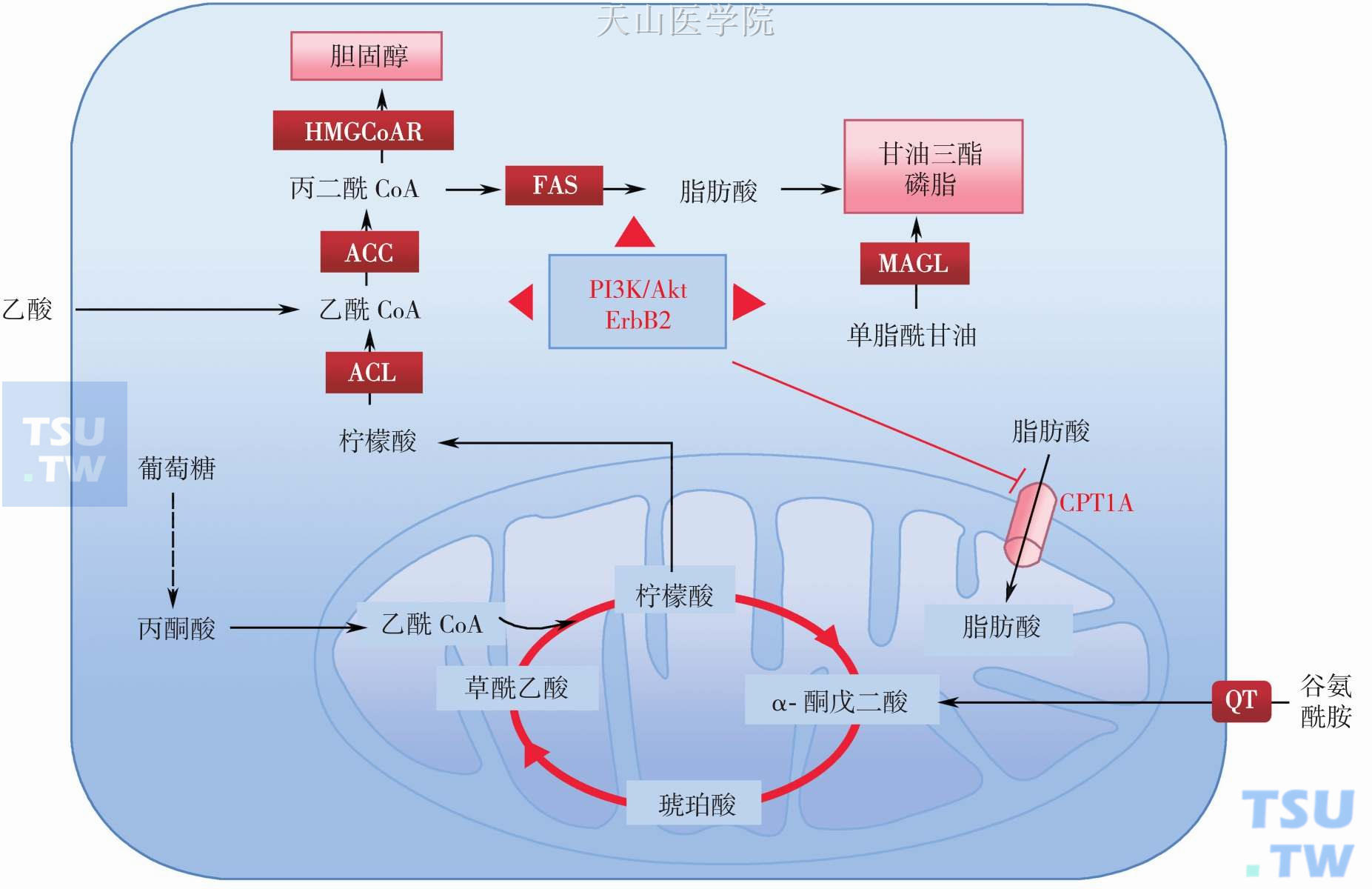
图3-3-5 肿瘤细胞内脂类代谢异常机制
FAS,脂肪酸合酶;ACL,ATP-柠檬酸裂解酶;ACC,乙酰CoA羧化酶α;MAGL,单酰基甘油脂酶;HMGCoA R,羟甲基戊二酸单酰辅酶A 还原酶;CPT1A,肉毒碱棕榈酰基转移酶1A;QT,谷氨酰胺转运载体
ACC是脂肪酸合成的限速酶,它催化乙酰CoA 和CO2生成丙二酰CoA。ACC在乳腺癌和前列腺癌中高表达,而抑制ACC导致脂肪合成下降和细胞凋亡。Spot14可调节多种脂肪合成相关酶基因表达,包括FAS和ACC等,乳腺癌中Spot14水平与癌侵袭性和预后差密切相关。MCF-7乳腺癌细胞转染过表达ErbB2 癌基因后,涉及脂肪酸从头合成的酶和不同脂类(甘油磷脂、鞘磷脂和前列腺素)周转相关酶表达明显改变。单脂酰甘油酯酶(MAGL)补充肿瘤细胞脂肪酸中发挥重要作用。MAGL在许多肿瘤中表达和活性增强,并且与肿瘤发生和侵袭和转移有关。
