铁是维持生命活动的基本元素之一。铁参与许多生命活动,与许多蛋白质分子结合并作为酶的辅助因子参与多种代谢反应,包括电子传递、DNA合成和红细胞生成。生物体内铁存在两种氧化状态:二价铁(亚铁,Fe2+)和三价铁(高铁,Fe3+)。铁通过供出电子或获得电子进行氧化还原态的转变,这是其发挥重要生物学功能的重要机制。
铁是机体内运输氧所必需的,同时铁与氧相互作用也会给机体带来潜在损害。1894年Fenton实验揭示了铁在羟自由基(•OH)产生中发挥的作用,通过Fenton反应(反应式1),Fe2+与H2O2作用产生•OH。
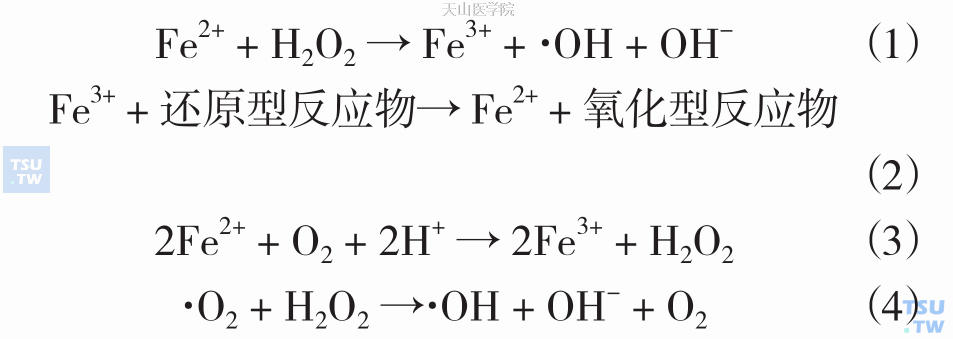
铁可逆性氧化还原能力可促进活性氧(ROS)产生。通过反应式(2),Fe3+与还原性分子反应转变为Fe2+,而Fe2+与O2反应产生H2O2,(反应式3),后者启动Fenton反应(反应式1),最后铁催化产生•OH 和OH-的反应称为Haber-Weiss反应(反应式4)。
ROS特别是•OH可与生物大分子反应引起突变和细胞损害,由于铁介导的上述反应的不利后果,高水平铁已被认为是癌变发生的风险因子,针对不同人中的许多研究表明机体铁储备与多种肿瘤(结直肠癌、肝癌、肺癌、肾癌和胃癌)发生呈正相关。
正常人体中20%~30%的铁与细胞内的铁蛋白结合。机体所有细胞都能表达铁蛋白,铁蛋白主要负责俘获和隔离铁的作用,与其他铁结合蛋白一样,铁蛋白结合铁以阻止游离铁有害的氧化还原循环,当细胞需要铁增加的时候,铁蛋白结合的储备铁释放出来并通过血清运铁蛋白(transferrin,Tf)转运。
铁调节蛋白-铁反应元件的调节作用
十二指肠黏膜细胞通过两条独立的通路吸收食物铁,一般认为肠道吸收的Fe3+必须要通过铁还原酶(Dcytb)催化转变为Fe2+,小鼠Dcytb敲除研究显示Dcytb对于食物铁吸收不是必须的,这提示存在可选择性铁还原酶。
一旦Fe3+经Dcytb催化转变为Fe2+,就能通过近端十二指肠黏膜细胞顶端的二价金属离子转运载体(DMT1)帮助其进入细胞内,DMT1吸收铁部分受到铁调节蛋白1和2(IRP1和IRP2)在mRNA水平上的调节。IRP1和IRP2是铁的关键感受器分子,组成控制铁代谢平衡的转录后调节网络。IRP1和IRP2都能以结构和序列专一性方式识别和结合铁反应元件(iron response element,IRE),IRE为高度保守的28nt序列,存在于一类与铁代谢相关蛋白质基因的非编码序列中(图3-6-1A和B)。这些含有IRE的mRNAs包括转铁蛋白受体1(TfR1)、铁蛋白、铁转运蛋白-1(ferroportin-1,FPN1)等。
几乎所有的细胞内,通过感受铁水平变化IRPIRE机制在调节这些蛋白质分子表达中发挥重要作用:当细胞内低水平铁时,IRP1和IRP2都能与TfR1 mRNA的3′UTR的5个IREs结合,结果使得TfR1 mRNA稳定性提高,促进蛋白质的翻译;而当细胞铁水平升高,则失去IRPs结合mRNA的活性,导致mRNA降解(图3-6-1A)。含有IRE的DMT1 mRNA也含有一个3′UTR的IRE,也以相同的机制受到机体铁水平的调节(图3-6-1B)。而IRP1和IRP2以同样的作用在转录后方式调节DMT1表达。但IRP1和IRP2两者的作用机制是不同的。事实上,IRP1与IRE结合受到Fe-S簇的影响,而Fe-S簇必须在高铁水平下形成。而IRP2受到铁介导的蛋白酶体降解的调节。
铁跨肠细胞基底膜的转运
铁吸收入肠细胞内后转变成肠细胞内易变的铁池(labile Fe pool,LIP),主要有Fe2+和Fe3+组成并处于氧化还原的动态平衡状态。LIP的分子性质还不清楚,但有提示可能包括低分子量配体,蛋白伴侣分子和(或)涉及细胞器相互作用。铁离开LIP通过FPN1后运出进入血液循环,FPN1是铁从细胞内释出的主要转运载体;同时细胞内铁氧化酶(hephaestin)在铁释出细胞的转运过程中可能也发挥一定的作用,但其作用机制还不清楚。FPN1定位与其转运铁功能相一致,主要分布在肠细胞基底膜,FPN1还高表达在肝巨噬细胞膜上,这涉及红细胞吞噬作用和铁再循环利用。
如同通过DMT1表达来调节铁吸收一样,肠细胞也采用类似机制来调节铁释放,主要有两种机制来影响FPN1表达调节铁释放:①IRP-IRE相互作用;②通过铁代谢调节激素Hepcidin在蛋白质水平上调节。
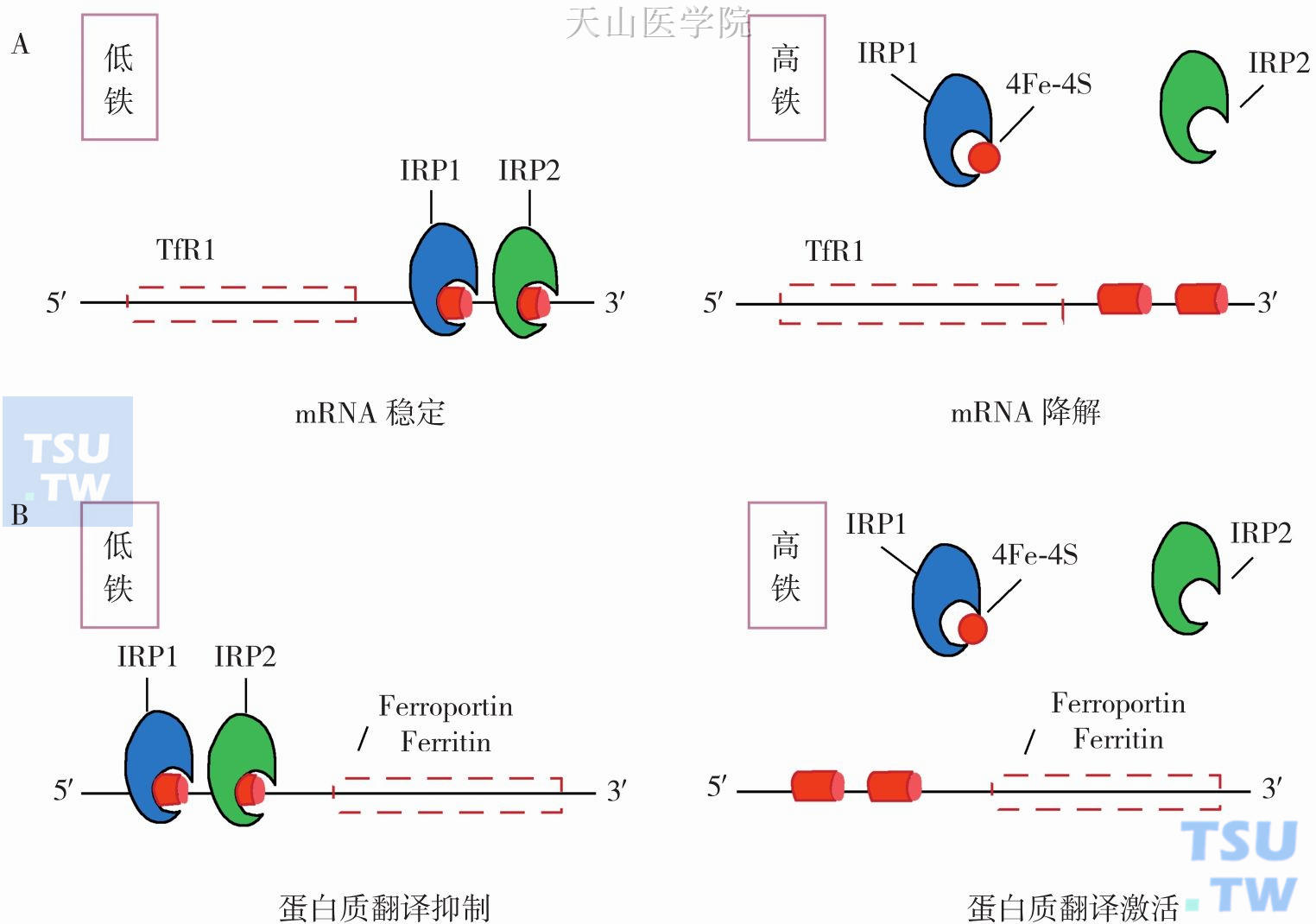
图3-6-1 细胞铁水平对铁代谢相关基因表达影响
IRP-IRE相互作用调节FPN1表达:如图3-6-1B所示 FPN1 mRNA 的IRE位于5′UTR,而相对的TfR的mRNA(或DMT1 mRNA)IRE则位于3′UTR(图3-6-1A)。当肠细胞内缺铁时,IRP1和IRP2高亲和力地与FPN mRNA 5′IRE结合,抑制FPN1 mRNA与核糖体结合,从而抑制翻译,使之肠细胞基底膜上FPN1表达下降导致细胞铁释放减少。相反,当细胞内铁充足时,IRP-IRE相互作用降低,FPN1 mRNA翻译增加,铁释放增多。对于IRP1,其与IRE结合活性下降是由于高铁导致IRP1分子中形成4Fe-4S簇;而IRP2与IRE结合活性下降是由于高铁介导蛋白酶体降解IRP2。还有,细胞内铁储存蛋白-铁蛋白也是受5′IRE调节,细胞内高铁水平时导致铁蛋白翻译合成增加,而铁缺乏时则阻止翻译(图3-6-1B)。
铁代谢调节激素Hepcidin调节FPN1表达:除了转录后调节FPN1表达外,Hepcidin可以负调节FPN1的表达。Hepcidin主要在肝脏合成,存在以20个氨基酸和25个氨基酸组成的两种肽,一旦从肝脏分泌后,Hepcidin运输到十二指肠细胞基底膜,并通过细胞内吞进入细胞内,接着介导FPN1降解,最终导致铁潴留在细胞内。作为负反馈弧的一部分,血清铁浓度影响Hepcidin的分泌,高血清铁引起Hepcidin的分泌,而低血清铁抑制Hepcidin分泌。因此,低血清铁导致FPN1高表达,高血清铁抑制FPN1表达。这就导致了FPN1在肠细胞基底膜上的不同表达(图3-6-2)。还有重要的是Hepcidin通过相同机制不仅调节肠细胞基底膜释放铁,而且还调节巨噬细胞和肝细胞。
铁转运和细胞摄取
由于铁在液体中氧化还原特性和潜在产生ROS,因此非结合铁在体内保持量极低。为了避免出现高水平的非结合铁,铁与血清转铁蛋白(Tf)两个高亲和位点结合进行转运。
细胞铁摄取涉及载铁的Tf与细胞膜上转铁蛋白受体1(TfR1),Tf与TfR1结合介导细胞内吞作用,使载有二铁的Tf和TfR1复合物进入细胞。Tf内化后变成内含体,由于内含体膜上质子泵介导的pH下降导致Fe3+从Tf上释放,并在内含体内的铁还原酶催化下使Fe3+转变为Fe2+。然后在DMT1作用Fe2+进入细胞质,并入LIP,与铁蛋白结合储存,或参与到其他含铁蛋白中。然后含有Tf-TfR1复合物的内含体外吐作用再利用TfR1,卸去铁的Tf回到血液循环中再装载肝脏释出的铁。细胞摄入Tf结合铁受TfR1表达调节,TfR1表达调节又通过IRE-IRP机制并以转录后方式完成。细胞铁摄入也受到血色素沉着基因产物(HFE)调节,HFE通过结合TfR1从而立体阻碍方式抑制Tf结合。
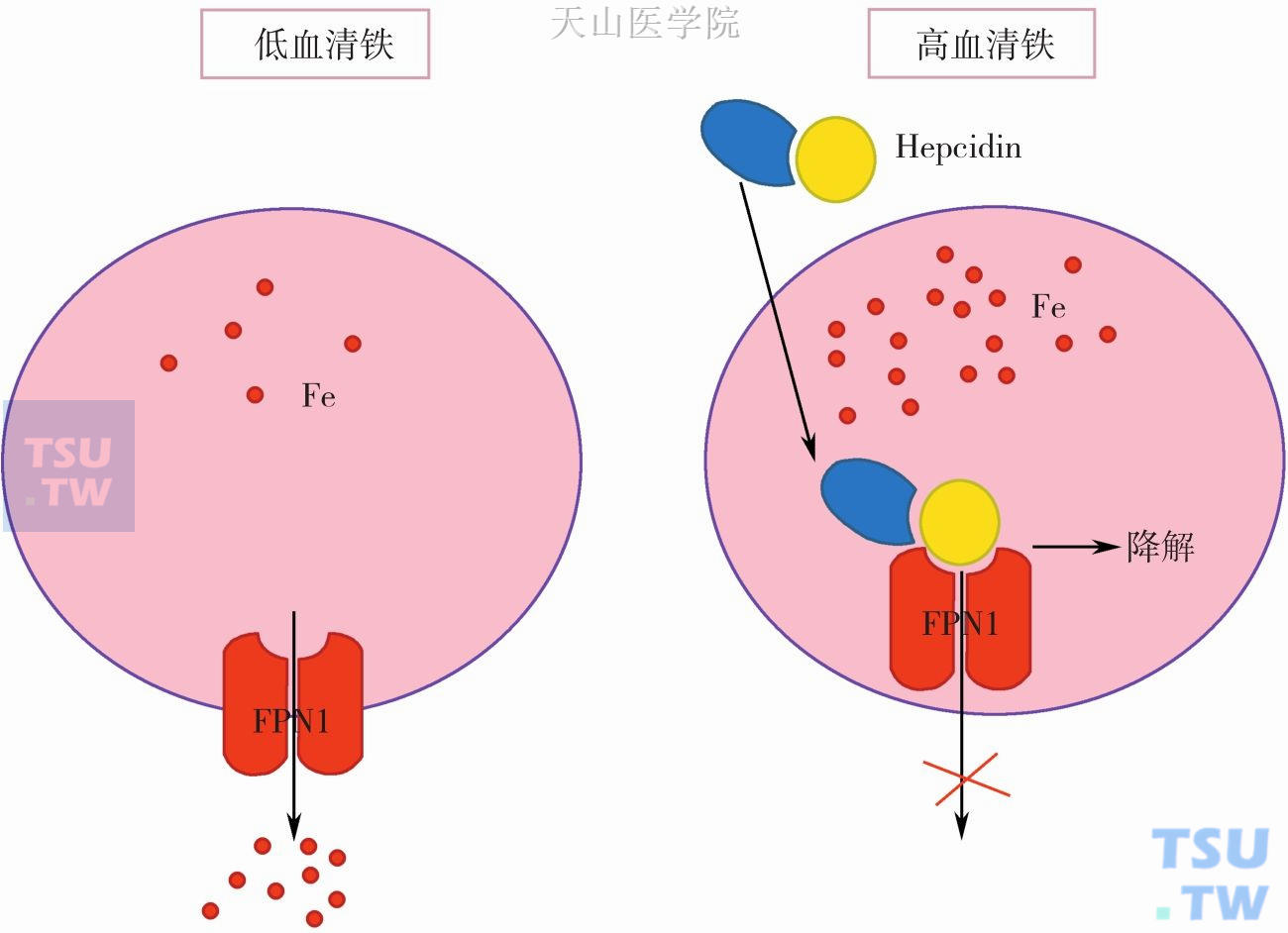
图3-6-2 肠细胞铁释放的调节
新近鉴定的TfR2功能还不清楚,TfR2似乎与铁摄入上没有定量意义。事实上,TfR2在铁平衡上发挥了关键性作用,因为TfR2突变可引起一种血色素沉着症,敲除TfR2基因小鼠引起铁过载。
