铁与肿瘤细胞增殖
铁与核苷酸还原酶和DNA合成
肿瘤细胞TfR1高表达可能部分解释是由于核苷酸还原酶对铁的需求增加。肿瘤细胞增殖旺盛需要不断地DNA合成,这需要核苷酸还原酶活性和表达的增加。核苷酸还原酶由两个亚基(R1和R2)组成,酶活性中心位于R1亚基上,然而要形成活性核苷酸还原酶之前要求R2的二铁中心和酪氨酰基团与R1的保守的半胱氨酸残基之间进行一系列反应,铁参与R2活性酪氨酰基团与氧的反应,同时还参与在R1和R2之间形成活性基团传递链。
人核苷酸还原酶的R2亚基还有另外一种亚基称为p53R2,R2主要负责DNA复制,而p53R2 以p53依赖方式为DNA损伤修复提供dNTPs,可能细胞还有不依赖p53的p53R2诱导合成,因为在p53突变细胞中DNA损伤仍能诱导合成p53R2。事实上p53R2是p53家族成员p73的转录靶分子。R2 和p53R2都含有对于酶活性很重要的铁结合位点,因此,两者对铁螯合剂非常敏感的。
因为核苷酸还原是DNA合成的限速步骤,抑制核苷酸还原酶可引起细胞许多后果:抑制DNA合成、细胞增加和DNA修复而导致细胞周期阻止和细胞凋亡等。因此,核苷酸还原酶也可作为抗癌药物研制的重要靶点。
铁影响细胞周期相关分子表达
铁除了通过核苷酸还原酶直接影响DNA合成外,还可影响细胞周期相关蛋白的表达而影响细胞周期和细胞增殖。细胞周期运行受到严格调控,主要调节分子包括细胞周期素(cyclins)、cyclins依赖蛋白激酶(CDKs)、cyclins依赖蛋白激酶抑制因子(CKIs)和P53。用铁螯合剂引起铁缺乏可导致细胞周期相关基因表达改变,包括P53、GADD45、cyclins D1,D2 和 D3,p21和CDK2,导致细胞周期阻止于G1/S期和细胞凋亡。
铁与肿瘤血管形成
肿瘤快速生长常常导致瘤体内细胞缺氧,而缺氧会刺激血管增生,而血管增生涉及血管内皮细胞增殖,铁在这过程中可能发挥重要作用。肿瘤血管形成与HIF密切相关,HIF-1活性取决于HIF-1α的稳定性,HIF-1α的稳定性受多种因素调节。首先是HIF-1α分子结构中有两个脯氨酸羟化位点(P402 和P564),其羟化是依赖氧浓度的,并在脯氨酰羟化酶催化下完成。羟化后的HIF-1α易于被von Hippel-Lindau (VHL)-Elongins复合物识别和结合,并介导泛素化,泛素化的HIF-1α随后被蛋白酶体复合物降解。具体见本章第二节肿瘤糖代谢中HIF的内容。HIF-1相关功能见表3-6-1。
表3-6-1 HIF-1靶基因与相关功能

Callapina等研究发现低铁也可以模拟低氧条件,因为Fe2+是脯氨酰羟化酶活性所必需的,细胞内缺铁导致脯氨酰羟化酶失活,后者不能羟化HIF-1α,从而增加HIF-1α的稳定性,同时脯氨酰羟化酶失活也阻止了无活性VHL转变为活性的VHL。最终HIF-1α入核,与HIF-1β结合形成活性的二聚体,转录一系列靶基因转录,其中包括相关血管形成的基因表达(图3-6-3)。
鉴于上述情况,铁螯合剂可以引起上调促血管形成的生长因子VEGF1表达,这些螯合剂理论上可促进血管增生和肿瘤生长。然而,应当注意的是血管生成和抗肿瘤的关系中呈现出在促血管和抗血管生成因子之间复杂的“平衡作用”。如缺铁除了引起VEGF1表达导致血管生成外,还有许多抗血管生成效应,包括:①抑制RR表达;②上调肿瘤生长和转移抑制因子Nrdg-1(N-Myc downstream regulated gene-1);③上调凋亡因子BNIP-3;④下调细胞周期蛋白cyclin D1而抑制细胞周期;⑤下调P21引起细胞凋亡;⑥上调P53抑制血管生成。体内试验发现铁螯合剂抑制肿瘤生长的证据表明缺铁的优势效应是抗肿瘤生长。
铁与肿瘤转移
肿瘤转移是肿瘤患者死亡的主要原因。脱离肿瘤组织的癌细胞生存能力是肿瘤转移效率的主要因素,如果在有利于环境的情况下,到达转移目的地的肿瘤细胞内会激发组织专一性信号通路以保证第二代肿瘤存活。一般认为倾向侵袭转移的癌细胞常显示细胞黏附下降的表型。这主要由于细胞黏附分子基因突变所致。这些黏附分子主要分为三类:整合素类(integrins)、钙黏着糖蛋白类(cadherins)和免疫球蛋白超级族(immunoglobulin superfamily)。研究表明培养液负载铁培养结肠癌细胞(CaCo-2 和 SW480)和肝细胞导致E-cadherin表达下降。许多研究表明铁螯合剂可影响一些细胞表面黏附分子(E-selectin,VCAM-1和ICAM-1)的表达。铁螯合剂DFO和2,2-dipyridyl处理人上皮微血管内皮细胞导致以时间和剂量依赖方式抑制VCAM-1表达。同样用DFO处理主动脉内皮细胞导致E-selectin,VCAM-1和ICAM-1表达抑制。但是还不清楚铁螯合剂介导基因表达改变是否或者怎样影响细胞侵袭和转移。
除了黏附分子外,癌细胞转移还与细胞外基质改变密切相关,主要涉及基质金属蛋白酶(MMPs)。有研究发现用铁盐溶液培养头和颈部鳞状癌细胞导致MMP-9表达增加,其机制主要通过细胞外信号调节激酶1/2/Akt介导激活AP-1所致。反过来,用铁螯合剂2,2-dipyridyl引起铁缺乏可导致人纤维肉瘤细胞HT1080 表达MMP-9升高3倍。可最近研究结果与2,2-dipyridyl 相反,DFO 可降低肝星型细胞表达MMP-2,-9。总的情况是大多数模型研究发现铁螯合剂引起MMPs表达下降,这表明铁螯合剂除了抑制肿瘤生长外,还可能通过改变细胞外基质相关的MMPs表达抑制癌细胞转移。
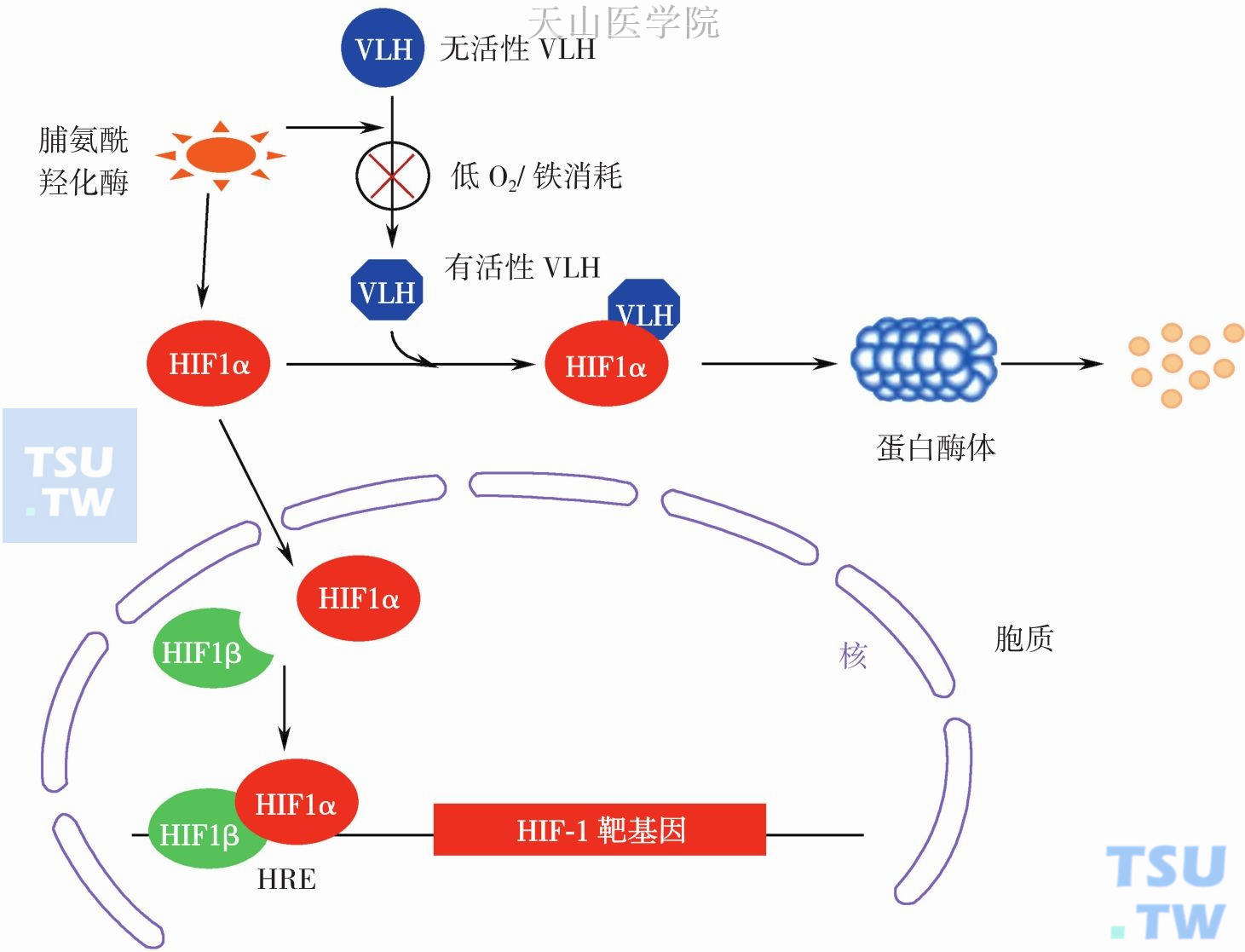
图3-6-3 缺氧或缺铁与HIF-1活性关系
