1941年,Huggins等采用去势手术治疗,使70%~80%的患者暂时取得效果,肿瘤迅速缩小,癌细胞大部分死亡。现在认识到这种癌细胞的死亡,是因雄激素减少,细胞发生凋亡而致死的。凋亡的发生不是单纯的被动死亡,而是前列腺内的雄激素减少后,雄激素的抗凋亡作用减弱,而并不是对细胞的增殖作用降低所引起,此时细胞内发生一系列的生化改变。TRPM-2、野生型p53、TGF-β等基因增加,然而这些基因均具有促使细胞凋亡的功能使癌细胞死亡,但是睾丸切除后,癌细胞不能全部凋亡,仍有雄激素非依赖性细胞存活下来,所以去势只能暂时缓解,10%~20%的患者能存活5年,但最终还是死于前列腺癌。
在20世纪70~80年代的一系列经典研究表明,睾酮是释放入血液的主要睾丸激素,在前列腺组织内,睾酮被1型及2型5α-还原酶迅速及不可逆地转化为双氢睾酮。在前列腺组织中,双氢睾酮比睾酮的水平高10倍以上,而且其对雄激素受体的亲和性也是睾酮的10倍,因此双氢睾酮是调节前列腺生长的主要雄激素。研究证实,前列腺双氢睾酮水平与前列腺上皮细胞数量之间存在量的关系,这些与研究结果是一致的(图18-1)。
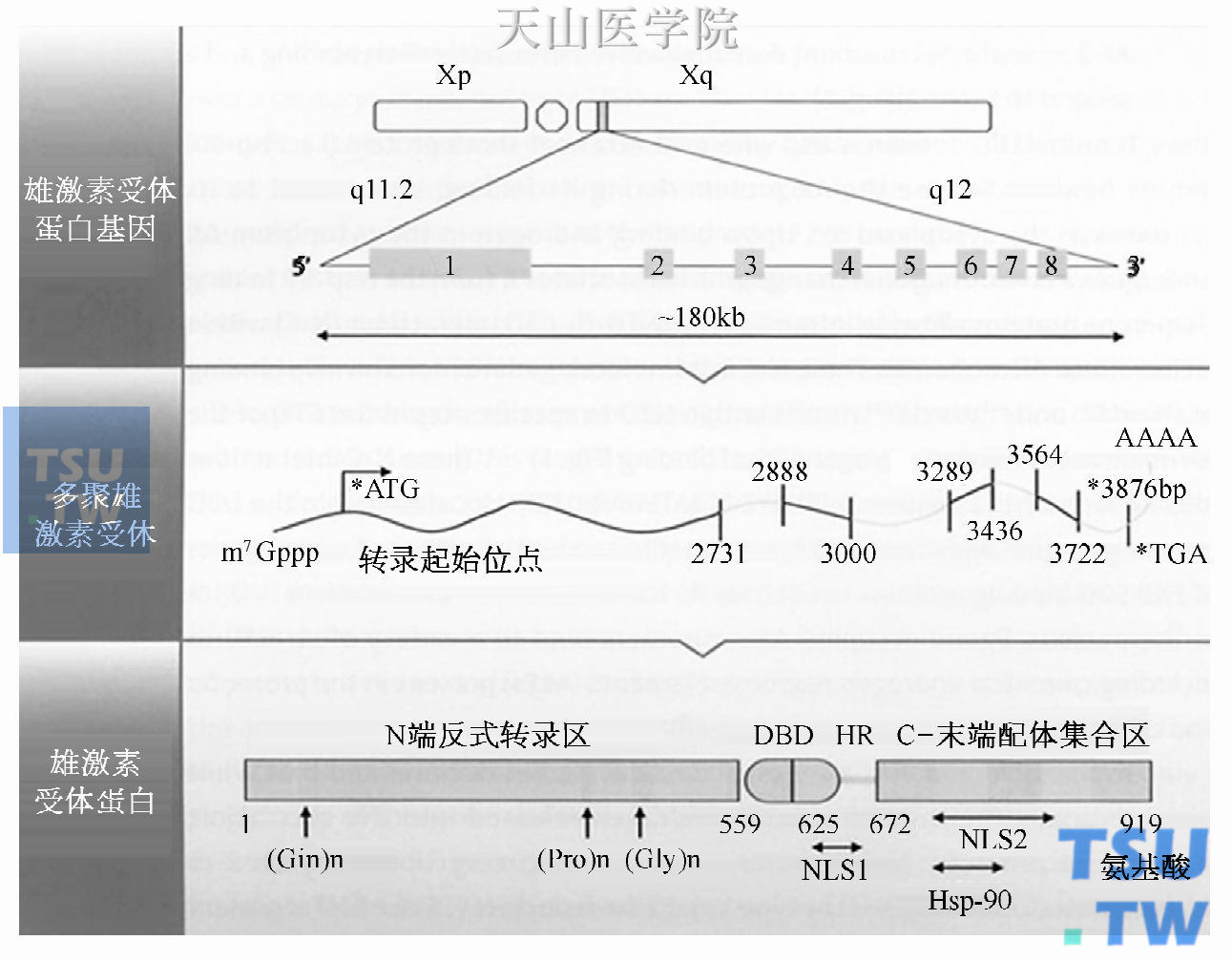
图18-1 雄激素受体基因,mRNA,蛋白质组织
因为正常前列腺上皮细胞表达雄激素受体(AR),对于雄激素诱导生长调节机制最初假定是通过胞内分泌的方式,双氢睾酮与细胞内雄激素受体结合,这种配体捆绑复合物再通过特异性的雄激素应答元件(ARE)与上皮细胞核相结合,并通过雄激素应答基因的启动子来增强或抑制转录。研究表明,上皮细胞转录活性的改变将直接导致前列腺上皮细胞的增殖与存活。20世纪90年代,Gerald Cunha以及他的团队对志愿者进行了超过15年的研究,这种单一的前列腺组织DNA复制的雄激素调节细胞内模型被证实是错误的。相反,Cunha小组确定,雄激素对前列腺上皮细胞正常生长调节涉及AR依赖相互间质/上皮细胞旁分泌信号通路。
雄激素受体山位于X染色体长臂的180 kb基因编码组成,因此其在每个细胞中都是单基因拷贝。这一基因由8个外显子编码组成,在图中用8个方框表示。在转录过程中,4.3 kb的多聚雄激素受体信使核糖核酸(mRNA)翻译成919个氨基酸长度的蛋白质。一部分功能区被认为是雄激素受体蛋白:①N端反式转录区;②DNA结合区(DBD)及铰链区(HR);③C末端配体结合区(LBD)。另外前述的组件区、一定数量的基序对于正确的雄激素功能是非常重要的,包括两个核输入信号(NLS),位于铰链区及C末端配体结合区,以及位于C末端配体结合区的热休克蛋白(Hsp-90)结合位点。(引自Litvinov IV et al. J Clin Endocrinol Metab 2003,88: 2972-82. Copyright 2003. The Endocrine Society)
Berges认为,正常前列腺上皮细胞生长的雄激素调节与雄激素受体依赖的基质/上皮旁分泌信号,andromedins的分泌(如生长和存活因子如IGF-1,FGF-7,FGF-10,VEGF)有关,其通过数个不同的细胞成分来调节前列腺的生长和细胞死亡。其中包括前列腺成人干细胞,其形成两个不同的细胞系:①终末分化神经内分泌细胞;②过渡扩增(TA)细胞,其成熟为中间细胞并最终分化为上皮细胞。每一种细胞成分都有唯一一套细胞标志物并且随雄激素受体状态及对激素的反应不同而不同。图18-2为上皮细胞与前列腺基质的相互作用机制。
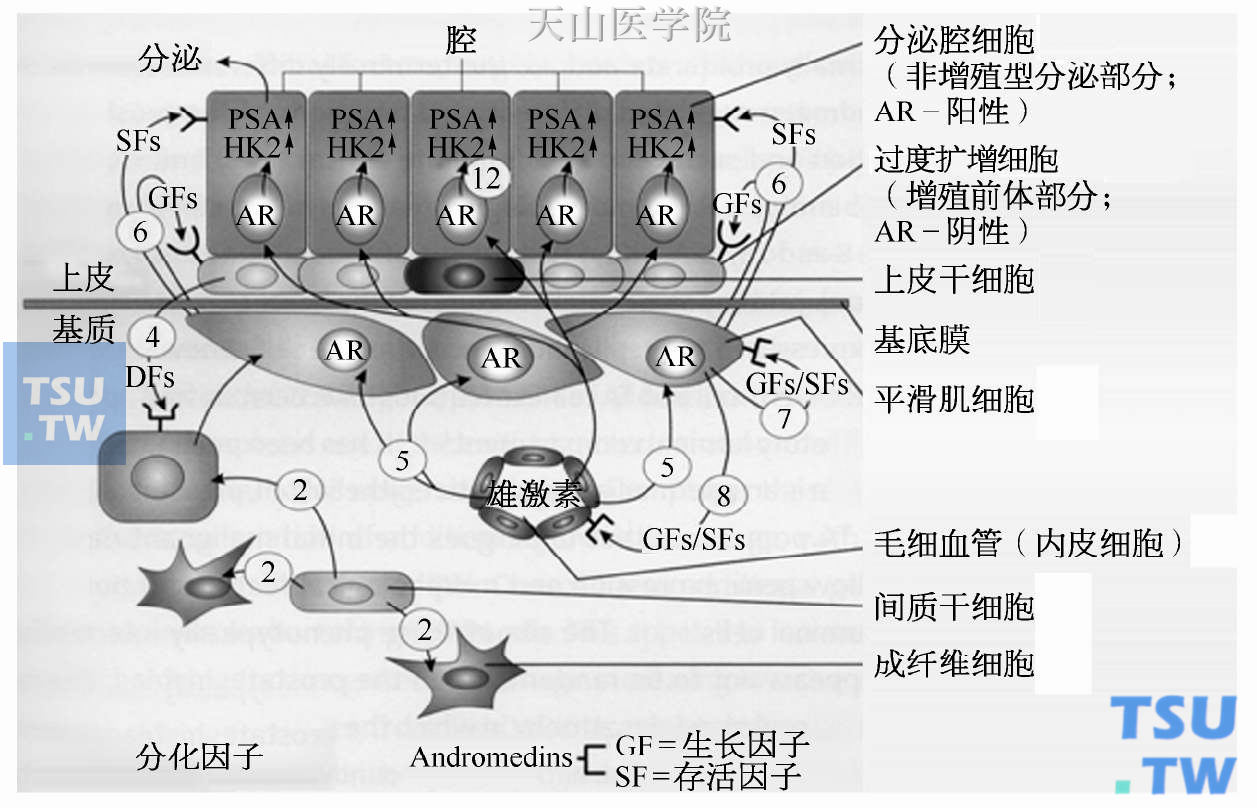
图18-2 上皮细胞与前列腺基质的相互作用机制
(引自Isaacs JT. 前列腺.2008,68:1 025-1 034)
目前较多的研究认为前列腺癌细胞可能来源于中间前列腺上皮细胞,据推测可能来源于基质TA细胞,通过雄激素受体的表达增强而出现恶变。而基质TA细胞一般不表达或仅表达低水平的雄激素受体。这种功能的获得使雄激素受体能够通过分子信号通路直接刺激前列腺细胞的增殖和存活,并且为通过雄激素受体信号通路阻断前列腺癌的雄激素,并提供了理论基础,这种新的治疗方法将前列腺受体信号通路作为今后主要的干预目标(图18-3)。
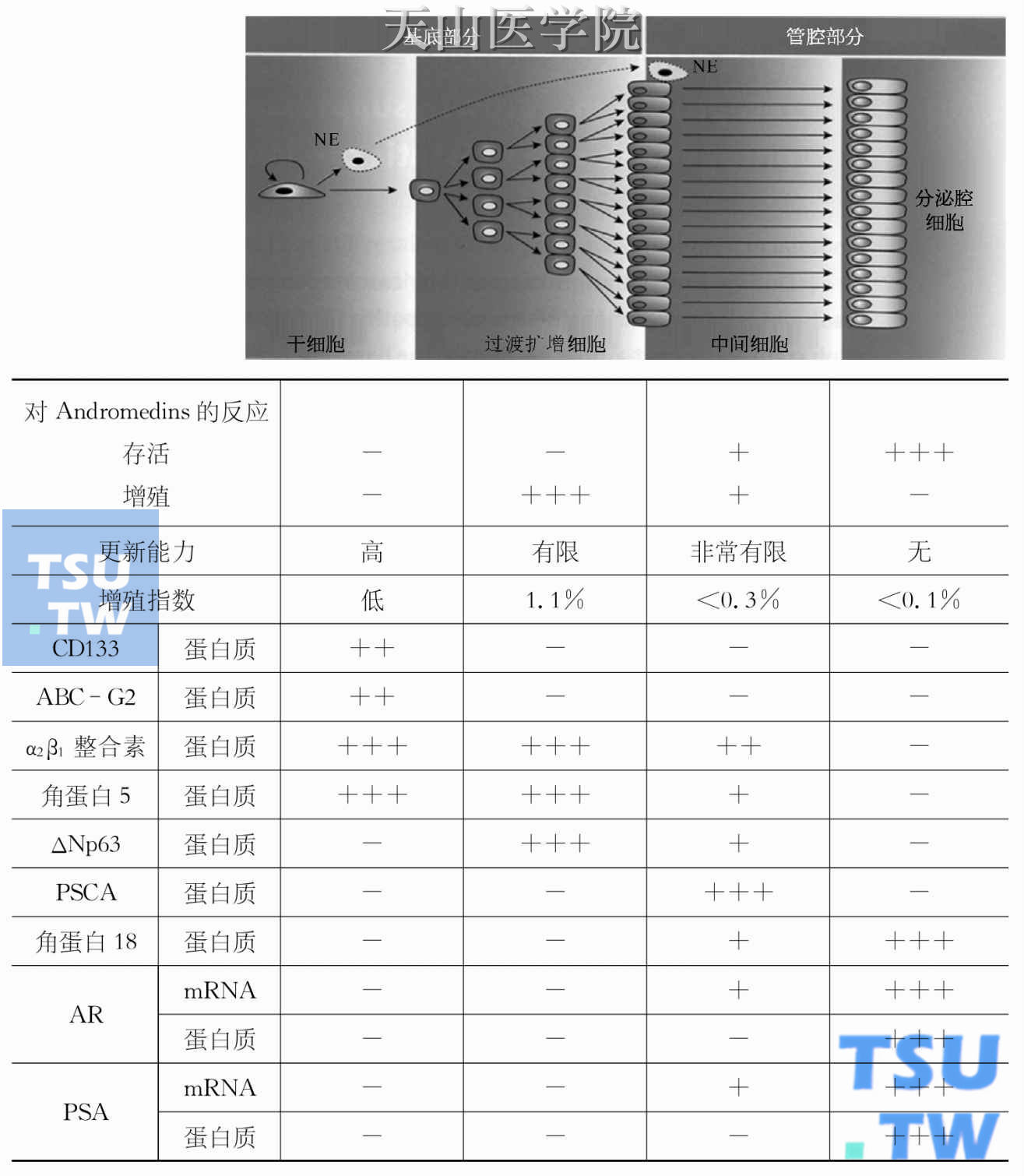
图18-3 前列腺干细胞不同细胞亚型的表型特征
(引自Isaacs JT.前列腺.2008,68:1 025-1 034)
(苏元华 宋业平 苏芳)
