精子发生就其本质而言,是在严密完整的生精调节网络调控下,特异基因在特定的时空秩序上,精密有序地表达和相互作用的结果,精子发生的任何一个发育阶段都伴有一些特异基因的表达。特异基因有序地表达是生精调节网络调控的结果,也是精子发生正常进行所需的条件和调节因素。与精子发生相关的基因很多,研究较多的包括Y染色体上的基因及原癌基因。
Y染色体与精子发生
人类Y染色体是G组的近端着丝粒染色体,长约60Mb,仅大于21号和22号染色体。在不同种族、民族人群中Y染色体的长度具有很大的变异性。Y染色体是性染色体,为正常男性独有,由两个遗传功能不同的部分组成——拟常染色体区(pseudoautosomal region,PAR)和Y特异区(male specific region of the Y chromosome,MSY)(图a)。拟常染色体区位于Y染色体两端,即PAR1和PAR2。在男性减数分裂过程中,参与同X染色体的配对、同源重组和分离。Y特异区占Y染色体全长的约95%,过去认为它不参与同X染色体的同源重组,故又称为Y染色体非重组区(non-recombining region of Y,NRY),但近期有研究表明,该区同X染色体的也有同源重组发生。
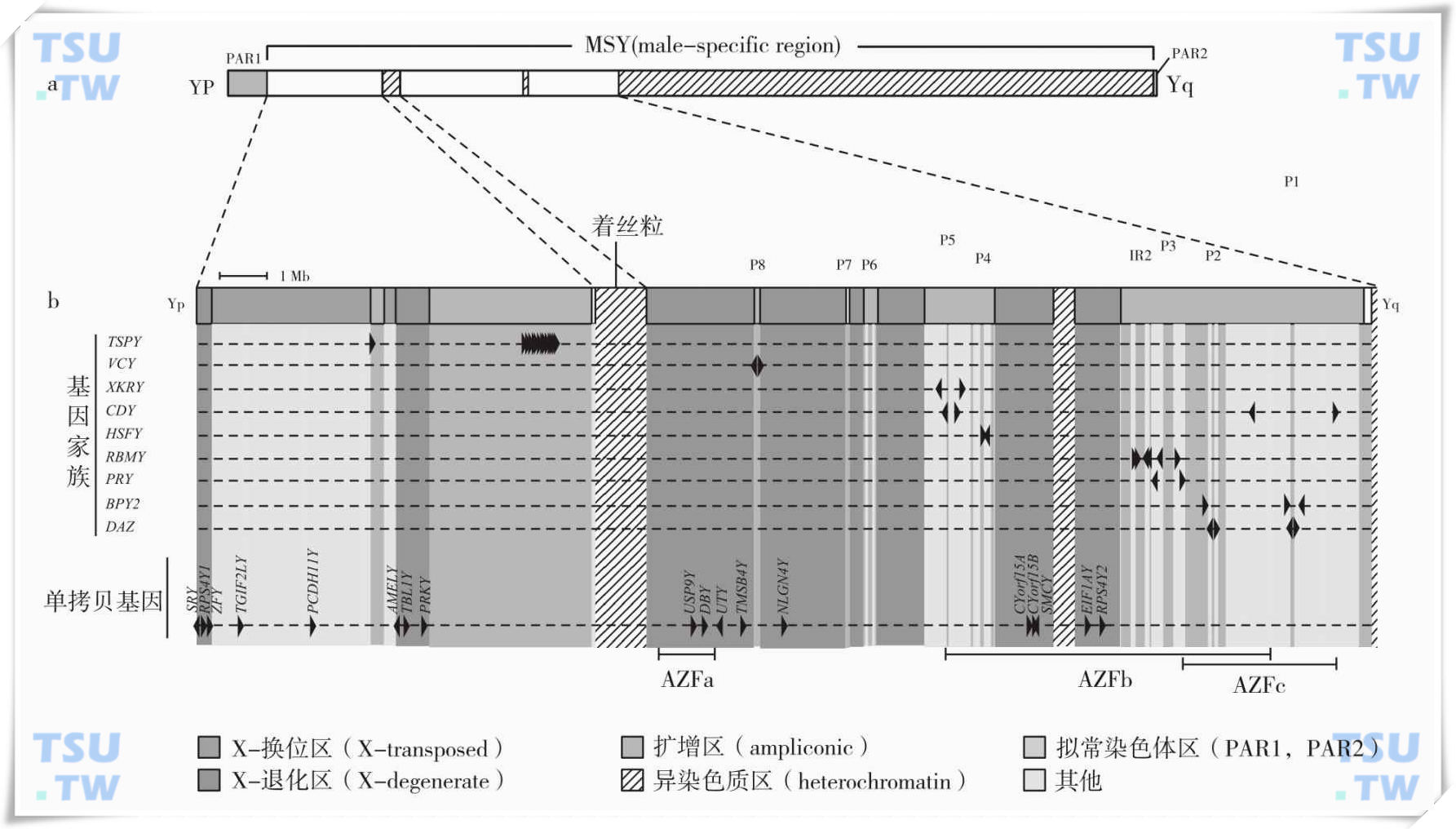
图1:染色体结构与基因
(引自:Skaletsky H,Kuroda-Kawaguchi T,Minx PJ,et al.The male-specific region of the human Y chromosome is a mosaic of discrete sequence classes.Nature.2003,423(6942):825-37)
Y特异区由异染色质区和常染色质区构成。异染色质区共有三段(上图b):①长臂末端与PAR2邻近段,长约40Mb;②着丝粒,长约1Mb;③新近由Skaletshy等在对长臂常染色质区测序时发现的位于染色质区中间的一段长约400kb的异染色质区,它由3000多个长达125bp的串联重复序列构成。Y特异区的常染色质区又根据系列的特点及其与X染色体的关系分为换位区(X-transposed)、X退化区(X-degenerate)和扩增区(ampliconic)。X换位区位于Y染色体短臂,与PAR1仅有一段短的X退化区相隔,并被一段扩增区隔成两段,总长约3.4Mb。该区的系列与Xq21 有99%是相同的,被认为是3百万~4百万年前人类与猩猩分支时,由X染色体转位至Y染色体,故命名为X换位区。X退化区散在分布于Y染色体的短臂与长臂,共有27个与X染色体相对应的单拷贝基因和假基因,同源性可达60%~96%。这种现象可能是X、Y染色体共同从常染色体进化的遗迹。扩增区也呈散在分布,总长约10.2Mb,该区命名的根据是存在非常相近的序列,存在几十kb甚或几百kb序列99.9%相同的现象。扩增区最大的序列结构特点是有8大回文结构序列,这些回文结构长9kb~1.4Mb,8大回文结构序列总长达5.7Mb,占Y特异区总长的约1/4。扩增区还存在反向重复序列(inverted repeat,IR),主要有IR1、IR2和IR3,重复序列长度为62~298kb,有99.66%~99.95%相同。
Y染色体微缺失主要发生在位于长臂5~6区间的无精子因子区域(azoospermia factor,AZF),共有三个区域(上图b):AZFa、AZFb和AZFc;其中,AZFb与AZFc是相互重叠的。这三个区域缺失的发生率在不同地区和不同实验室报道结也不完全一致。但大多数结果表明:AZFc缺失所占比率最高,达80%左右,其次是AZFb缺失,接近10%,再次是AZFb与AZFc共同缺失,约占5%,AZFa发生率最低,仅占总发生率的3%左右。
近年来,研究者们加强了对Y染色体微缺失的发生机制的研究,并阐明了大部分Y染色体微缺失发生的经典机制——同源重组。同源重组能解释所有的发生在AZFa区、AZFb区和AZFc区的全区缺失。本世纪初,几个研究小组几乎同时发现了AZFa区全区缺失发生的机制:在AZFa区发现了两段同源性很高的人类内源性反转录病毒序列,分别分布在AZFa微缺失的两个断端,大部分的AZFa微缺失是由于这两个人类内源性反转录病毒序列中的同源序列重组,造成792kb的片段缺失,使AZFa区仅有的两个Y染色体单拷贝基因DBY和USP9Y丢失。AZFb和AZFc区的微缺失也主要是这些区域内分布在回文结构中的同源性高的扩增子发生同源重组而致。其中,AZFb区缺失主要是由于回文结构P5与P1近端同源重组,造成6.2Mb的缺失和共32拷贝的基因和转录单位的丢失;不育男性发生Y染色体微缺失最常见的是AZFc区全部缺失,其机制是由于回文结构P3中的扩增子b2与P1中的扩增子b4同源重组,造成3.5Mb的缺失和共21拷贝的基因和转录单位的丢失;而AZFb区和AZFc区共同缺失可能有两种重组方式——回文结构P5与P1远端同源重组,造成7.7Mb的缺失和共42拷贝的基因和转录单位的丢失,或回文结构P4与P1远端同源重组,造成7.0Mb的缺失和共38拷贝的基因和转录单位的丢失。
同源重组也能解释部分的AZF区部分缺失。AZFc区部分缺失的发生率较高。Repping等发现了三种AZFc区部分缺失的方式,并阐明了发生机制(图2a)。gr/gr缺失是由于扩增区g1、r1、r2分别与g2、r3、r4同源重组所致,造成AZFc 区1.6Mb片段的缺失和9拷贝的基因和转录单位的丢失。b1/b3缺失是由于扩增区b1与b3同源重组所致,AZFc区缺失片段长度也为1.6Mb,共有12拷贝的基因和转录单位的丢失。b2/b3缺失的机制稍复杂,有两种可能的机制:一种是先通过g1、r1、r2与g2、r3、r4发生倒位,使b2与b3的方向一致,再由b2与b3发生同源重组;另一种可能是b2与b3发生倒位后再同源重组。这两种方式的结果是一致的,都造成了相同的长1.8Mb片段的缺失,同源重组解释了迄今所发现的大部分Y染色体微缺失,但仍由小部分发生在AZF区域的部分缺失不能用这种机制解释。
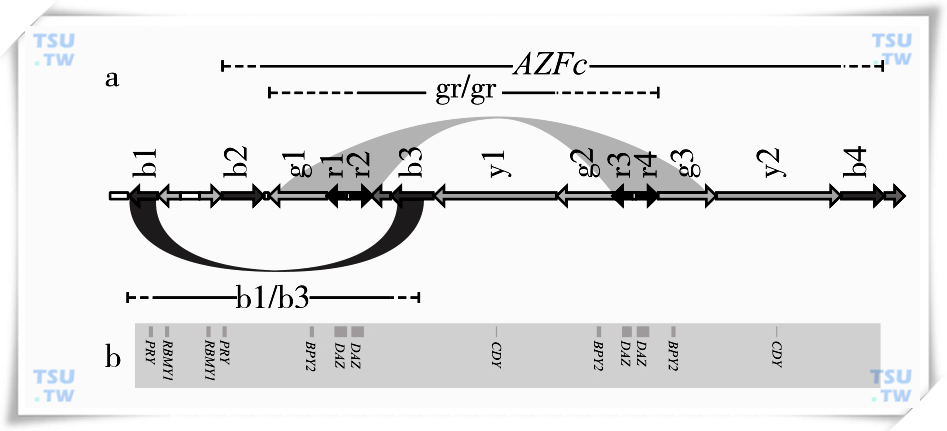
图2 AZFc区gr/gr和b1/b2微缺失机制和基因分布
近年来,随着对Y染色体微缺失研究的广泛开展与深入,不同AZF区域的微缺失与表型有些联系。AZFa区微缺失多为AZF区全部缺失,表现为无精和唯支持细胞综合征。唯支持细胞综合征患者AZFa区的微缺失高达55%。AZFa区微缺失,也有部分缺失而只影响DBY或USP9Y单个基因的报道,患者睾丸的表型多样化,但这种缺失形式还未被较多的研究证实。AZFb区全部缺失,或AZFb和AZFc同时缺失时,患者表型同AZFa区全缺失相类似,表现为精子发生停滞和唯支持细胞综合征。AZFc区缺失的患者临床和睾丸组织学表型多样化,一般多有精子发生,甚至能使妻子自然受孕而传给下一代。AZF区域微缺失与表型的联系对于治疗有指导性意义:一般认为,AZFa区、AZFb区发生全部缺失的患者,以及部分AZFc区微缺失的患者,由于睾丸内无精子产生,故不推荐做睾丸穿刺取精和卵泡浆内单精子注射术(ICSI);对于部分AZFc区微缺失而睾丸内有精子产生的病例,可考虑睾丸穿刺取精和ICSI,但同时也要考虑成功率和微缺失的可遗传性。Selman等报道了一个DAZ,BPY2和CDY1基因缺失的32岁特发性无精患者,睾丸精子发生停滞于精母细胞阶段,用促性腺激素治疗后有精子产生,并顺利通过ICSI技术使其妻生出两个健康的女婴。因此,对于有Y染色体微缺失无精患者的治疗,值得进一步研究。
一般认为,Y染色体微缺失致男性不育的分子机制主要是Y染色体缺失区域存在与精子发生相关的基因。男性只有一条Y染色体,如果发生缺失就会有相应表型出现。单个拷贝的缺失可能就会影响基因功能的发挥,这些基因多为多拷贝基因,可能存在数目叠加效应。目前,随着基因组计划的完成,AZF各区的基因已经明确(图1b,图2b),这些基因的功能已成为后基因组时代的研究热点,也是阐明Y染色体微缺失致男性不育和表型的分子机制的主要途径。
原癌基因与精子发生
精子发生的过程是细胞分裂增殖和细胞凋亡都很旺盛的过程。原癌基因参与细胞生长、分裂分化以及凋亡等过程,对精子发生发挥着重要作用。在生精细胞的不同发育阶段常有一些原癌基因表达,这些原癌基因主要有:蛋白激酶类,包括c-kit、c-abl、c-mos、c-raf等;GTP结合蛋白类,主要是ras家族,包括H-ras、K-ras、N-ras;核转录因子,如c-fos、c-jun;Wnt-1。这些原癌基因的表达产物对生精细胞的增殖、分化和变态有重要调控作用,突变或表达异常可引起精子发生障碍和(或)不育。
其他参与精子发生基因包括:编码睾丸特异的RNA结合蛋白基因,调节生精细胞周期的周期蛋白基因,减数分裂基因,调节核蛋白转型的基因,细胞骨架蛋白基因等。
