胰岛素的生物合成在胰岛β细胞内进行。人胰岛素原(proinsulin)是胰岛素(insulin,INS)和C-肽(C-peptide,C-P)的前体,由86个氨基酸组成。胰岛素由51个氨基酸组成,分为A、B两条肽链,A链含21个氨基酸残基,B链含30个氨基酸残基,两链之间在A7和B7,A20和B19的半胱氨酸(Cys)由两个二硫键相连接;A链在A6和A11也有一个二硫键相连接使胰岛素成为立体结构。C-肽由31个氨基酸组成的连接肽。胰岛素和C-肽之间各有两个碱性氨基酸即与B链羧基相连的有两个精氨酸和与A链端相连的各有一个赖氨酸和一个精氨酸(下图)。
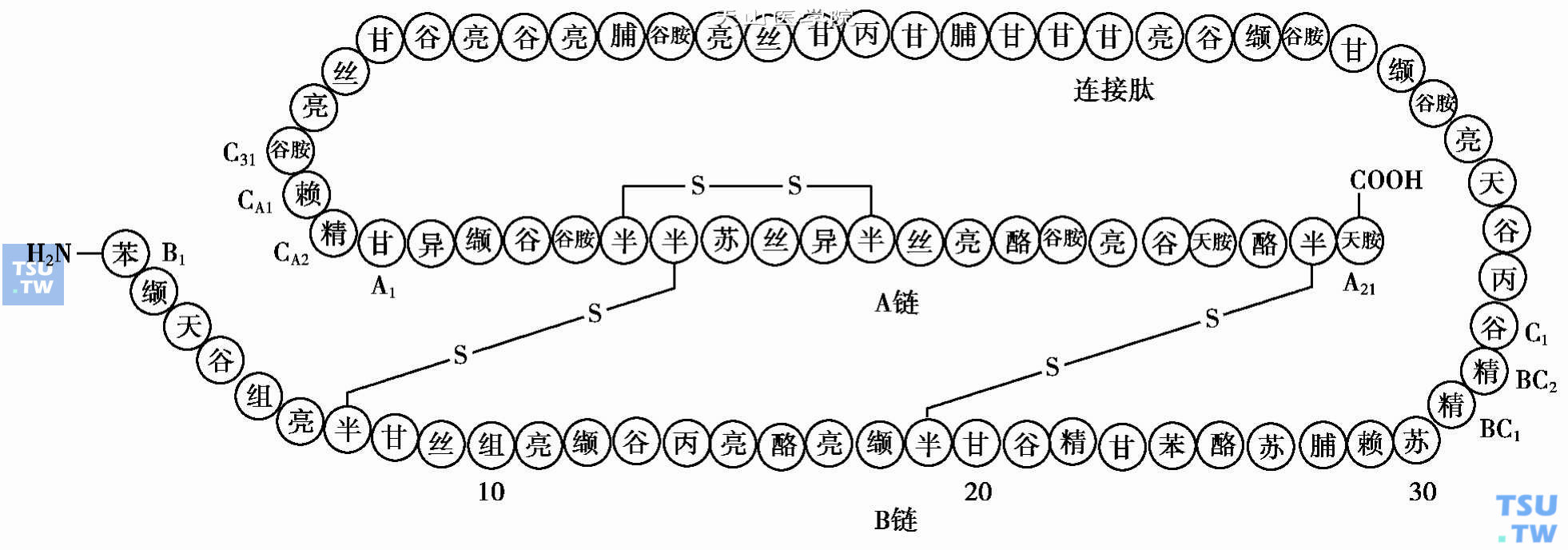
人胰岛素原结构
在人胰岛素原前的N端尚有一个延伸出一段富含疏水性的23个氨基酸,在胰岛素基因有RNA聚合酶的作用下转录,产生mRNA,在核糖体合成由109个氨基酸构成的前胰岛素原(preproinsulin)(下图)。在胰岛β细胞内的前胰岛素原中的23个富含疏水性的氨基酸,有利于穿透β细胞内的粗面内质网膜的磷脂层,将其他肽段拉入内质网池,在特异蛋白内肽酶的作用下,很快将这段23个氨基酸肽链切除而脱离内质网,余下的即为胰岛素原。当胰岛β细胞受应激(如葡萄糖)刺激后,在供能的条件下,将胰岛素原转运至高尔基复合体,形成具有二层膜结构的未成熟的β颗粒。从高尔基复合体产生芽孢样突起脱落入胞质内,储存于光面微泡囊内(分泌小泡)。经特异蛋白水解酶的作用,将胰岛素和C肽相连的两对碱性氨基酸切开分解成胰岛素和C肽并形成二硫桥而成熟,β分泌颗粒在成熟过程中需要结合锌并储存起来。成熟的β颗粒在释放前转移至微管-微丝附近,在葡萄糖代谢供能条件下,促进钙离子进入细胞后,使β颗粒依附于微管-微丝上,再由后者收缩,使β颗粒转运至细胞膜下,由囊腔膜及细胞膜融合后释放胰岛素。
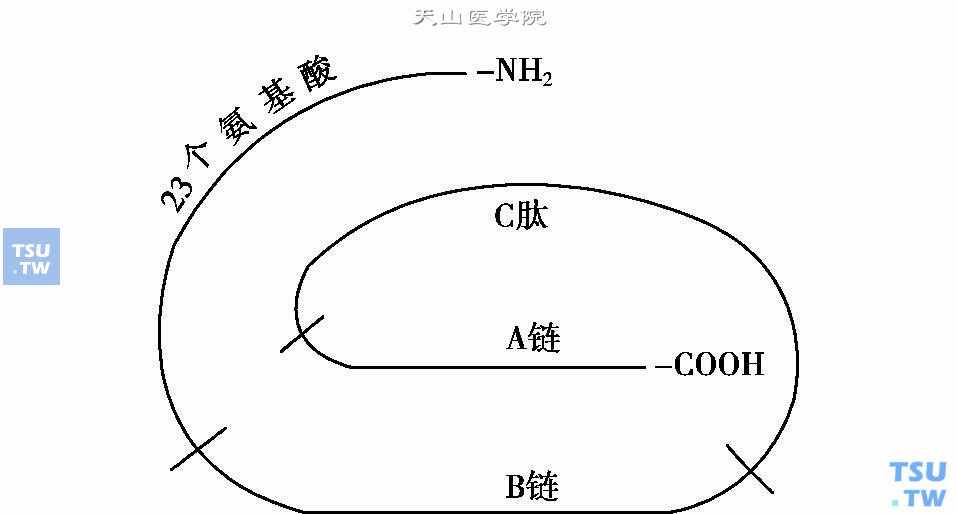
前胰岛素原结构示意图
胰岛素基因存在于所有的细胞,并在这些细胞具有相同的拷贝和同样的结构,但经特殊的分子水平调控选择性地在胰岛β细胞表达。当某一个信号尤其是葡萄糖的刺激到达β细胞时,胰岛素的合成和分泌协同进行,其作用幅度取决于细胞内的代谢速率、葡萄糖浓度和刺激时间。微管收缩将这些颗粒移到细胞质周边,β颗粒与细胞膜融合,经胞饮作用,冲破膜外表面,β颗粒解体,同时释放出胰岛素、C肽和部分未被分解的胰岛素原(从β颗粒形成到分泌胰岛素约需1~2小时)到达胰静脉→门静脉→肝脏→肝动脉→体循环(下图)。在正常情况下,分泌的成分中胰岛素和C肽占94%,胰岛素原及其中间产物占6%。
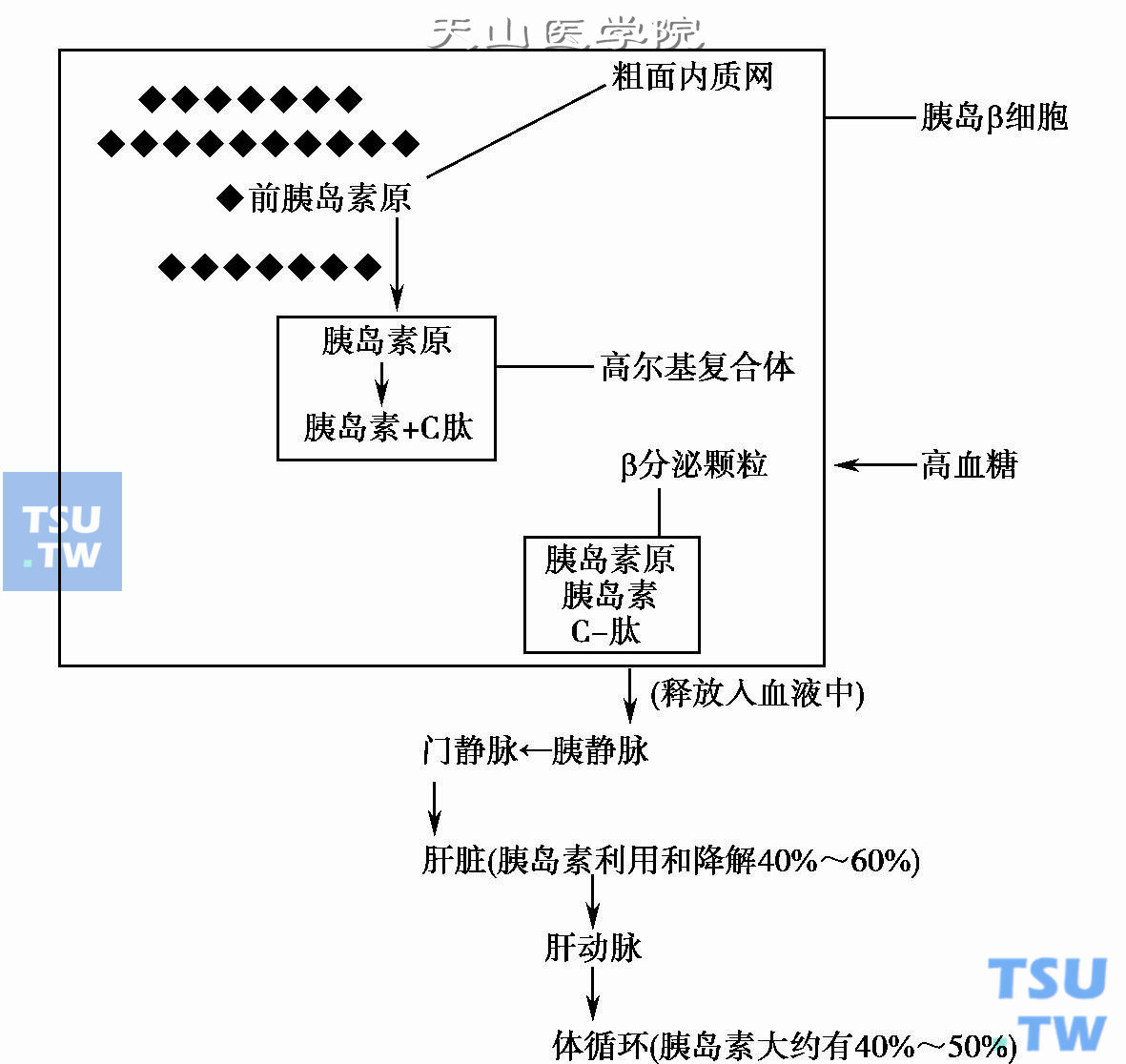
胰岛素的生成和代谢途径示意图
钙离子在胰岛素分泌过程中具有重要的作用,细胞质中钙离子可以增加微管的活动,加速β颗粒的移动,有利于胰岛素的分泌。
人血浆中胰岛素的基础水平平均为10μU/ml (60pmol/L或0. 4ng/ml)。正常人在标准餐后,血浆中胰岛素浓度很少超过100μU/ml,进餐后8~10分钟血浆胰岛素升高,30~45分钟达到高峰,此后迅速下降,并于90~120分钟时恢复到基础水平。
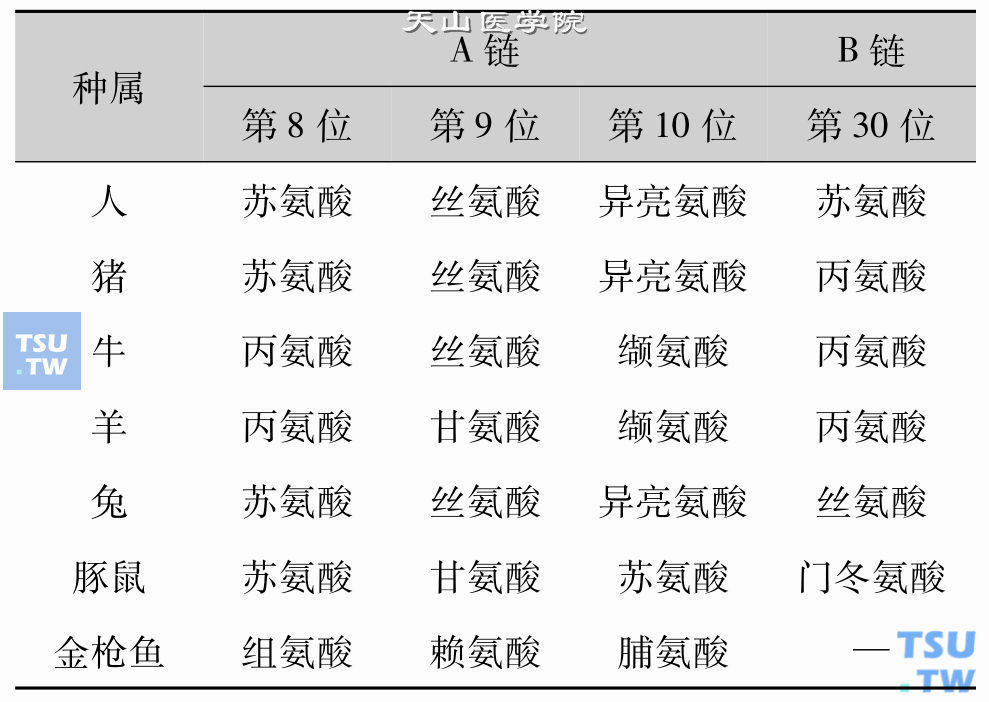
不同种属动物胰岛素与人胰岛素的结构是有差别的。如下表所示,猪胰岛素与人胰岛素结构相比较,仅在B链上的第30位氨基酸不同,而牛胰岛素与人胰岛素的结构除了第30位氨基酸不同外,在A链第8位和第10位的氨基酸也不同。所以,在临床上常用猪胰岛素治疗糖尿病患者。
胰岛素原具有胰岛素相似的作用,其强度较弱,大约为胰岛素生物效应的1 /10~1 /15,故胰岛素原本身也具有弱的胰岛素样生物活性。但由于胰岛素原半衰期(18~20分钟)较胰岛素半衰期(6~8分钟)长,其作用时间也较持久。一般认为C肽无生物活性,也不与细胞膜结合,半衰期大约十几分钟,在人体内是否进一步降解尚不清楚,它从尿中排出。此外,在人体血液中还有不能被胰岛素抗体抑制的非抑制性胰岛素样活性物质即胰岛素样生长因子-1(IGF-Ⅰ)和EGF-Ⅱ,该类物质为多肽,其胰岛素样活性明显低于胰岛素。
不同种属动物胰岛素的结构比较