在20世纪早期,一名来自德国柏林的医生Georg Zuelzer发现在切除胰腺引起糖尿病的狗的动物模型上,用胰腺提取物可降低尿液中葡萄糖的排出量;1911年Scott E L用酸乙醛从胰腺中也曾提出过有作用的物质;罗马尼亚生理学教授Nicolas Paulesco于1921年制备出一种胰腺物质能使动物产生低血糖;还有Zuelzer及Kleiner也都接近于制备出该类物质。最后,还是加拿大的四位学者Banting F G、Best C H、Macleod J J R和Collip J B等于1921年首次成功地从狗的胰腺中分离出了这种物质并证明了它的生物学效应;后来,Collip JB将这种物质进行了充分的纯化并用于人体注射治疗以降低血糖。最初他们将这种能降低血糖的物质命名为“Isletin”,后来改名为“Insulin”一词,这确实是一个划时代的贡献。从此以后,1型糖尿病患者注射这种物质不但能长期存活下去,而且可与正常人一样地工作和生活。世界上第一位接受这种胰腺提取物治疗的患者是在加拿大多伦多医院住院的一名14岁的名叫Leonard Thompson的1型糖尿病患者,当时患者的血糖高达27. 8mmol/L (500mg/dl)以上,每日尿量高达3~5L,在每天仅供应450kcal的极严格饮食控制条件下,仍然排出大量的尿糖。患者从1922年1月23日开始每日注射这种新的胰腺提取物后,病情大为改善,血糖下降,尿糖每日排出量从100g以上减少到7. 5g,患儿变得容光焕发,自我感觉良好,最后存活到35岁。当时还有一位叫Ted Ryder的男孩则更为幸运,也接受这种新的胰腺提取物治疗后,生活到76岁,于1993年才去世。由于在胰岛素发现及其对糖尿病治疗上所取得的杰出成就,Banting和Macleod于1923年分别被授予诺贝尔医学奖和生理学奖;随后Banting宣布他将与Best平分奖金,而Macleod也与Collip分享获奖的喜悦。从中人们不难看出,胰岛素的发现和临床应用是研究小组集体协作的结果:在Macleod教授的指导下,以Banting最初的实验结果为基础,Best辅助了整个研究的最终完成,而Collip为确保实验的最后成功作出了一系列具有突破性的贡献,这样才会有最终的成果。
从那时以后至今的80多年中,胰岛素的发展从制剂的杂质较多和免疫原性较强,到纯度不断提高而免疫原性明显降低;作用时间上,从只有短效作用的胰岛素发展到出现中、长效作用的胰岛素;给药方法上,从只能多次皮下注射发展到胰岛素泵的使用;在制剂上,从动物胰脏提取纯化的动物胰岛素发展到重组DNA技术制备的人工合成的人胰岛素及其人胰岛素类似物的出现等一个漫长的征途。1923年美国Eli Lilly公司开始生产这种原始的但是救命的第一代胰岛素制品(RI),但它的纯度非常低,含有许多污染物,如胰岛素样物质(前胰岛素原、胰岛素原、胰岛素的中间产物、胰岛素二聚体、去氨基胰岛素、精氨酸胰岛素、己烷酯胰岛素等)和非胰岛素样物质(胰高血糖素、生长抑素、胰腺多肽和血管活性肠肽等)。当1926年Abel和他的助手以胰岛素结晶形式制备出结晶胰岛素时,其纯度有了很大的提高。Scott和Fisher 于1935年开始进一步用重结晶法制备出略纯一些的结晶胰岛素,称为第二代胰岛素,他们并发现胰岛素的三方体中含有二价的锌元素(Zn2+)及在有Zn2+存在的条件下,提纯的胰岛素更容易结晶从而制备出结晶锌胰岛素酸性溶液(CZI)。RI及CZI的pH为2. 5~3. 5,这样可保持其在溶解状态,当其和输液一起应用时,由于pH的改变会在输液瓶的底部沉淀,易使其作用很不均匀。RI和CZI都是速效型或短效型的胰岛素。1936年Hagedorn等发现当结晶锌胰岛素和碱性蛋白(如鱼精蛋白)结合时其作用时间可延长。Scott等进一步发现在上述复合物中再增加锌的含量可使其作用更为延长而制备出鱼精蛋白锌胰岛素(PZI),它属于慢效型或长效型胰岛素。皮下注射这种胰岛素后在酶的作用下,使蛋白分解而逐渐释放出游离胰岛素再被吸收。
1946年Novo Nordisk公司Hagedorn实验室使用结晶的方法制备出了中性鱼精蛋白锌胰岛素又称低鱼精蛋白锌胰岛素(NPH)[ N(neutral)代表中性,P(protamine)代表鱼精蛋白,H代表发明人Hagedorn H C博士],它是2份RI和1 份PZI的混合剂。NPH的作用时间介于RI与PZI之间。NPH和PZI都含有大分子的鱼精蛋白,能使人体内产生蛋白质抗体,而且鱼精蛋白和胰岛素结合后更容易产生胰岛素抗体,久用可由于胰岛素和胰岛素抗体结合而减低胰岛素的降糖作用,故胰岛素抗体能引起药物剂量逐渐增加,疗效日渐下降,甚至于出现耐药性,注射部位也可出现过敏或脂肪萎缩等副作用;当胰岛素与其抗体解离后释放入血液中的胰岛素浓度增加又可诱发低血糖;动物实验研究还发现,胰岛素抗体还可促使或加重糖尿病的肾脏病变。1951年Hallar maller提炼出高浓度的锌便可和胰岛素结合形成锌胰岛素复合物,再用醋酸盐代替磷酸盐作缓冲剂,即使不加鱼精蛋白也能使其pH在7. 4时保持稳定状态且作用可呈不同时间的延续,即慢胰岛素(lente insulin)系列,其中半慢胰岛素(semi-lente insulin)结晶小,作用时间最快,同RI或CZI相似;特慢胰岛素(ultra-lente insulin)的结晶最大,作用最慢,属于慢效型或长效型胰岛素,与PZI相似;慢胰岛素是由70%的特慢胰岛素和30%半慢胰岛素混合组成属于中效型胰岛素,同NPH胰岛素相似。20世纪70年代以后,丹麦的Novo Nordisk公司使用“凝胶层析分离”和“离子交换层析分离”技术,首先研制出纯度更高、免疫原性更低的属于第三代的单峰胰岛素(1972年)及更进一步提纯的高纯度胰岛素(1980年)为第四代的单组分胰岛素(MC insulin),该类胰岛素制剂不存在可诱发糖尿病患者出现任何不良生物反应的其他物质。我国学者康有厚等报告的单组分胰岛素的临床应用结果表明,单组分胰岛素抗原性低,将结晶猪胰岛素改用单组分胰岛素后可使胰岛素抗体水平下降和胰岛素剂量减少,并对皮下脂肪萎缩有明显改善。
长期注射动物胰岛素的患者体内出现相应胰岛素抗体的原因是由于动物胰岛素与人胰岛素氨基酸的结构不同,动物胰岛素作为异性抗原在人体内产生抗体。因此,提出了使动物胰岛素向人胰岛素的研制和生产工艺。人胰岛素的研制和生产始源于1963年Mirsky等从人尸体的胰腺中提取,1974年Sieber等实现了从氨基酸中的化学合成。1978年 Homanberg等和Morihara等以猪胰岛素为底物,采用酶切技术将猪胰岛素B链第30位的丙氨酸一次性移换成苏氨酸即成为人胰岛素的氨基酸结构,建立了半合成人胰岛素的工业性生产工艺。与此同时,应用基因工程/重组DNA技术经微生物(如细菌、酵母菌等)发酵合成人胰岛素也已获得成功,并有各种剂型的人胰岛素已经应用于临床治疗糖尿病患者。
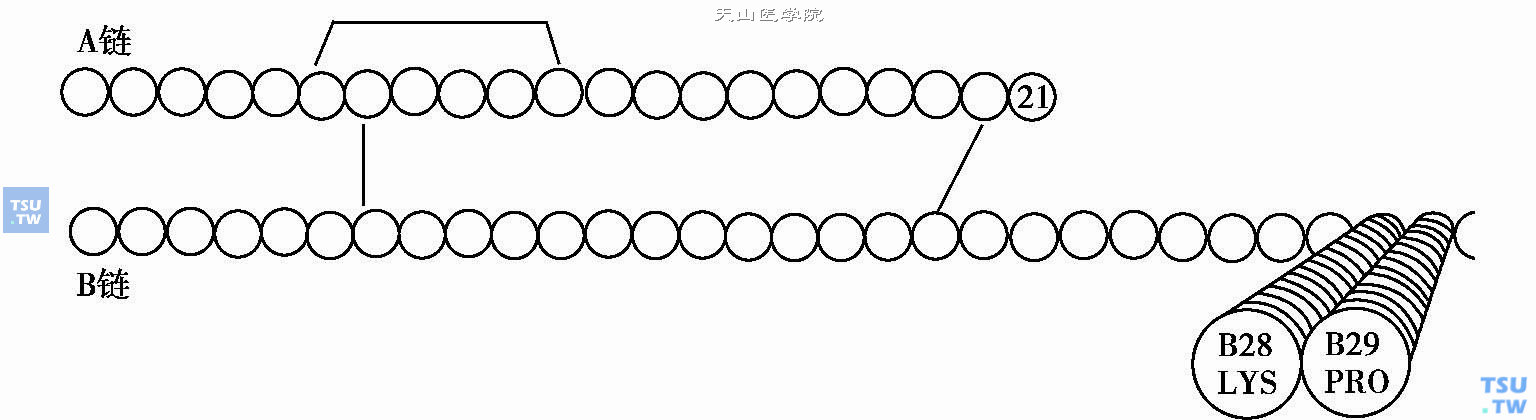
人胰岛素类似物的结构
药用胰岛素注射后比人体内生胰岛素吸收慢,高峰时间延迟,持续时间长,与人体内血糖的变化规律不相吻合,必须餐前15~30分钟有时甚至需要餐前45~60分钟注射才能控制餐后的高血糖,其原因是药用胰岛素不是单体而是易发生聚变的含锌离子的六聚体;而且由于维持作用时间较长,易增加两餐间低血糖发生的危险;NPH或特慢胰岛素常因使用时混悬不充分而造成吸收变异程度大,且在注射后4~10小时呈现较明显血药高峰,睡前注射后易产生夜间低血糖。药用胰岛素六聚体的产生取决于胰岛素的结构,易发生聚变的关键部位是胰岛素B链第28位和第24~26位的氨基酸。1992 年Lilly公司采用基因重组技术,将人胰岛素结构中的B链第28位的脯氨酸(PRO)和第29位的赖氨酸(LYS)位置互换成为类似胰岛素生长因子-1 (IGF-1)的结构[ Lys(B29),Pro(B28)],取名为LYSPRO即为人胰岛素类似物(上图),其作用与内生胰岛素相似,在溶液中表现为单体胰岛素的理化特性,它与锌离子的亲和力较低,注射后吸收及代谢均较快,作用持续时间相对较短,注射后大约4~5小时可降至基础水平,与进餐后内生胰岛素浓度的变化相似。人胰岛素类似物由于免疫原性低而用量小,作用快而无需提前注射胰岛素,持续时间短而不易发生餐前低血糖反应。1996年该药已应用于临床,商品名为“优必林”(humalog)。1993年Novo-Nordisk公司又研制出一种长效人胰岛素类似物,是将人胰岛素B链第29位的赖氨酸用脂肪酸酰基化的类似物(NN304)替代。当NN304注入体内后,它能与白蛋白上的脂肪酸结合位点可逆地结合而免受降解,使半衰期明显延长,可达14小时。结合状态的NN304无生物活性,在体内缓慢解离可恢复活性而发挥作用,故注射NN304后的血糖曲线波动较宽平,没有血糖清除高峰,无夜间低血糖的危险,也无清晨高血糖出现。还有一种新研制的长效胰岛素类似物(HOE901)是将人胰岛素A链第21位天门冬酰胺用甘氨酸替换,以改善胰岛素的稳定性。与NPH的临床对比研究显示,HOE901可使空腹血糖进一步下降,而严重低血糖反应的发生无明显增加。
我国在胰岛素的研制和生产方面也取得了长足的进展,1965年我国的科学工作者成功地合成了具有生物活性的结晶牛胰岛素;现在生产的动物RI和PZI以及单峰制剂已能满足临床上的需要。20世纪90年代末期又研制出了人胰岛素,并已在临床上应用。深信不久的将来,我国在胰岛素的研制和生产方面一定会有更进一步的发展。
