线粒体主要功能是能量转换,即将营养物质贮存的化学能转换为细胞可利用的ATP。即通过氧化磷酸化方式将营养物质中能量转换为ATP化学能。线粒体由内外两层膜封闭,包括外膜、内膜(嵴)、膜间腔和基质四个功能区隔。外膜平滑,内膜则折成长短不等的嵴并附有基粒。内外膜之间为线粒体的膜间腔,与嵴内隙相连,内膜内侧的空间称为线粒体基质(图3-1-3)。线粒体有 1000 种以上的酶和其他蛋白质,这些酶和蛋白质按精确的顺序合理分布于线粒体的各个不同部位。因此,有人称线粒体为细胞的“酶袋子(bag of enzymes)”。在肝细胞线粒体中各功能区隔蛋白质的含量依次为:基质67%、内膜21%、外膜8%、膜间隙4%。内膜上镶嵌的蛋白质密度是各种生物膜中最高的,线粒体氧化磷酸化酶系复合物、各种转移载体和输入结构装置等都位于内膜上。同时内膜脂类组成特点是:心磷脂(cardiolipin)含量高,占10%~20%,几乎不含胆固醇。从能量转换角度来说,内膜起主要作用。催化三羧酸循环,脂肪酸和丙酮酸氧化以及血红素合成的酶类均位于基质中,基质还具有一套完整的转录和翻译体系,包括线粒体DNA(mtDNA),70S核糖体,tRNAs、rRNA、DNA聚合酶、氨基酸活化酶等。因此,内膜和基质是线粒体功能主要承担部位。内外膜的通透性不同,外膜的通透性高,可容许多种物质通过,而内膜则构成明显的通透屏障,使一些物质如蔗糖和NADH全然不能通过,而其他物质如Na+和Ca2+等也只有借助于主动运输才能通过。
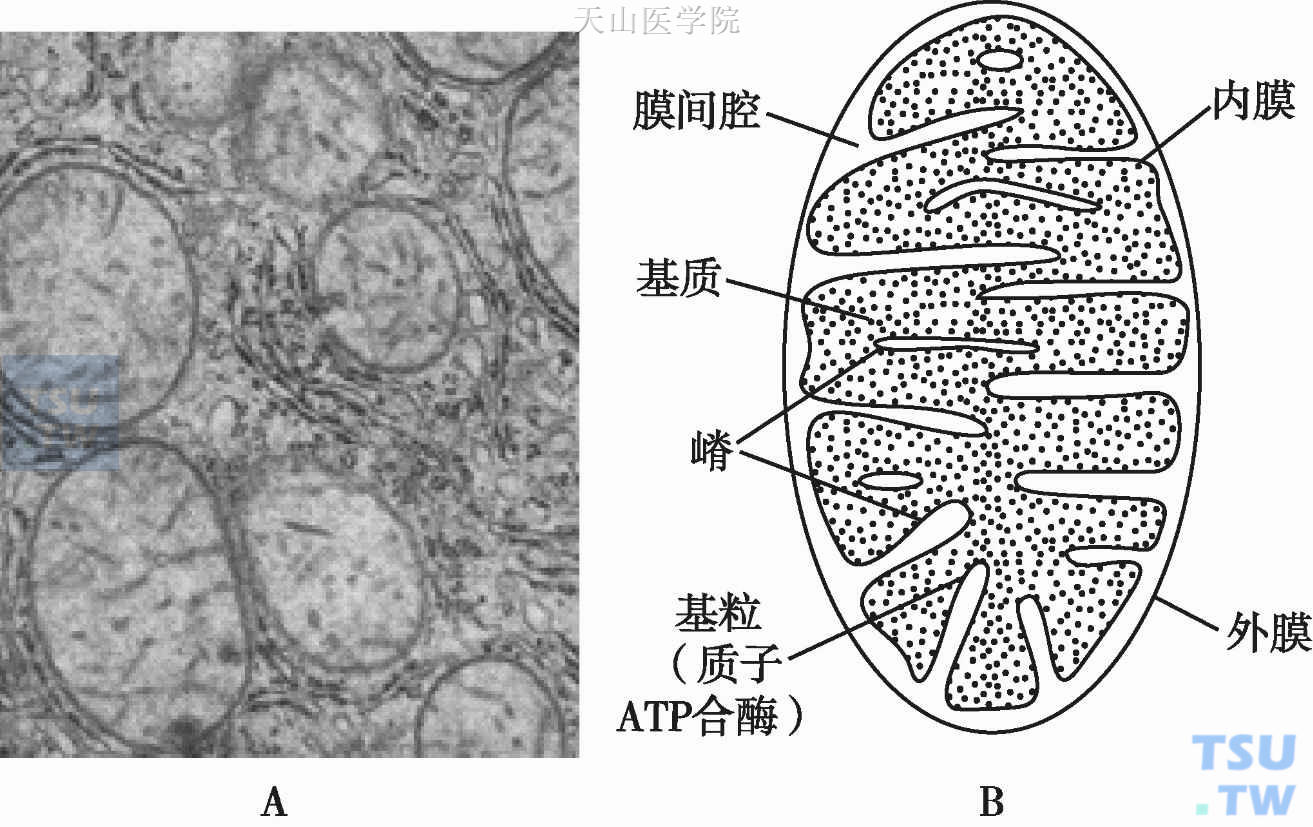
图3-1-3 (A)大鼠肝线粒体透射电镜照片(×15 000);(B)线粒体结构模式图
线粒体电子传递链
线粒体电子传递链(electron transfer chain)。三羧酸循环产生的还原当量(NADH+H+、FADH2)经线粒体内膜上的电子传递链的连续传递,最终与氧结合生成水,在此过程中同时释出大量的自由能。电子传递链(也称呼吸链)是镶嵌在线粒体内膜上一系列氧化还原复合体(递氢体和递电子体)组成的连锁反应体系,其本质是一些酶和辅助因子,形成四个复合物(图3-1-4):复合物Ⅰ(NADH-泛醌氧化还原酶):催化NADH氧化和辅酶Q(coenzyme Q,CoQ)还原;复合物Ⅱ(琥珀酸-泛醌氧化还原酶)又称琥珀酸脱氢酶:催化琥珀酸氧化和CoQ还原;复合物Ⅲ(泛醌-细胞色素氧化还原酶):催化Co QH2氧化和Cyt c还原;复合物Ⅳ(细胞色素C氧化酶):催化Cyt c氧化和O2还原。这些复合物组成两条呼吸链:NADH氧化呼吸链和琥珀酸呼吸链。人体内大多数脱氢酶都以NAD+作辅酶,在脱氢酶催化下底物SH2脱下一对氢交给NAD+生成NADH+H+,NADH+H+的一对氢经NADH呼吸链传递,最后交给氧结合生成水。凡底物脱下的氢直接(如琥珀酸、线粒体内α-磷酸甘油)或间接交给FAD(如脂酰辅酶A)而生成FADH2,均进入琥珀酸氧化呼吸链或FADH2氧化呼吸链。
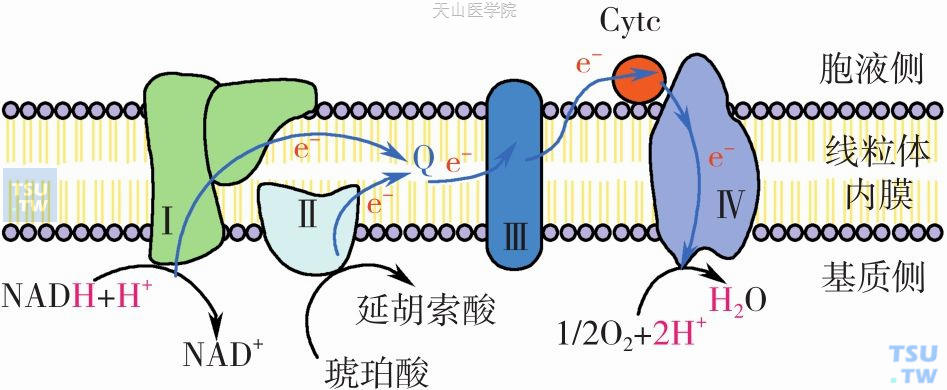
图3-1-4 线粒体内膜电子传递链复合物
线粒体氧化磷酸化
线粒体氧化磷酸化(oxidative phosphorylation)。还原当量(NADH+H+、FADH2)经呼吸链电子传递过程中释放出自由能,推动ADP磷酸化生成ATP过程,称氧化磷酸化,又称为耦联磷酸化。氧化和磷酸化是两个不同的概念。氧化是底物脱氢或失电子的过程,而磷酸化是指ADP与Pi合成ATP的过程。在结构完整的线粒体中氧化与磷酸化这两个过程是紧密地耦联在一起的,即氧化释放的能量用于ATP合成,这个过程就是氧化磷酸化,氧化是磷酸化的基础,而磷酸化是氧化的结果。氧化磷酸化耦联机制可用化学渗透学说来阐明(图3-1-5),具体内容包括:①呼吸链在传递电子过程中释放的能量不断地将线粒体基质内的H+逆浓度梯度泵出线粒体内膜;②H+不能自由透过线粒体内膜,结果使得线粒体内膜外侧H+浓度增高,基质内H+浓度降低,在线粒体内膜两侧形成一个质子跨膜梯度,线粒体内膜外侧带正电荷,内膜内侧带负电荷,这就是跨膜电位(ΔΨm)。由于线粒体内膜两侧H+浓度不同,内膜两侧还有一个pH梯度ΔpH,膜外侧pH较基质pH约低1.0单位,底物氧化过程中释放的自由能就储存于ΔΨm和ΔpH,两者合称质子电化学梯度(proton electrochemical gradient,ΔµH+);线粒体外的H+可以通过线粒体内膜上的ATP合酶(ATP synthase,也称F0 F1复合物或复合物V)并顺着H+浓度梯度进入线粒体基质中,这相当于一个特异的质子通道,H+顺浓度梯度方向运动所释放的自由能用于ATP的合成。
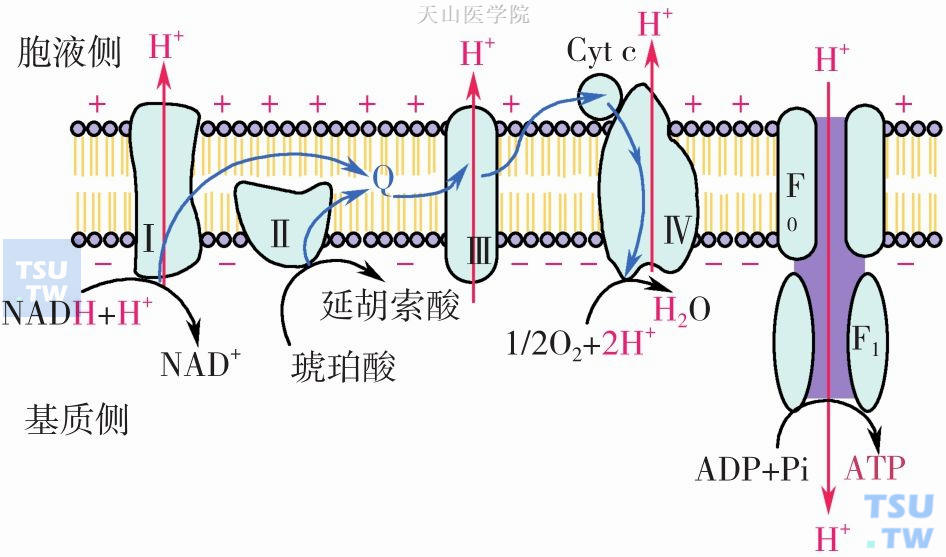
图3-1-5 氧化磷酸化偶联的化学渗透学说模式图
线粒体氧化磷酸化的调节
(1) ADP/ATP 相互转换是调节氧化磷酸化速率的主要因素:正常机体氧化磷酸化速率主要受ATP/ADP 比例调节。因为呼吸链的电子传递与ATP 生成紧密耦联、相互依赖,所以ATP 生成以呼吸链电子传递为前提,ADP 磷酸化又能推动电子传递过程。完整线粒体只有ADP 和Pi 充足时电子传递才能有效进行。
(2) 甲状腺素刺激机体耗氧量和产热同时增加:甲状腺激素诱导细胞膜上Na+-K+-ATP 酶的生成,使ATP 加速分解为ADP和Pi,ADP 增多则促进氧化磷酸化。甲状腺激素可促进机体耗能和产热;甲状腺激素(T3)还可诱导解耦联蛋白基因表达,引起营养物质氧化分解释能和产热均增加,但ATP 合成相对减少,所以甲状腺功能亢进患者表现基础代谢率增高。
(3) 解耦联剂(uncoupler)可使氧化与磷酸化耦联分离(解耦联),其机制是破坏电子传递过程建立的跨内膜的质子电化学梯度,使电化学梯度储存的能量以热能形式释放,ATP 的生成受到抑制。如经典解耦联剂二硝基苯酚(dinitrophenol,DNP)具有质子转运载体功能的脂溶性分子,在线粒体内膜中可自由移动,进入基质侧时释出H+,返回胞质侧时结合H+,从而破坏了电化学梯度导致氧化磷酸化解耦联。
机体内有一类具有类似DNP作用的生理性解耦联剂,如线粒体内的解耦联蛋白(uncoupling protein,UCP)家族,在机体能量代谢调节和体温调节等方面发挥作用。UCP家族有5个同源物,由2 个32kD 亚基组成的同源二聚体,每个单体为6 跨膜蛋白,含3 个类似的2 次跨膜结构,具有转运质子功能,消除跨内膜质子电化学梯度势能而发挥解耦联作用。人(尤其是新生儿)和其他哺乳动物中存在含有大量线粒体的棕色脂肪组织,其线粒体内膜中富含解耦联蛋白1(uncoupling protein1,UCP1)。UCP1在内膜上形成质子通道,H+可经此通道返回线粒体基质,从而消耗呼吸链氧化建立的跨内膜质子电化学梯度势能,并以热能形式释放。目前提出了两种模型来解释UCP1转运质子的机制(图3-1-6):模型a:UCP1通过转运脂肪酸来消除内膜质子梯度,脂肪酸的羧基具有转运质子功能,UCP1将内膜外结合质子脂肪酸转运到线粒体基质并释放出羧基上的质子;模型b:质子化的脂肪酸可通过自由扩散方式进入线粒体基质,释出质子的脂肪酸由UCP1转运出线粒体内膜。上述UCP1转运质子都需要游离脂肪酸参与,所以游离脂肪酸也是生理性的解耦联剂。因此,棕色脂肪组织(brown adipose tissue,BAT)线粒体通过UCP1不断消耗质子梯度方式将营养物氧化分解释放的能量转变为热能以达到维持体温和御寒的目的。新生儿硬肿症因缺乏BAT,不能维持正常体温而使皮下脂肪凝固。UCP2 广泛存在于全身组织,尤其白色脂肪组织高表达,UCP2 表达下降可促进肥胖的发生,而肥胖抵抗大鼠白色脂肪组织中UCP2 表达增强。UCP2还能负性调控胰岛素的分泌,可能与2 型糖尿病发病相关。此外,UCP2在控制线粒体活性氧簇(reactive oxygen species,ROS)产生方面发挥作用。成人中棕色脂肪很少,所以主要表达于骨骼肌和心肌组织的UCP3可能在成人能量消耗中发挥作用。UCP3主要分布于BAT和骨骼肌,在能量平衡和脂类代谢也发挥重要作用。
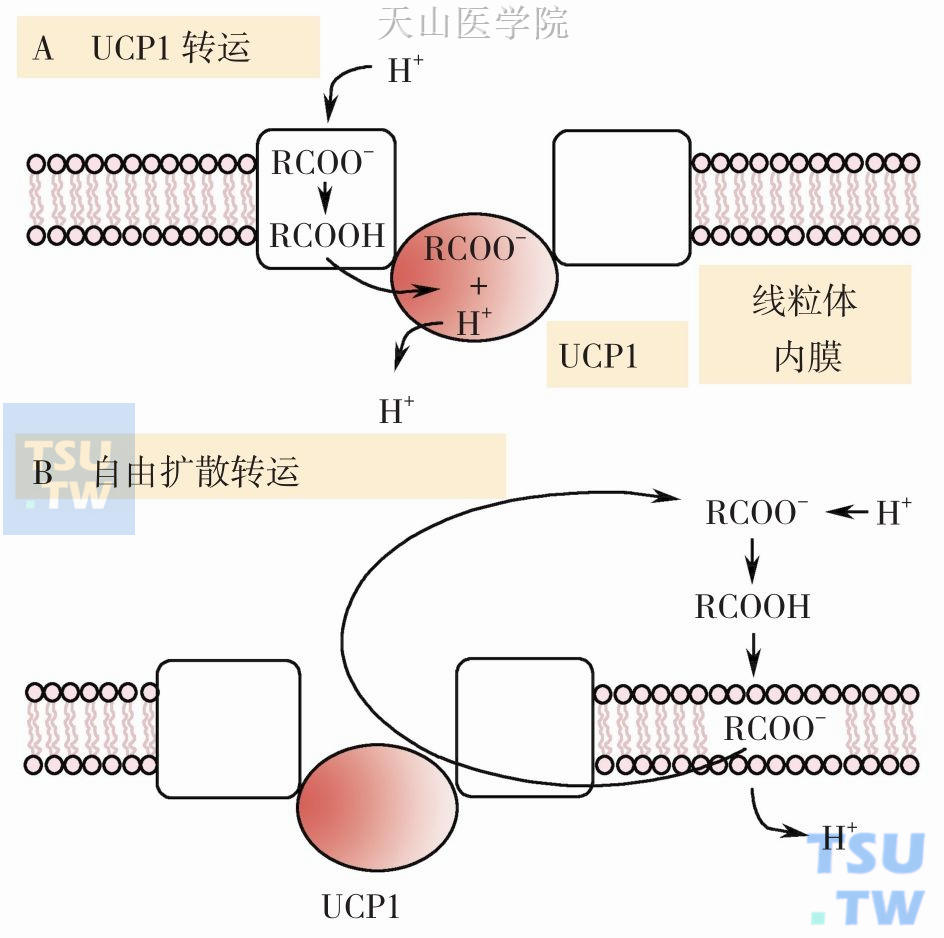
图3-1-6 UCP1转运质子的模型
