维生素B1是最早发现的水溶性B族维生素,因其结构中有含S的噻唑环与含氨基的嘧啶环而又得名硫胺素(thiamine)(图3-5-1)。1897 年Christiaan Eijkman首次明确了精白米与脚气病的关系,他的研究发现导致了维生素的发现,并于1929年获得了诺贝尔奖。1911年 Casimir Funk从米糠中分离到抗脚气病的化合物并命名其为维生素(vitamine),1926年Barend Coenraad等第一次成功地分离和结晶得到了维生素B1。1937年Lohman和 Schuster明确了维生素B1磷酸化衍生物二磷酸硫胺素 (thiamine diphosphate,ThDP) 是丙酮酸氧化脱羧的辅助因子,之后陆续发现了维生素B1其他磷酸化衍生物,以及在氧化脱羧催化中的作用。维生素B1的发现极大地推动了维生素的相关研究,以及物质代谢与疾病关系的研究。
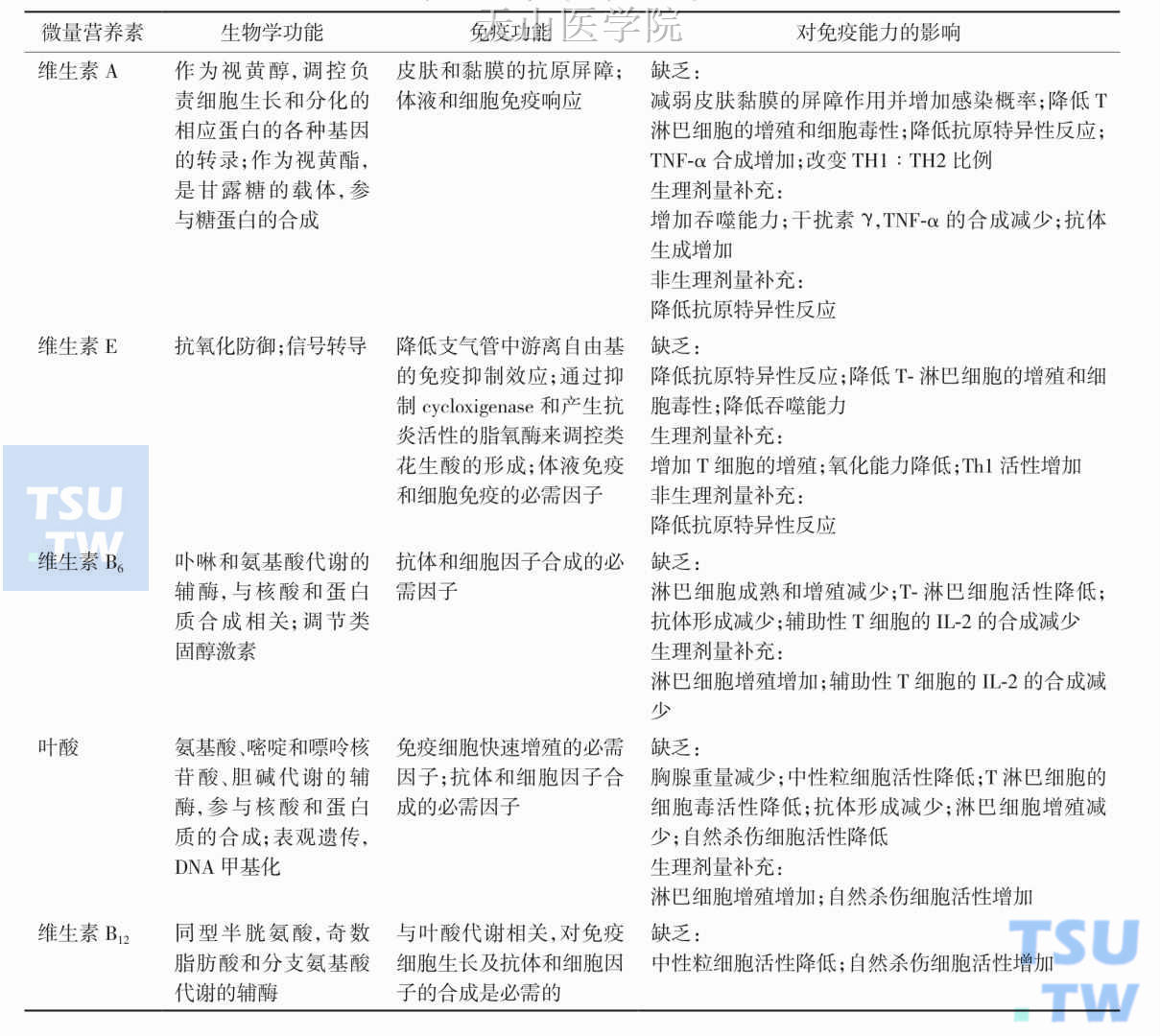
表3-5-1 部分维生素的免疫作用
维生素B1磷酸衍生物及其功能
维生素B1易被小肠吸收并通过血液运输进入全身组织细胞,在细胞内可形成五种磷酸化衍生物:一磷酸硫胺素(ThMP)、二磷酸硫胺素(ThDP)常称为焦磷酸硫胺素(TPP)、三磷酸硫胺素(ThTP)以及腺苷二磷酸硫胺素(AThDP)和腺苷三磷酸硫胺素(AThTP)。这些磷酸化衍生物可能具有不同的生理作用,其中的一些作用和机制尚不清楚。
TPP是维生素B1在生物体内的主要活性形式,经由硫胺素焦磷酸激酶催化生成。TPP是多种脱羧酶的辅酶:胞质转酮醇酶(TKT)辅酶,线粒体丙酮酸脱氢酶复合体(PDH)、α-酮戊二酸脱氢酶复合体(α-KDH)和支链酮酸脱氢酶的α-酮酸氧化脱羧酶辅酶,以及过氧化物酶体的α-羟植烷酰CoA裂解酶(α-HPCL)的辅酶。PDH和α-KDH是葡萄糖有氧氧化分解产生ATP的关键酶,其中PDH是糖酵解产物丙酮酸进入线粒体氧化分解的关键酶;TKL是胞液磷酸戊糖途径中多种单糖间转换和磷酸戊糖生成的关键酶,这对于增殖旺盛的细胞非常重要(图3-5-2)。支链酮酸脱氢酶是支链氨基酸氧化分解的关键酶,α-HPCL在3-甲基分支脂肪酸α-氧化反应中催化C-C键裂解反应。因此,TPP是糖、脂肪酸和氨基酸氧化代谢中重要的辅助因子。细胞内TPP动态平衡除了与维生素B1补充之外,还取决于硫胺素焦磷酸激酶(硫胺素 + ATP → TPP + AMP)和硫胺素二磷酸酶(TPP + H2O → 硫胺素 + 2Pi)两者基因表达和活性调节密切相关。
其他维生素B1磷酸衍生物:ThTP长期认为有专一激活神经活性,然而近来发现细菌、真菌、植物和动物中普遍存在,在一些动物组织中ThTP可以磷酸化修饰蛋白质。这提示ThTP可能与细胞基本代谢功能和细胞信号转导相关。ThTP由ThDP磷酸化合成,除了细胞质的腺苷酸激酶1外,还可以由线粒体内FoF1-ATP 合酶催化,类似于氧化磷酸生成ATP,也即依赖线粒体化学渗透机制,这些提示ThTP可能与细胞力能学有关。ThMP功能目前还不清楚。
AthDP少量存在于脊椎动物肝脏,其功能不清楚,AthTP主要存在于细菌,可占到细菌细胞内硫胺素总量的20%,而在酵母、高等植物和动物组织中含量较少,其功能不清楚。最近研究表明AthTP可与多聚(ADP-核糖)聚合酶1(PARP1)特异性结合,微摩尔级水平AthTP可抑制PARP1活性,而PARP1过度激活与各种应激性疾病(包括糖尿病)密切相关。研究发现高剂量硫胺素可明显改善糖尿病并发症。这表明AthTP作为PARP1抑制剂的药理学作用。
总之,除了TPP作为酶辅助因子的重要代谢作用之外,其他维生素B1磷酸衍生物可能具有非酶辅助因子的作用,并且也与维生素B1缺乏的各种临床病症发生相关。
维生素B1缺乏症
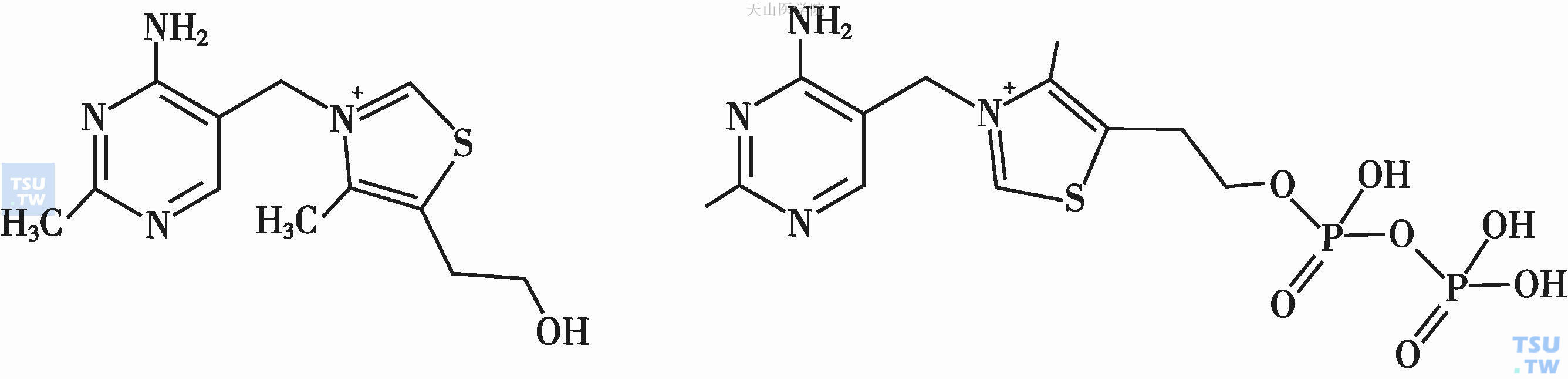
图3-5-1 维生素B1及焦磷酸硫胺素的结构
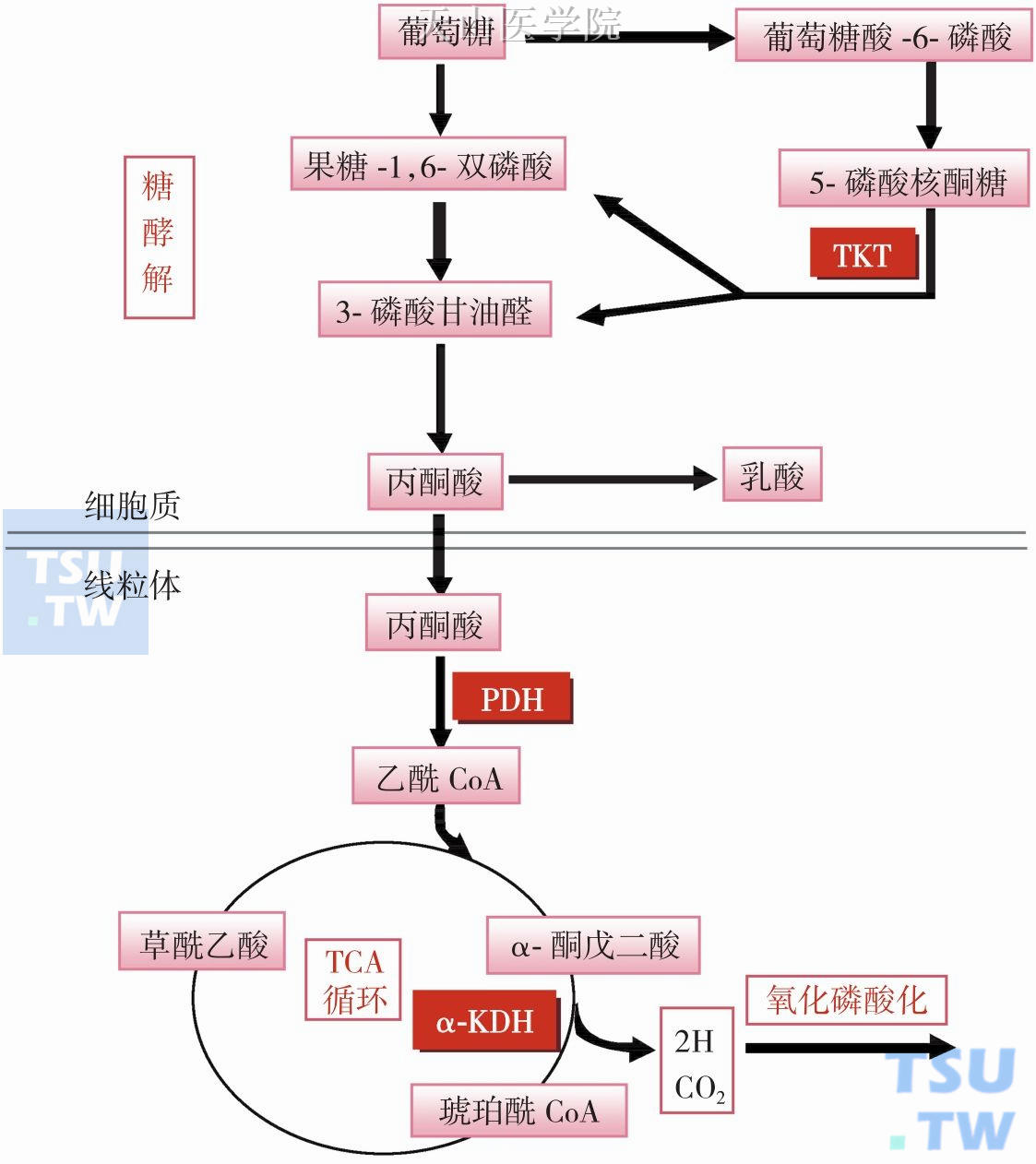
图3-5-2 焦磷酸硫胺素(TPP)与糖代谢关系
TKL,转酮醇酶;PDH,丙酮酸脱氢酶复合体;α-KDH,α-酮戊二酸脱氢
酶复合体
多种原因可引起维生素B1缺乏,如营养不良,过多摄入富含硫胺素分解酶的食物(生食淡水鱼和贝壳类,以及蕨类植物),或富含抗硫胺素因子(茶、咖啡和槟榔等),一些有并发症的糖尿病患者常伴有维生素B1缺乏。由于维生素B1的磷酸化衍生物及相关代谢酶对所有细胞生命活动都是必需的,因此维生素B1缺乏时,往往会影响到全身组织器官功能,其中神经系统和心肌对维生素B1缺乏尤其敏感,当维生素B1缺乏时会引起脚气病(Beriberi),因此又将维生素B1称为抗脚气病维生素。按其程度,依次可出现下列反应:神经系统反应(干性脚气病)、心血管系统反应(湿性脚气病)、Wernicke(韦尼克)脑病及Korsakoff综合征(多神经炎性精神病)。这是因为神经系统和心肌主要依赖氧化磷酸化获得能量。由于维生素B1缺乏导致TPP 合成不足,丙酮酸的氧化脱羧发生障碍,并伴有丙酮酸及乳酸等在神经组织中的堆积,可出现手足麻木、四肢无力等多发性周围神经炎的症状(干性脚气病);严重者引起心跳加快、心脏扩大和高输出量型心力衰竭,下肢水肿等症状(湿性脚气病)。Wernicke综合征是维生素B1缺乏的另一严重后果。此病的特殊体征是眼肌麻痹,眼球震颤和共济失调,服用维生素B1后,可迅速见效。Wernicke脑病常伴有Korsakoff精神病的体征,其特点是记忆力明显减退。不能获得新知识,以及健谈症,这些常是不可逆的。
此外,维生素B1参与神经递质——乙酰胆碱和γ-氨基丁酸(GABA)合成,同时维生素B1可抑制胆碱酯酶的活性。因此,缺乏维生素B1时,一方面减少乙酰胆碱合成,同时由于胆碱酯酶活性增强,乙酰胆碱水解加速,从而进一步减少了局部乙酰胆碱含量。因为支配胃肠运动的迷走神经是通过释放乙酰胆碱发挥作用的,这势必造成胃肠蠕动缓慢、消化液分泌减少、食欲缺乏和消化不良等症状。所以在临床上补充维生素B1,可增加食欲和促进消化。
维生素B1与肿瘤
维生素摄入量与肿瘤发生率
维生素摄入量与肿瘤发生关系存在矛盾的结果。2000年Boros LG认为摄入维生素B1增加与肿瘤高发生率有关。西方国家饮食结构和维生素保健品高消费导致维生素B1摄入远高于亚洲和非洲,肿瘤发生率是亚洲和非洲国家的8.5倍,其中乳腺癌、前列腺癌和结肠癌发生率是亚洲和非洲国家50~100倍,而非洲的冈比亚和尼日利亚等国家有季节性维生素B1缺乏,其乳腺癌、前列腺癌和结肠癌发生率处于世界最低。但早在1987年的一份营养问卷调查结果显示相反结论,即前列腺癌发生率与维生素B1摄入量呈负相关;同样2005年研究显示维生素B1摄入减少与Baker囊肿、骨肉瘤和颌下腺囊肿等发生相关,并且通过补充维生素B1可治愈这些肿瘤;还有的调查发现维生素B1摄入与乳腺癌、卵巢癌、子宫内膜癌、结直肠癌和肺癌的发生无相关性。这些不同结果表明维生素摄入量与肿瘤发生的关系还存在很多争议。这就要求进行更大规模营养素与肿瘤发生调查,需要更严格科学的设计方案,以及采用更客观和可靠维生素B1摄入量测定和计算方法等才能解决这些争议。
维生素B1对肿瘤生长的双重作用
低中剂量维生素B1促进肿瘤发生和生长TPP是糖代谢关键酶的辅助因子,细胞生存和增殖需要通过糖代谢来不断提供能量和碳源,尤其是磷酸戊糖通路中TKT催化生成磷酸核糖活性依赖TPP,而高度分裂增殖细胞需要大量合成磷酸核糖。因此,细胞生存和增殖,特别是肿瘤细胞需要维生素B1。研究证实低剂量到中等剂量维生素B1可促进肿瘤细胞生存和增殖。Comín-Anduix等在Ehrlich腹腔积液肿瘤模型上研究发现当维生素B1摄入量在推荐剂量的12.5~75倍时仍能促进肿瘤增生,并且发现TPP依赖酶的表达和活性是增加的。TPP依赖的TKT是快速增殖肿瘤细胞合成大量核苷酸前体的关键酶,在结肠癌、泌尿系统上皮肿瘤、乳腺癌、卵巢癌和胃癌等肿瘤中证实TKT是上调的。这些结果表明TPP激活TKT活性是肿瘤细胞增殖必要条件之一。
高剂量维生素B1抑制肿瘤生长Comín-Anduix等研究发现当维生素B1摄入量大于推荐剂量的75倍时肿瘤增殖停止,显示出抗增殖效应。最近在胰腺癌和神经母细胞瘤细胞系的研究进一步证实高剂量硫胺素可显著抑制肿瘤细胞增殖,同时促进肿瘤细胞凋亡。并且发现高剂量硫胺素的抑制作用类似于二氯乙酸(dichloroacetic acid,DCA),能显著降低PDH磷酸化水平,降低葡萄糖消耗、乳酸产生和线粒体跨膜电位。高剂量硫胺素和DCA两者都具有靶向肿瘤代谢表型而对正常细胞没有影响,但硫胺素的IC50显著小于DCA,更具有安全性和应用前景。因为达到抗肿瘤作用的DCA需要量达到mmol/L级,换算为成人用量达到25mg/ (kg•d),这个用量会导致患者神经系统毒性病变,包括线粒体肌病、脑病变和卒中样发作等,而硫胺素是人体功能的必需维生素,在抑制肿瘤生长的高剂量时几乎没有产生剂量限制性毒性反应。研究显示正常人给予1.5g/d硫胺素没有任何副作用,给予7.5g/d硫胺素时只出现轻微的消化不良症状。
维生素B1抗肿瘤作用的机制
高剂量硫胺素抗肿瘤作用的机制尚未完全阐明。目前认为高剂量硫胺素主要通过影响PDK和PDH活性,纠正肿瘤细胞的Warburg 效应而发挥抗癌作用的。早在20世纪30年代就发现肿瘤细胞在有氧条件下仍进行活跃地糖酵解,也就是Warburg 效应。其主要特征:氧化磷酸化下降和耗氧减少,葡萄糖摄取增加而葡萄糖产能效率降低,乳酸产生和释放增加。Warburg 效应的活跃程度随细胞类型不同而异,还与肿瘤的侵袭性生长密切相关。不同肿瘤发生Warburg 效应的机制不尽相同,往往涉及糖代谢相关酶和转运载体异常(突变、表达异常和同工酶改变等)。
PDH是糖酵解转向糖有氧氧化的关键酶,而PDH活性受磷酸化/去磷酸化调节,磷酸化的PDH活性下降而去磷酸化被激活,PDH磷酸化/去磷酸化修饰分别由丙酮酸脱氢酶激酶(PDK)/丙酮酸脱氢酶磷酸酶催化。研究发现肿瘤组织缺氧微环境条件下HIF-1α还可激活转录PDK1,PDK1磷酸化PDH而失活,从而抑制三羧酸循环和氧化磷酸化,致使细胞糖代谢由线粒体氧化磷酸化方式向糖酵解转变。因此,肿瘤细胞过表达PDK并通过磷酸化PDH是肿瘤细胞生存,特别是在缺氧条件下生存的主要机制之一。这提示靶向抑制PDK磷酸化PDH可能是一种抑制肿瘤生长的潜在策略。如DCA靶向抑制PDK1而激活PDH,促进乳酸转变为丙酮酸而进入线粒体氧化,DCA可有效抑制包括肺癌、乳腺癌、子宫内膜癌和结肠癌等恶性肿瘤生长。如果肿瘤细胞存在线粒体氧化磷酸化缺陷时DCA可增加线粒体产生ROS,其抗癌作用更为有效,而对正常细胞无影响。丙酮酸氧化脱羧产物(NADH和乙酰CoA)可反馈抑制PDH活性,并可促进PDK磷酸化修饰PDH;相反过多PDH的底物(丙酮酸、ADP)和辅助因子TPP可抑制PDH磷酸化修饰。研究发现补充硫胺素,特别是当摄入量超过推荐量的75倍时,显著增加TPP并产生类似于DCA的作用(图3-5-3),即恢复PDH活性和增加线粒体产生ROS,从而抑制肿瘤细胞增殖,促进肿瘤细胞凋亡。
硫胺素的非酶辅助因子作用:硫胺素还可能通过非酶辅助因子作用发挥抗肿瘤作用,游离型硫胺素具有直接抗氧化特性和参与合成谷胱甘肽等,研究揭示抗氧化剂处理肿瘤细胞可以通过降低ROS或氧化应激而抵抗细胞增殖。此外,高剂量硫胺素还会直接影响细胞内参与硫胺素代谢平衡的相关基因表达,影响硫胺素和TPP,以及硫胺素磷酸化衍生物之间比例和水平,从而发挥抗肿瘤的作用,但其机制尚不清楚。
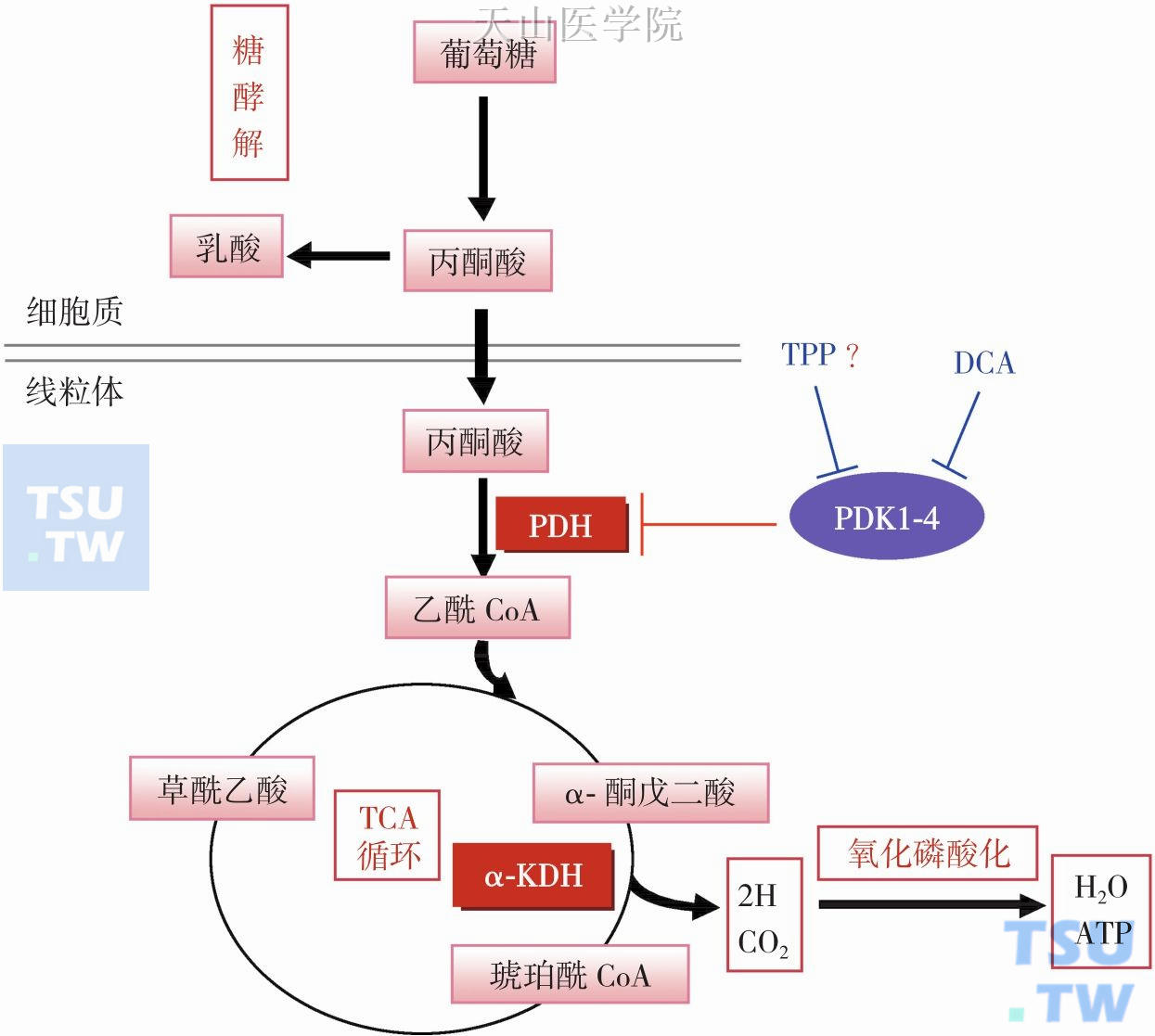
图3-5-3 TPP类似DCA抑制PDK活性而促进丙酮酸有氧氧化分解
高剂量硫胺素抗肿瘤效应又一个老药新作用的例子,这提示我们对于曾经以为功能明确的维生素家族成员需予以高度重视和再认识,并开展相关功能、作用机制和临床应用等研究。同时,由于硫胺素对肿瘤生长的双重作用,肿瘤患者补充维生素B1时,慎用低中剂量而建议用大于75倍的推荐膳食供给量(recommended dietary allowance,RDA)可能会更好。
