Warburg效应提出时就将肿瘤细胞糖酵解代谢活跃的原因归结于肿瘤线粒体呼吸功能的损伤。认为肿瘤细胞的氧化磷酸化功能发生了不可逆性的损伤,迫使细胞在有氧情况下也利用糖酵解生成ATP。研究发现肿瘤细胞线粒体在结构形态、功能,包括线粒体在能量代谢、mtDNA 等方面发生改变。任何降低线粒体氧化磷酸化的事件均可促进氧化组织中发生转化的细胞或肿瘤细胞的增殖,呼吸链复合体大量减少与肿瘤细胞快速增长和侵袭性增加密切相关。
肿瘤细胞线粒体结构与形态改变
由于恶性肿瘤细胞能量供给主要来源于糖的无氧酵解,而不是糖的有氧氧化,因此在代谢十分活跃、生长迅速的恶性肿瘤中,常发现肿瘤细胞所含线粒体数目、大小及形状等存在差异。恶性肿瘤线粒体较周围正常细胞线粒体的数目变少,形状不一,更容易发生变性改变,包括线粒体多形性如呈C形、环形、有的呈长杆状,肿胀,增生,内室水肿,峭内间隙水肿,基质致密,亦可表现为线粒体固缩;有的线粒体峭可以与线粒体的长轴平行,而不像正常时垂直排列,且异常线粒体与正常线粒体常常共存。目前已在结肠癌、肾癌、乳腺癌、胰腺癌、儿童及成年胚胎性癌肉瘤(肾)、胃癌、白血病、甲状腺癌、腭淋巴瘤、颊黏膜嗜酸性细胞癌等多种肿瘤组织发现线粒体形态的异常,除上述的一些改变外,还有线粒体外膜皱曲、嵴结构破坏、线粒体向核周的转移以及空泡变等。其中,线粒体肿胀、嵴形状的不规则及断裂是最常见的超微结构改变。出现异常线粒体的细胞,呼吸功能严重缺陷,葡萄糖摄取和乳酸累积现象更为活跃。肿瘤组织中mtDNA的不稳定性和频繁发生突变是导致线粒体形态学发生改变的原因之一。Rhoo细胞是一类mtDNA 缺失、无线粒体功能、依靠糖酵解存活的细胞系。因为不含mtDNA,其线粒体没有功能,线粒体的结构与正常线粒体表现出明显不同,线粒体嵴膜严重减少并紊乱。另外,线粒体是高度动态变化的细胞器,在细胞的不同生命过程中以及外界环境刺激下,在细胞内不断运动、融合、分裂以保持一定的形态,其数量和形态都是可变的,因此,融合和分裂过程也可能导致线粒体形态学发生改变。肿瘤组织中,线粒体融合和分裂间的平衡被打破,线粒体分裂占据优势。
2. 肿瘤细胞线粒体呼吸功能变化型的肿瘤组织中鉴定出线粒体中氧
已在多种类化磷酸化多肽链的编码基因突变或表达量异常,并且在其转录调控区域突变率更高,因此可能导致其转录失调、合成功能低下或无功能的呼吸链复合体组分,使肿瘤氧化磷酸化水平降低。在肝癌、肾癌、结肠癌、乳腺癌、胃腺癌、食管鳞状上皮癌和肺癌等多种肿瘤组织内,线粒体内膜ATP酶复合体β亚基表达量显著下降;在嗜酸性粒细胞腺瘤组织内,线粒体呼吸酶复合体Ⅰ表达量降低且功能下降;线粒体ATP合酶催化亚单位(b-F1-ATPase)的表达水平与Warburg效应程度成反比,在大多数肿瘤中表达下降;研究还发现,寡霉素在抑制肺癌细胞氧化磷酸化的同时,快速增加需氧糖酵解,提示肿瘤细胞可由于线粒体氧化磷酸化过程受到抑制转而依赖糖酵解,而当糖酵解过程受到抑制的时候,肿瘤细胞不能有效上调氧化磷酸化功能。这些研究结果初步证实,线粒体氧化磷酸化功能部分受损是导致Warburg效应的原因之一。然而,需要指出的是,Warburg效应不仅存在于肿瘤细胞,也存在于多种快速生长的正常细胞中,一些研究也证实肿瘤细胞中线粒体的功能并不降低。说明除氧化磷酸化功能受损外,肿瘤细胞中一定还存在其他上调糖酵解的机制。
肿瘤线粒体能量代谢异常的机制
肿瘤细胞线粒体DNA异常
在20世纪70年代以前,有关线粒体与肿瘤关系的研究主要集中在肿瘤细胞线粒体的形态和能量代谢等方面。自1981 年完成人类mtDNA 全序列的测定以后,mtDNA与肿瘤关系的研究受到人们的普遍关注。近年来的大量研究表明,mtDNA 突变、拷贝数的变化以及基因表达水平的变化等与肿瘤的形成与发展存在密切联系,有望成为恶性肿瘤早期诊断和预后的标志物。
肿瘤形成与mtDNA 损伤有关。由于mtDNA的易损伤性和突变的遗传特点等因素,决定了线粒体高突变率的特点。加之mtDNA 相邻基因间极少有非编码基因,mtDNA的突变率高于nDNA,如mtDNA 突变发生比p53 基因突变的发生高200倍以上。Fliss等发现64%的皮肤癌患者、46%的头颈肿瘤患者及43%的肺癌患者的体液样本细胞mtDNA 突变。目前,已在大量肿瘤包括膀胱癌、乳腺癌、卵巢癌、肝癌、食管癌、胃癌、结肠癌、胰腺癌、肾癌、前列腺癌、甲状腺癌和造血系统肿瘤等组织中检测到mtDNA 突变。但受检测方法及样本差异性等因素的影响,即使针对同一种肿瘤的mtDNA 突变情况,各种报道之间也往往存在一定差距,甚至有一些互相矛盾。对于肿瘤中mtDNA突变的发生频率及种类等问题仍无定论,需进一步研究阐述。
mtDNA任何位置均有可能发生突变,但其中D-环是突变发生最为频繁的区域。D-环区有复制起点和转录启动子,具有高度多态性,重链(H链)合成时形成的特异三链结构及与内膜直接接触,使它对ROS十分敏感,D-环区的突变可能会改变该区域与mtDNA 复制相关的反式作用因子的亲和力,从而影响mtDNA的复制,引起mtDNA 拷贝数改变,也可能改变线粒体的转录和蛋白质生成,影响线粒体氧化磷酸化功能,而氧化磷酸化障碍又导致 ROS 产生增加,而 ROS 的增加又加剧了mtDNA突变,进一步增加 ROS 产生,最终影响线粒体氧化磷酸化系统,从而造成线粒体内持续的氧化应激环境,促使癌症的发生。
mtDNA易发生突变机制许多因素包括物理因素、化学因素、药物、生理或病理等可引起mtDNA损伤,造成线粒体功能损伤、细胞凋亡和肿瘤发生。与nDNA相比,mtDNA 之所以成为突变易发生的热点区域,与其自身结构特点及所处的生物学环境密切相关,各种可能的影响因素包括:①mtDNA 分子量小,裸露于线粒体基质中,缺乏组蛋白的保护。②复制保真度较低,负责mtDNA 复制的DNA 聚合酶γ校对能力差,而tRNA 基因部位易形成发夹样结构,从而使其复制错误频率明显高于nDNA。③亲脂性致癌物优先聚集于mtDNA 上。mtDNA与富含脂质的线粒体内膜相连,mtDNA 对脂溶性致癌物的结合率比nDNA高。用14C 标记的多种化学致癌剂处理培养细胞或体内注射一定时间后,分离靶细胞的mtDNA 和nDNA,检测标记致癌剂与它们的结合量。结果显示,烷化类致癌剂与mtDNA 的结合率是nDNA的5 倍;苯并芘是40~90倍;多环香烃是50~500 倍;黄曲霉素B1是3~4 倍,而且这些结合不易消除。④mtDNA 在整个细胞周期中都处于不断合成状态,易受外界干扰,且受损伤后线粒体中缺乏有效的DNA 损伤修复机制,稳定性差。⑤mtDNA 中除了一小段D-环区域外,其他序列无内含子,序列微小的改变可涉及其基因组内的重要结构基因的变化,导致线粒体功能障碍。⑥mtDNA 存在于线粒体基质内或依附于线粒体内膜,并因此与电子传递系统相接近,mtDNA 暴露于呼吸链产生的高水平ROS 及其他自由基包围之中,易受氧化损伤;在可能导致mtDNA 突变的有害因子中,ROS 的影响受到人们的普遍关注。分析癌基因ras 介导的细胞致瘤性转化的分子机制时发现,转染ras 的卵巢上皮细胞,线粒体抗氧化能力增强,细胞得以在高ROS 的条件下继续生长并失控,继而发生恶性转化。肿瘤细胞中mtDNA 发生突变与肿瘤细胞内有高水平的超氧化物和氢过氧化物相吻合,这可能是由于各种原因引起mtDNA突变后可致编码基因异常,进而导致呼吸链异常并使ROS 增加,ROS 又可导致新的突变发生。不论哪种情况先发生,都将形成恶性循环,产生一个持续的高氧环境,有助于肿瘤的发生发展。抗氧化剂可减少细胞恶性变的发生。肿瘤治疗的策略之一是增加胞内氧自由基的生成,从而使其对肿瘤细胞发挥杀伤性作用。
mtDNA 拷贝数异常
肿瘤中mtDNA 不但有局部的突变,而且还发生数量的改变。不同分期头颈肿瘤患者的肿瘤组织中,mtDNA 拷贝数随组织学分级程度而增加。如发现部分肿瘤组织如肝癌、肾癌、结肠癌、乳腺癌、胃腺癌、食管鳞状上皮癌和肺癌线粒体内ATP 酶复合体β亚基表达缺陷,而mtDNA 拷贝数的增加对呼吸链功能下降可能起到代偿作用,有可能成为另一个诊断和判定肿瘤分期的标志物。Yu等发现mtDNA 拷贝数的降低可能参与乳腺癌细胞的转化或进展。Yin 等报道了肝癌组织中mtDNA 拷贝数目较正常肝组织中明显减少,而且男女患者mtDNA 突变有显著差异,这种差异和临床表现相关。在白血病患者的白细胞mtDNA 的拷贝数有不同程度的增加。肿瘤细胞mtDNA 数目增加可能与mtDNA 复制失控有关。恶性胶质瘤中最常被检测到的异常就包括了mtDNA 拷贝数的变化。一项对45 例神经胶质瘤样本的研究发现,mtDNA 的数量在87%的样本中被高度放大,而另一个经常在人类肿瘤中用来作为参照核编码的基因拷贝数只在18%的样本中升高,提示在恶性胶质瘤中mtDNA 的改变比核编码的基因更为频繁。对15 个肿瘤切片的单独检测证实了mtDNA 拷贝数变化的高发生率,并且还检测到了mtDNA 向核内的转移,这种转移与mtDNA 拷贝数的增多相关。mtDNA 向nDNA的转移代表着一种原癌基因激活的机制。另一项对星型细胞肿瘤的研究提示,位于肿瘤样本中一个位于D-环区的曾被很好的阐述的多态性位点的异质性丢失,而存在于正常的脑组织中。从上面的结果可以看出,不同部位的实体瘤中mtDNA 的突变和不稳定性很不一致,整体分析它们的关系还不成熟。mtDNA 在线粒体间、细胞内及细胞间的调控机制、它们的遗传背景和环境、mtDNA 突变与肿瘤发生和发展的关系等,均需继续进行深入的研究。
mtDNA表达异常
肿瘤细胞mtDNA 除了易发生突变之外,其基因转录水平也常发生改变。很多研究发现肿瘤细胞中线粒体基因的表达总体上是上调的,而转录水平增高时可使细胞凋亡降低,可能与其致癌有关。Sharp 等发现在恶性乳腺癌组织中复合物Ⅳ的细胞色素氧化酶(COX)ⅡmRNA 的转录水平有显著升高,并且COXⅡ表达越高则恶性肿瘤的分化程度就越低。另外,在许多实体性癌中发现编码呼吸链复合体的mtDNA基因表达增加,这也可能是对肿瘤细胞能量需求增多的一种适应反应。一项对15 名结肠癌患者进行的研究发现,NADH脱氢酶亚基2(ND2)的mRNA 水平在恶性肿瘤组织中升高。早期胃癌组织部分线粒体基因的表达与正常组织存在明显差异,部分线粒体编码基因的表达水平显著上升。乳头状甲状腺癌组织中NADH 脱氢酶、ATP 合酶6(ATPase 6)、细胞色素b(Cyt b)及COX Ⅰ和Ⅲ编码基因的表达水平上调,同时核编码的线粒体转录因子A(mtTFA)的表达水平无明显变化。Lu 等发现人结肠癌细胞系HT29细胞mtDNA 中的ND4、ND4L、Cyt b、COXⅡ、ATPase 6 和8 以及16S rRNA 的转录水平均高于正常细胞,而且ND4、ND4L 的mRNA 水平与细胞的分化可能有关,对结肠癌预后有判定作用。在结肠癌患者的原发性肿瘤组织和有恶化前家族性多发性结肠息肉(familial polyposis coli,FPC)综合征的患者体内,存在线粒体编码的呼吸链亚单位表达的改变。但在乳腺癌组织中,ND2、ND4、ATPase6 的表达并未发生变化,仅COXⅡ表达增加。线粒体氧化呼吸链编码基因表达的升高,既反映线粒体对肿瘤细胞高能量需求的代偿,同时也可能通过抑制肿瘤细胞凋亡等途径间接诱导肿瘤的发生。尽管基因表达总体水平上升,肿瘤细胞的氧化磷酸化功能却表现出障碍,提示肿瘤组织中线粒体基因表达产物的功能可能存在缺陷,或表达的氧化磷酸化复合物各种亚基比例失调。肿瘤组织mtDNA转录水平上调还常伴有mtDNA 突变,推测这种上调也可能是mtDNA 对“mtDNA 性氧化磷酸化功能损伤”的代偿。同时,mtDNA 突变导致的ROS增多可能参与某些nDNA的激活,激活的nDNA又通过调控线粒体的基因表达,在肿瘤的发生、发展过程中发挥作用。关于肿瘤与线粒体基因表达、mtDNA 拷贝数及mtDNA突变间的关系,还有待于进一步研究。
核基因突变的影响
由于线粒体呼吸链复合体各组分是由细胞nDNA与mtDNA 共同编码,其中任何一个环节出现问题都可能导致呼吸功能的异常。在多种癌组织中,发现了编码线粒体氧化磷酸化(oxidative phosphorylation,OXPHOS)复合物亚基的nDNA有突变,nDNA对线粒体结构和功能的调节有异常。如:在遗传性嗜铬细胞瘤、结直肠癌等肿瘤中,编码线粒体OXPHOS的细胞色素b的小亚基(cybS)和琥珀酸脱氢酶D(SDHD)的基因有突变;nDNA的突变影响了线粒体呼吸链组分如琥珀酸脱氢酶的活性,导致代谢中间产物的堆积,从而抑制HIF-1α脯氨酰羟化酶,通过这一途径造成了异常的糖酵解表型。
线粒体DNA与核基因相互作用
正常情况下,mtDNA 的复制和转录都受到nDNA的指导和调控,因为线粒体的DNA和RNA合成的聚合酶都是由细胞nDNA编码的,因此mtDNA遗传系统只有依靠nDNA所合成的大量多肽类物质的协调才能发挥作用。mtDNA受损伤后,可能在细胞质内产生游离的mtDNA 或mtDNA片段,如果产生过多且伴mtDNA的降解失调,则游离的mtDNA 或mtDNA片段有可能穿过核孔,随机整合到核基因组中,起到类似致瘤病毒的作用。乳腺癌细胞mtDNA的缺失可以导致氧化应激,加重了脂质过氧化作用;以乳腺癌细胞系(Rhoo细胞)和由其获得的Rhoo细胞(无mtDNA的细胞) 对比,分析二者在nDNA表达谱方面的差异,发现在Rhoo细胞中一些涉及细胞能量代谢、细胞结构、信号转导、细胞生长、分化和凋亡的nDNA的表达发生了改变,这些基因可能与调节细胞核和线粒体之间的相互作用有关。此外,由于丧失了mtDNA,乳腺癌Rhoo细胞失去了锚着依赖性,转入正常线粒体后则锚着依赖性又恢复;Rhoo细胞注射入裸鼠后,不再成瘤,而转入正常人成纤维细胞的线粒体后则恢复。而另一研究发现,将缺失mtDNA 的人宫颈癌、卵巢癌细胞系和骨肉瘤细胞注射入裸鼠后腿肌肉中可形成肿瘤,而注射入皮下的瘤细胞无成瘤能力或成瘤能力很弱。这些实验结果表明,mtDNA 参与肿瘤发生,但具有环境依赖性,即其可能与某些nDNA的表达有关,这些nDNA与mtDNA 相互作用而导致肿瘤发生。一般来讲,肿瘤组织线粒体基因转录水平常常上调,并且还常伴有 mtDNA 突变。因为 mtDNA 突变导致的ROS 增多可能参与某些nDNA的激活,激活的nDNA又通过调控线粒体的基因表达,在肿瘤的发生、发展过程中发挥作用。
缺氧诱导因子抑制线粒体活性
缺氧诱导因子(hypoxia induced factor,HIF)抑制线粒体活性:肿瘤的最主要的特征是肿瘤细胞的失控生长,不断增多的细胞数将导致耗氧量的增加,造成肿瘤内缺氧微环境的形成,这在人实体瘤中表现的尤其明显。在快速生长的肿瘤细胞中,供氧量不能满足线粒体产生ATP的需求,肿瘤细胞继而通过上调糖酵解,补偿氧化磷酸化产能的不足,逃避缺氧导致的死亡。HIF-1是在缺氧条件下存在于哺乳动物和人体内一种转录因子,它最先在缺氧诱导的细胞核抽提物中发现。它广泛存在于人和动物的多种肿瘤细胞中,可调控一系列靶基因。HIF-1是由HIF-1α和HIF-1β亚单位组成的异源二聚体,两个亚单位均含有碱性螺旋-环-螺旋(bHLH)结构。通常情况下,在氧浓度正常时,HIF-1α在细胞内表达量维持在较低水平,易于泛素化(ubiquitination)而被蛋白酶水解;当细胞氧浓度降低时,HIF-1α的转录、翻译水平则呈指数增加,故为氧敏感亚基。HIF-1β是组成性表达亚基,在常氧和缺氧状态下均可表达,它与HIF-1α结合成二聚体形成有活性的HIF-1,抵抗蛋白水解酶的降解。
HIF-1α是肿瘤细胞适应低氧状态的关键调控分子,可促进葡萄糖摄入和糖酵解等相关基因的表达,参与糖酵解关键步骤激活。近期研究表明,HIF-1α还可通过转录活化丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinase-1,PDK1)来抑制线粒体有氧呼吸。PDK1可以使丙酮酸脱氢酶(PDH)磷酸化失活,从而减少丙酮酸生成乙酰辅酶A和进入三羧酸循环,减少进入电子传递链的NADH 和FADH2的量,使细胞糖代谢由线粒体内的氧化磷酸化方式转向糖酵解(图3-1-9)。缺氧环境可诱导HIF-1α的表达,继而上调肿瘤细胞糖酵解途径。三羧酸循环累积的底物也可诱导HIF-1α的表达。如琥珀酸盐在胞浆中的累积可抑制HIF-1α脯氨酸羟化酶,导致HIF-1α的稳定和激活。乳酸盐和丙酮酸盐也有类似的调节机制。因此,许多研究者认为,HIF-1是肿瘤细胞糖酵解增强的原因之一。然而,一般认为HIF-1仅在低氧情况下才稳定、才有功能,而Warburg效应是在正常氧情况下,糖酵解水平出现了增高,因此对肿瘤细胞而言,在有氧情况下HIF-1很可能出现了异常的活化状态。某些肿瘤在充氧环境下,也观察到高水平的HIF-1α表达,提示除了低氧,其他的因素如激素、生长因子和一些代谢物堆积(延胡索酸、琥珀酸和2-羟戊二酸)等也可诱导HIF-1的表达和稳定性提高。
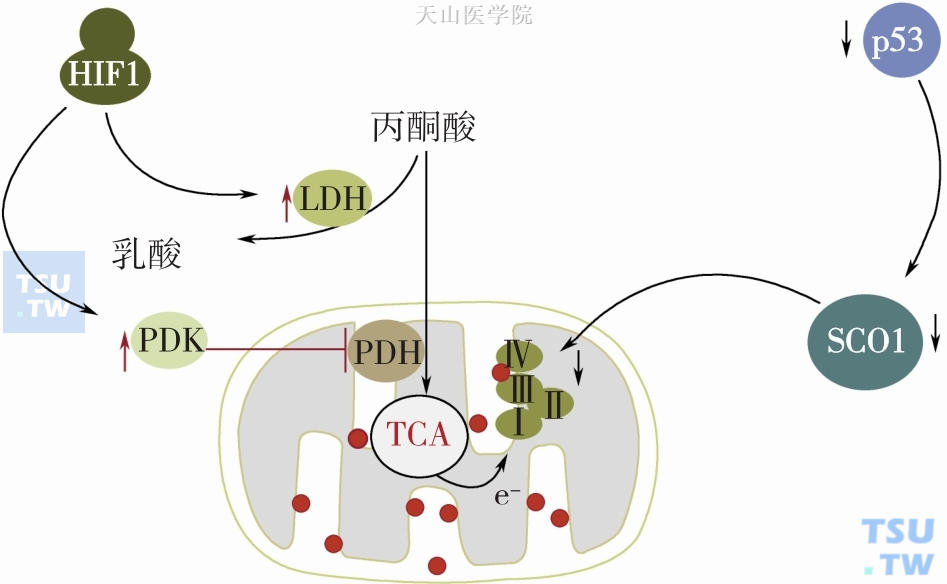
图3-1-9 HIF-1和P53对线粒体氧化磷酸的调节
抑癌基因p53突变
p53基因是人体抑癌基因,该基因编码一种分子量为53kDa的蛋白质,命名为P53。它是细胞生长周期中的负调节因子,它是与细胞周期的调控、DNA 修复、细胞分化、细胞凋亡等重要的生物学特性密切相关的一个中枢性调节分子,一直深受细胞生物学家和肿瘤生物学家的关注。p53基因的失活对肿瘤形成起重要作用。p53不仅参与细胞的增殖与凋亡的调控,也参与线粒体呼吸调节。迄今的研究发现,在50%以上的肿瘤中存在p53基因的异常(包括点突变、等位基因缺失、重排、插入、基因融合等)。因此,p53基因与肿瘤的发生、发展以及临床疗效均有密切关系。近年来研究发现P53在保持线粒体完整性、氧化磷酸化和下调糖酵解等方面发挥着重要作用。在细胞和小鼠模型中都证实P53缺失可以导致线粒体氧化磷酸化缺陷和糖酵解加强。研究证实P53可通过调节多个靶基因表达来维持线粒体氧化磷酸化功能。这些靶基因包括合成细胞色素C氧化酶(synthesis of Cytochrome c Oxidase,SCO)2、PDK2、凋亡诱导因子(apoptosis-inducing factor,AIF)、谷氨酰胺酶2 (glutaminase 2,GLS2)、帕金森病相关基因Parkin和核糖核苷酸还原酶亚基p53R2等。SCO2是参与线粒体细胞色素C氧化酶复合物组装的重要调节蛋白,P53通过诱导SCO2表达,保障线粒体呼吸链复合物稳定而增强线粒体氧化磷酸化。研究发现p53 缺失HCT116细胞中SCO2水平下降9倍,线粒体耗氧量明显降低。如果在p53缺失结肠癌细胞(HCT116)和p53突变结肠癌细胞(DLD1和SW480)中表达野生型的SCO2,线粒体的耗氧量增加到 p53(+/+)细胞水平。这表明p53通过调节SCO2 参与有氧呼吸的调节。AIF对于线粒体呼吸链复合物I完整性是必需的,P53通过转录激活AIF促进线粒体氧化磷酸化。Parkin除了可以抑制糖酵解外,还可促进P53增强线粒体氧化磷酸化。研究表明Parkin发挥潜在抑癌基因作用,多种肿瘤中发现Parkin的缺失或突变,导致线粒体氧化磷酸化下降。进一步研究证实Parkin 可增加丙酮酸脱氢酶复合物的关键组分丙酮酸脱氢酶E1α1(pyruvate dehydrogenase E1α1,PDHA1)表达,从而促进丙酮酸氧化生成乙酰CoA和三羧酸循环。Parkin缺陷降低了PDHA1水平,导致丙酮酸氧化和氧化磷酸化下降和糖酵解增强。P53除了通过Parkin激活PDH外,还可通过抑制PDK2表达而激活PDH活性,从而促进氧化磷酸化。其他,P53通过上调核糖核苷酸还原酶亚基p53R2以保持线粒体DNA(mtDNA)完整性和线粒体功能,P53还可以直接与mtDNA 聚合酶γ相互作用来维持mtDNA完整性和线粒体氧化磷酸化功能。总之,P53通过上述机制维持线粒体完整性和氧化磷酸化,而各种肿瘤P53缺失或突变必然导致线粒体氧化磷酸化缺陷,从而导致糖酵解增强。
Myc激活促进线粒体代谢
重编程谷氨酰胺通过胞膜和线粒体膜上专一性转运载体进入线粒体三羧酸循环途径进行代谢,并且可以经三羧酸循环中间物转变为其他代谢物后再出线粒体,参与重要的合成代谢。肿瘤细胞谷氨酰胺酶活性显著高于非转化的对照细胞。离体肿瘤细胞培养研究表明肿瘤细胞消耗的谷氨酰胺量是其他氨基酸的10倍;谷氨酰胺分解和缺陷的TCA循环会导致低水平的乙酰CoA脱离TCA循环进入胞质脂肪酸从头合成途径。同时谷氨酰胺分解途径中的苹果酸酶催化反应产生的NADPH+H+是脂肪酸从头合成和谷胱甘肽再循环的重要辅助分子。同糖酵解一样,谷氨酰胺分解是一个双功能途径,即提供能量和合成途径的前体分子。因此,谷氨酰胺是促进细胞增殖和细胞转化的必需分子。Myc过表达通过抑制microRNA-23a/b表达,而促进线粒体谷氨酰胺酶表达增加,从而增加谷氨酰胺分解,还可诱导谷氨酰胺转运载体ASCT2和SN2表达。因此,Myc对于肿瘤细胞线粒体摄取和代谢谷氨酰胺发挥了重要作用。
(缪明永)
