肿瘤细胞内蛋白质/氨基酸代谢与宿主相反,蛋白质合成增强,同时氨基酸摄取和代谢增加,主要包括谷氨酰胺、BCAA、蛋氨酸和精氨酸等。
肿瘤细胞摄取和代谢谷氨酰胺增强:许多研究表明葡萄糖和谷氨酰胺是肿瘤细胞和正常增殖细胞消耗的两个主要底物,它们的消耗速率常超过能量和生物合成的需求。肿瘤细胞为了满足细胞不断增殖所需要的能量和合成代谢,常常要不断消耗大量葡萄糖,并大大增强糖酵解,糖酵解中间代谢物大量用于合成代谢,而减少了进入TCA循环的乙酰CoA。为了补偿这种代谢改变保证正常TCA循环和能量供给,在许多肿瘤细胞中谷氨酰胺摄取分解代谢显著增强。离体肿瘤细胞培养研究表明肿瘤细胞摄取谷氨酰胺的量是其他氨基酸的10倍。同时发现细胞增殖并不一定与高葡萄糖消耗率关联,事实上多种细胞系在低葡萄糖水平时也能进行增殖。如Novikoff鼠肝肿瘤细胞在50µmol/ L葡萄糖水平培养时,6-磷酸葡萄糖主要用于合成大分子而不产生乳酸,当葡萄糖碳主要用于合成细胞建构分子时需要其他能量来源。在增殖细胞尤其是肿瘤细胞中,其能量来源就是谷氨酰胺,如MDA-MB-453细胞在0.5mmol/L葡萄糖介质中培养时其谷氨酰胺消耗量是5mmol/L葡萄糖介质中培养时的8倍,在HeLa细胞的培养介质中用果糖或半乳糖置换葡萄糖后,由谷氨酰胺分解产生ATP占细胞能量的99.9%,同样在葡萄糖饥饿的胎肺成纤维细胞MRC5和肺癌细胞HLF-a中,ATP主要来自于寡霉素敏感的氧化磷酸化。谷氨酰胺分解首先需要磷酸依赖的谷氨酰胺酶(催化谷氨酰胺分解为谷氨酸)高表达,谷氨酰胺合成酶(催化谷氨酸合成谷氨酰胺)失活,和NAD(P)+依赖的苹果酸脱羧酶(也称苹果酸酶,在细胞质中催化苹果酸脱羧生成丙酮酸)高表达。在肿瘤细胞中谷氨酰胺分解途径涉及的TCA循环,由于肿瘤细胞线粒体Mn-SOD和胞质CuZn-SOD明显下降导致自由基升高而抑制含Fe2+顺乌头酸酶的活性,从而阻碍TCA循环。因此,过表达Mn-SOD显示增强顺乌头酸酶活性和抑制许多肿瘤细胞增殖。谷氨酰胺分解和TCA循环障碍,使更多的乙酰CoA脱离TCA循环进入胞质参与脂肪酸从头合成(图3-4-6)。如异种移植人乳腺癌动物模型显示释放出软脂酸、软油酸、硬脂酸、油酸、亚油酸、γ-亚麻酸和花生四烯酸增加。除了乳酸外,脂肪酸释出是消除过剩氢的有效途径,而且脂肪酸是免疫抑制剂,可保护肿瘤细胞免受免疫攻击。谷氨酰胺本身,以及谷氨酸和天冬氨酸都是核酸合成重要前体分子,同时谷氨酰胺分解途径中的苹果酸酶催化反应产生的NADPH+H+是脂肪酸从头合成和谷胱甘肽再循环的重要辅助分子(图3-4-6)。同糖酵解一样,谷氨酰胺分解是一个双功能途径,即提供能量和合成途径的前体分子。因此,谷氨酰胺是促进细胞增殖和细胞转化的必需分子。谷氨酰胺是血浆中最丰富的氨基酸,研究发现降低细胞外谷氨酰胺水平与U937和骨髓单核细胞表型和功能分化密切相关。Wang等发现在高度恶性乳腺癌细胞系MDA-MB231中谷氨酰胺酶显著高表达。然而谷氨酰胺酶高表达并不能完全解释其在肿瘤细胞内活性,因为谷氨酰胺酶基础活性(没有变构激活剂磷酸存在时活性)是很低,而在转化的成纤维细胞和其他转化的细胞中,在没有明显表达改变时,谷氨酰胺酶活性显著高于非转化的对照细胞,如Dbl转化的NIH-3T3 细胞的谷氨酰胺酶基础活性是非转化成纤维细胞的5~10倍,在人乳腺癌细胞SKBR3也发现类似结果。
谷氨酰胺会影响肿瘤细胞生物学行为。有研究发现人结肠癌细胞补充谷氨酰胺可促进细胞增殖和抑制细胞与固体培养基的黏附,这提示谷氨酰胺会增加细胞侵袭和转移能力。因此认为结肠癌患者补充谷氨酰胺可能会恶化病情。另一方面,肿瘤细胞的谷氨酰胺代谢可能在肿瘤治疗上有某种选择性优势。如细胞因子TNF-α杀死肿瘤细胞的机制大多是由于TNF-α信号通路促进线粒体产生更多的ROS所致。有研究发现当L929细胞培养基中用谷氨酰胺代替葡萄糖作为能量底物时,L929细胞对TNF-α引起的细胞毒反应更加敏感,也就是说,肿瘤细胞以谷氨酰胺氧化分解作为主要能量代谢状况增加了TNF-α介导的细胞毒反应时线粒体产生ROS。
肿瘤细胞中谷氨酰胺与葡萄糖之间相互协调在肿瘤细胞或正常细胞生长的过程中,都需要利用到葡萄糖及谷氨酰胺,长久以来,大家都认为这两种细胞生长的必要成分毫不相关,但是实际上两者是相互依赖的,研究发现当限制了谷氨酰胺利用时,葡萄糖利用也被停止。也就是细胞没有了谷氨酰胺,也就丧失了葡萄糖,于是肿瘤细胞的生长也就停止了。其机制涉及转录因子Mondo A、Mix和硫氧还蛋白相互作用蛋白(TXNIP)。Mondo A和Mix属于碱性螺旋-环-螺旋亮氨酸拉链(bHLHZIP)转录因子家属成员,这个家属在控制细胞生长、分化和死亡中发挥重要作用。Mondo A与Mix形成复合物形式发挥转录作用,并且定位于线粒体外膜上和在线粒体与细胞核之间穿梭,在核内聚集主要受葡萄糖和6-磷酸葡萄糖水平影响。Mondo A-Mix复合物可调节75%葡萄糖依赖的转录功能,通过介导由葡萄糖激活的TXNIP可抑制葡萄糖摄入。TXNIP有多方面的作用:可以与氧还蛋白结合和抑制氧还蛋白作用,通过稳定周期蛋白抑制因子P27抑制细胞增殖,作为Mondo A-Mix复合物效应分子,可以限制葡萄糖摄入而负调细胞生长。Kaadigea等发现谷氨酰胺通过激活招募组蛋白依赖的辅助激活因子到Mondo A的氨基端抑制TXNIP转录表达。因此,当同时存在葡萄糖和谷氨酰胺时,TXNIP水平下降,而这有利于肿瘤细胞摄入葡萄糖和有氧酵解;同时发现下调Mondo A而降低TXNIP,促进葡萄糖摄入和细胞增殖,Mondo A-Mix复合物转录激活TXNIP时需要组蛋白乙酰转移酶(histone acetyltransferase,HAT)。另外,一个可透过细胞膜的TCA循环中间物α-酮戊二酸的类似物通过TXNIP基因启动子抑制Mondo A转录活性,促进葡萄糖摄入。这些结果表明谷氨酰胺依赖的线粒体补充代谢通过阻断Mondo A-Mix复合物依赖的TXNIP基因转录激活来决定葡萄糖摄取和有氧糖酵解的,而谷氨酰胺通过线粒体补充代谢将MondoA-Mix复合物转录激活因子转换为转录抑制因子,而且需要将组蛋白去乙酰酶依赖的辅助抑制因子招募到与已与启动子结合的Mondo A-Mix复合物(图3-4-9)。谷氨酰胺依赖的Mondo A转录抑制作用并不限于TXNIP,还可作用于另一个葡萄糖激活的和Mondo A依赖的靶基因ARRDC4,ARRDC4是TXNIP同源分子,也可抑制细胞生长。总之,Kaadigea等认为谷氨酰胺与葡萄糖之间协调利用决定了代谢关卡,而这关卡在这些营养素低于最低需要水平时能阻滞细胞生长。
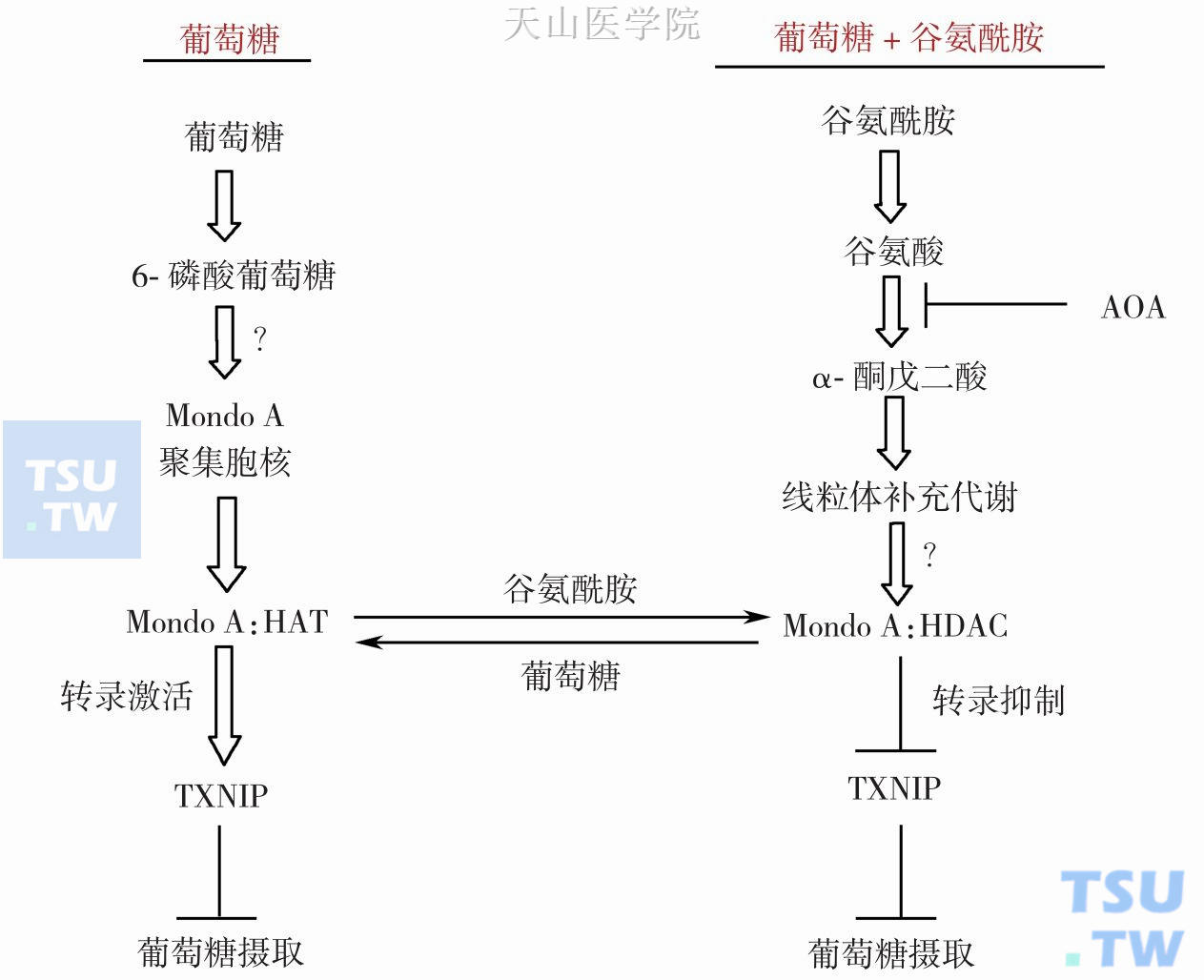
图3-4-9 谷氨酰胺通过Mondo A转录活性调节葡萄糖摄入
注:HAT:组蛋白乙酰转移酶,HDAC:组蛋白脱乙酰化酶,Mondo A:一种转录因子,AOA:氨基氧乙酸
谷氨酰胺代谢异常机制:Rho GTPase-信号通路与谷氨酰胺分解。Rho GTPase家族(CDC42、Rac1、RhoA和RhoC)与细胞广泛的生物学过程,包括从肌动蛋白细胞骨架重排到细胞极性,细胞迁移和细胞周期运行等密切相关。因此,这些Rho GTPase与各种疾病和发育紊乱,以及肿瘤等相关。Wang等研究发现Rho GTPase-信号通路与肿瘤细胞代谢密切相关的,高度激活Rho GTPase家族的Cdc42、Rac和RhoC可以显著激活线粒体谷氨酰胺酶基础活性。肿瘤细胞内谷氨酰胺酶调节包括两个方面,一个是表达增加,就是谷氨酰胺酶蛋白水平升高;另一个是酶活性提高。谷氨酰胺酶转录后修饰调节可能在肿瘤细胞和转化细胞中发挥重要作用。Wang等进行了K型谷氨酰胺酶特异性羧基端剪接变体谷氨酰胺酶C(glutaminase C,GAC)异位表达研究,结果发现异位表达在Dbl转化细胞的GAC基础活性显著高于异位表达在非转化细胞的酶活性;接着作者将Dbl转化细胞异位表达的GAC分离出来并用碱性磷酸酶处理后导致GAC基础活性完全消除,这提示癌细胞和转化细胞中GAC是被磷酸化修饰的并且与其基础活性升高相关的;研究还证明GAC特异性抑制剂968通过阻断转化细胞内GAC磷酸化修饰而发挥作用的。研究表明Rho GTPase-信号通路能激活转录因子NF-κB。另外,NF-κB激活对Dbl诱导细胞转化是必需的,并且与人类肿瘤,特别是乳腺癌密切相关的。因此,Wang JB等用小分子化合物(抑制NF-κB负调因子IκBα降解)抑制NF-κB活性或用RNA干扰下调NF-κB大亚基p65/RelA后都能明显使Dbl转化细胞和乳腺癌细胞中谷氨酰胺酶活性下降。这表明NF-κB激活对于肿瘤细胞谷氨酰胺酶活性非常重要的。NF-κB参与细胞多种生物学功能,包括肿瘤细胞存活和迁移等密切相关的一个重要转录因子,它不能直接调节谷氨酰胺酶活性。显然可能是通过间接途径,如上调与GAC修饰有关的蛋白激酶和(或)相关调节蛋白等。目前有关GAC修饰的相关激酶以及GAC修饰位点和结构信息等还不清楚,有待进一步研究。
最近研究表明Myc过表达在谷氨酰胺代谢中发挥重要作用。Myc过表达可抑制microRNA-23a/ b表达,导致线粒体谷氨酰胺酶表达增加,从而增加谷氨酰胺分解。研究表明Myc与某些依赖谷氨酰胺肿瘤类型密切相关的,这类肿瘤细胞缺乏谷氨酰胺时会导致Myc依赖的细胞凋亡。Myc不仅诱导谷氨酰胺转运载体ASCT2 和SN2表达,而且还诱导谷氨酰胺酶和LDH表达,这不仅会导致乳酸增加,而且增加细胞增殖合成所需的乙酰CoA和NADPH+H+。因此,Myc过表达的后果是细胞代谢重调整,转而依赖谷氨酰胺分解代谢来维持细胞生成和补缺TCA循环。Myc过表达的不同细胞系对剥夺谷氨酰胺敏感性是不同的,而另一些Myc过表达的细胞系对葡萄糖剥夺敏感,这些对营养素不同要求的机制还不清楚,但这些肯定与不同细胞的糖酵解速率和谷氨酰胺分解速率有关。
