目前对唾液腺导管细胞电解质的转运机制的了解仍不完全。与肾脏和其他吸收性上皮的导管系统不同,唾液腺导管系统对水没有通透性,因此初始唾液中的水分将不会发生改变,其渗透压的改变均来自于导管细胞对离子成分的修饰。
电解质转运模型
唾液腺导管细胞电解质转运过程可用Knauf等1982首先提出、后来为Cook等修改的模型描述。这个模型提出,基侧膜上的钠泵维持细胞内高K+低Na+状态,从而产生跨膜Na+梯度。管腔中的Na+可经由顶膜上的Na+通道或Na+-H+交换进入细胞;管腔中的Cl-则可经过Cl-通道以及不依赖Na+的Cl--HCO3-交换进入细胞;H+则可通过K+-H+交换进入细胞。细胞内的K+和Cl-可经基侧膜上的Cl-通道及K+通道流入血流。细胞内的Na+则被Na+/K+泵泵出(图3-2)。推测导管细胞胞质pH是由K+-H+交换和Cl--HCO3-交换维持的,但具体作用过程不明。不难看出,整个离子转运过程是一个从管腔内重吸收Na+和Cl-到血流中的过程。与之相匹配,细胞同时分泌K+和HCO3-到管腔内。这个过程的动力来自Na+/K+泵所产生的细胞内低Na+状态。在这个过程中,cAMP是主要的第二信使,Na+和Cl-的重吸收是cAMP所激活的。Ca2+信号的作用尚不确定,推测是抑制Na+和Cl-的重吸收。导管细胞的细胞间连接对水和离子均没有通透性。
上述模型仍有需要修改的地方,例如要使两侧膜上的离子进出平衡,基侧膜上应有K+-Cl-协同转运蛋白存在,但迄今仍无证据表明其实际存在。
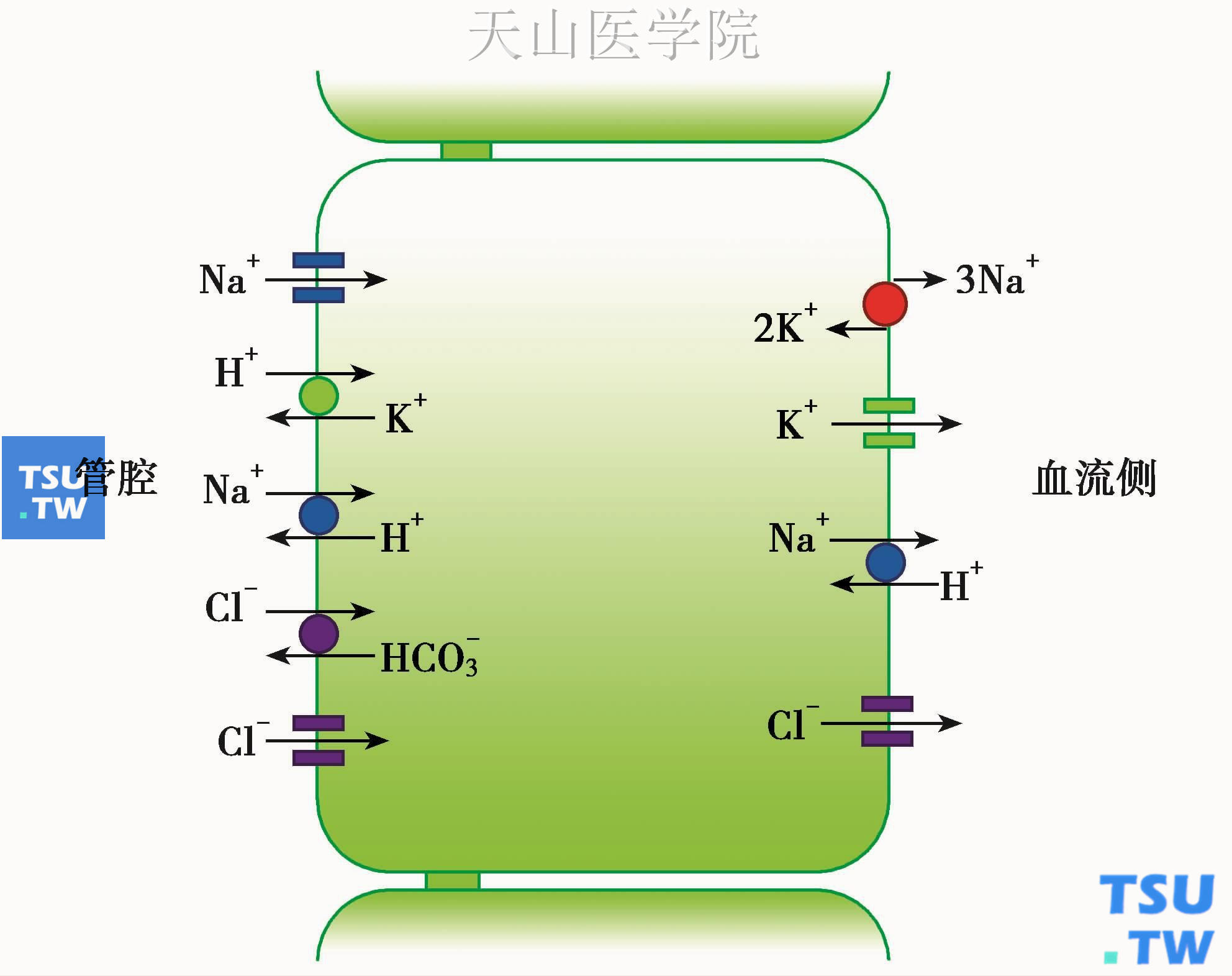
图3-2 唾液腺导管细胞电解质转运示意图
离子转运机制
管腔侧(顶膜) Na+通道
从管腔到血流的Na+重吸收是导管细胞电解质主要的动力。如图3-2所示,导管细胞顶膜存在有Na+通道,可导致大量Na+内流入细胞。实质上,所有吸收性上皮包括唾液腺导管细胞,均含有Na+通道。
分类:上皮Na+通道的分类很复杂,已有数种方法。
①按对抑制剂氨氯吡嗪脒(amiloride)的敏感程度分类:这种分类法把Na+通道分为高敏通道和低敏通道。凡氨氯吡嗪脒的Ki<1μmol/L者称为高度敏感性Na+通道,而Ki>1μmol/L者,称为低敏感Na+通道。
②按对Na+和K+的选择性分类:这种方法把上皮Na+通道分为三组,分别为Na(5)型、Na(9)型、Na (28)型。Na(5)型具有很高的离子选择性,又称为高度选择性通道,其对Na+和K+的选择性(PNa/PK)>10。Na(9)型具有中等选择性,其PNa/PK为3,而Na(28)型对Na+和K+没有选择性。
③按分子结构分类:90年代早期(1993~1994),用大鼠大肠对上皮Na+通道进行了克隆,发现这些通道由三种同源亚单位构成,即α、β和γ ENaC(rat epithelial Na+channel)。ENaC均属于高度选择性Na+通道。
电生理特征:①高度选择性Na+通道:单通道电导为3. 7~4. 9pS;PNa/PK为10~20;氨氯吡嗪脒的Ki为0. 07~0. 3μmol/L。②中度选择性Na+通道:单通道电导为9~21pS;PNa/PK为3~6;氨氯吡嗪脒的Ki 为0. 9μmol/L。③非特异性阳离子通道:单通道电导为2. 6~30pS;PNa/PK为1~1. 5;氨氯吡嗪脒的抑制能力变异甚大,取决于组织来源,一般为0. 1~10μmol/L。
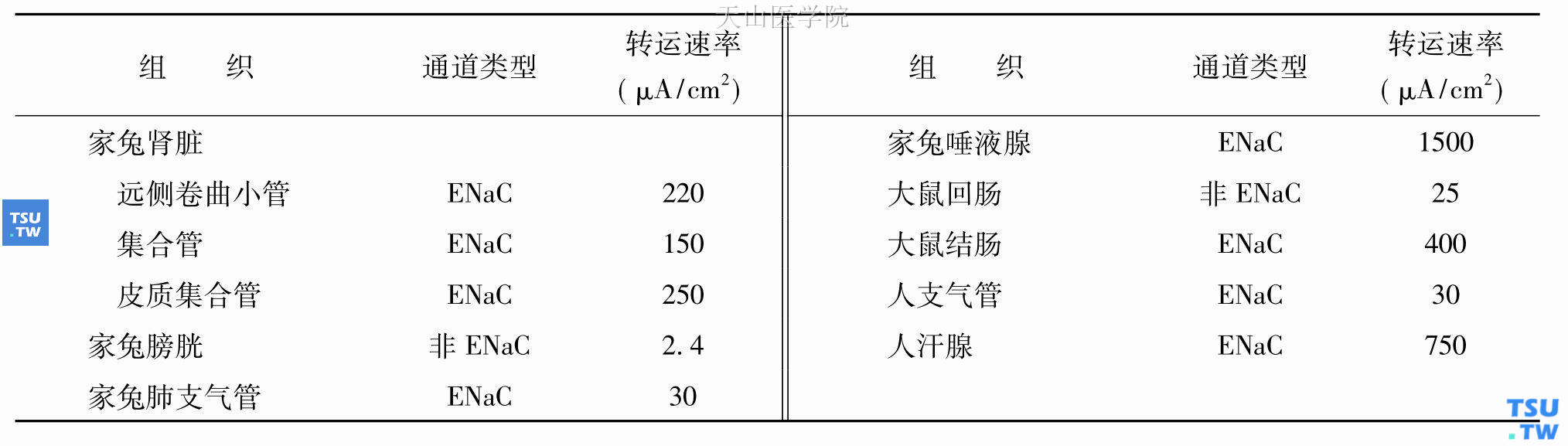
唾液腺的Na+通道可能是活性最强的Na+通道。已知家兔唾液腺的Na+通道的Na+的重吸收率为1500μA/cm2,远远高于其他任何组织(表3-14)。
表3-14 不同组织Na+通道的转运速率
顶膜Na+-H+交换
许多研究表明,大鼠唾液腺导管细胞顶膜含有电中性Na+-H+交换器,这提供了另外一种Na+进入细胞的途径。由于Na+入细胞、H+出细胞最终可能导致HCO3-的吸收。已经观察到,如果用Cl-取代家兔导管管腔内的HCO-,Na+的吸收则减低30%。如果用脂溶性物质丁酸盐取代HCO-,
33则不会影响Na+的吸收,表明其作用是在Na+转运机制。更重要的是,溶液中含有碳酸酐酶抑制剂如乙酰唑胺(acetazolamide)时也产生类似作用,表明HCO3-来自CO2。但是这些物质对家兔导管系统不起作用,提示家兔的Na+吸收比大鼠更复杂。迄今为止,Na+-H+交换在导管细胞的Na+吸收中的重要性仍不十分确定。
Cl-通道
Na+经Na+通道进入细胞产生的细胞内正电荷增加必须伴随有负电荷进入或正电荷出细胞。曾经有人考虑K+外流到管腔内的可能性,但很快就被否定了,因为顶膜对K+的通透性很低。家兔导管系统存在有阴离子电导,后来证实不是经由细胞间紧密连接,而是通过跨细胞转运途径。虽然导管上皮是非常“紧密”的,但家兔导管对Cl-的阻力却很低。当导管上皮管腔和基侧的溶液中含有相同浓度的Cl-时,其电阻仅为10Ω/cm2。用SO42-取代Cl-时,电阻增加到40Ω/cm2,表明存在Cl-的电导。后来单细胞通道技术也证明,导管细胞的顶膜和基侧膜上均有Cl-通道。这种Cl-通道可能是cAMP激活的。最近的研究证明,CFTR Cl-通道是导管系统Cl-重吸收的主要机制。
K+分泌机制
大鼠下颌下腺导管可分泌大量K+,其分泌速率为2. 5nmol/(cm2•s),相当于Na+吸收速率的50%以上,达到稳态时的电化学梯度为7. 5kJ/mol,而Na+的电化学梯度为10kJ/mol。这样高的电化学梯度除了来自主动转运机制之外,还由于顶膜K+倒流的通透性极小。K+的分泌主要是经由K+-H+交换。
K+的分泌有明显的种间差异,家兔导管分泌K+的能力明显低于大鼠。家兔导管的K+分泌的速率一般在0. 5nmol/(cm2•s),仅仅相当于大鼠的20%。然而家兔导管转运Na+的能力却是大鼠导管的3倍。与之相符,家兔导管所产生的K+的梯度仅为2. 5kJ/mol,只有大鼠的1/3。这种差异的原因不明,既不是来自于顶膜的K+通透性不同,也不是由于钠泵的活性不同,唯一可能的解释是大鼠导管含有更多的K+-H+交换器。然而,这只是一种理论上的推测,目前还没有K+-H+交换器的实验证据。
HCO3的分泌机制
-导管细胞可主动分泌HCO3-。研究表明,大鼠和家兔下颌下腺导管可分别建立HCO3-电化学梯度达3. 0kJ/mol和6. 1kJ/mol。然而,当用含有HCO3-的生理盐水(阳离子为Na+)灌流大鼠下颌下腺导管时,HCO3-的分泌则很慢。更有甚者,用这种溶液灌流家兔唾液腺导管则引起HCO3-吸收,而不是分泌。与之相反,如果减低管腔内的Na+浓度,HCO3-分泌增加,其机制不明。虽然导管细胞分泌HCO3-的速率低于分泌K+的速率,但只要Na+吸收被完全控制,K+和HCO3-的分泌就完全相同,表明二者以同样量分泌。由于Na+-H+交换的进行,使H+流入细胞,HCO3-又被部分重吸收,因而其浓度低于K+。直到现在仍不完全清楚HCO3-转运的确切方式。有人认为,HCO3-可以CO2的形式自由扩散,证据是抑制碳酸酐酶就可以抑制HCO3-转运,但这种理论不能解释全部HCO3-转运现象。
