尽管恶液质的准确机制仍然不十分清,有许多因素可影响恶液质的发生发展,包括实际体重、肿瘤位置及分期、食物摄食量减少、代谢率改变、内分泌异常及抗肿瘤治疗的副作用等。但是已经被证实的是,体重明显减轻的肿瘤患者其机体炎症反应明显,故细胞因子发挥着重要的作用。基因型能够通过改变肿瘤组织和宿主体内的细胞因子的产生水平,从而影响恶液质的发生发展。
固有免疫受体及免疫调节介质
Toll样受体
Toll样受体(toll-like receptors,TLRs)属于病原相关分子模式识别受体,主要表达于天然性免疫系统细胞,如单核细胞/巨噬细胞、树突状细胞。目前确定的TLR 共有11种,可识别不同的配体。TLRs通过激活核转录因子(nuclear factorkappa B,NF-κB)进而调控多种重要的细胞因子、黏附分子和趋化因子的表达,在机体的免疫应答、炎症反应及组织修复等方面发挥重要的作用,其活化也参与细胞增殖和凋亡的过程。近来大量研究表明,TLRs与肿瘤密切相关,特别是与炎症相关肿瘤。
固有免疫反应情况已被证实与TLR4基因的多态性相关,TLR4的突变可引起机体对脂多糖的低反应性。在动物实验中,与TLR4基因敲除的C3H/HeN小鼠相比,野生型的小鼠体重减轻显著,去脂体重及脂肪组织明显减少,IL-1β水平也明显比前者升高。
TLR1基因定位于染色体4p14,长度为8537bp,有4个外显子区和3个内含子区。在+1805位点存在T/G多态性,体外实验发现,+1805G等位基因转染细胞的基础NF-κB活性及脂多糖刺激后的NF-κB活性均下降。
TLR2基因定位于染色体4q32,在+2029、+2251 及-16934位点分别存在C/T、G/A及A/T多态性。研究发现,携带+2029T等位基因者IL-12产生水平较+2029C者明显减少,且+2029T及+2251A等位基因转染细胞的NF-κB活性比野生型的降低。在内含子1区存在GT串联重复序列,与启动子区域的-16934A /T多态性密切相关,-16934A等位基因者的GT重复序列较少,平均为19次,而-16934T等位基因者则为24次。同时,在体外实验发现,携带-16934TT基因型的外周血单核细胞在刺激后的TNF-α、IL-6及IL-12的产生量均较多。
TLR4基因定位于染色体9q32-33,在+896、-2604位点分别存在A/G、G/A多态性。在相同的脂多糖刺激下,转染+896GG基因型质粒的THP-1细胞的NF-κB活性比转染野生型的THP-1细胞显著降低,且NF-κB的易位减少。同时,人类实验中发现,携带+896G等位基因者的促炎症细胞因子、急性期反应蛋白和可溶性黏附分子的水平均较低。同样的,关于-2604G/A多态性的研究提示,携带-2604AA基因型者的细胞内TLR4 mRNA转录水平较GG或GA型的低。
TLR5基因定位于1q41-q42,在+1174位点存在C/T多态性。体外实验发现,在相同的鞭毛蛋白刺激下,转染+1174T等位基因细胞的NF-κB活性较野生型者低。
P选择素
选择素是一类细胞表面跨膜糖蛋白,根据其表态部位不同,分为E选择素、P选择素(P-selectin,SELP) 、L选择素。SELP又称颗粒膜糖蛋白(granular membrane protein,GMP) -140是一种富含半胱氨酸的整合蛋白,为黏附分子选择素家族主要成员,可表达于活化的血小板及内皮细胞表面,也有可溶形式。其主要功能是介导白细胞、内皮细胞、血小板等细胞间的反应,在免疫识别、炎症反应和血栓形成过程中起重要作用,参与急性炎症反应中巨噬细胞及中性粒细胞的募集。
对于尚未发生恶液质的肿瘤患者,SELP基因型情况可能在对患者进行危险度分层中有重要意义。在腹腔内注射脂多糖(lipopolysaccharide,LPS)小鼠或肿瘤小鼠体内均发现高水平的SELP。有人认为,骨骼肌表达SELP单纯是由于全身炎症反应的作用。然而,Tan等人的研究结果提示,SELP是在小鼠/大鼠肌肉萎缩过程的早期诱导基因产物。而在关于胃癌与结直肠癌患者存活率的研究中发现,SELP血浆水平是一个重要的预后因素,SELP较低的肿瘤患者的生存期较SELP高水平者长。
SELP编码基因定位于人为染色体1q21-24,有17个外显子和16个内含子。SELP基因在+37674、-2123及-1969位点存A/C、C/G及A/G多态性。有研究提示,以上的基因多态性均与血浆SELP水平相关,携带+37674C、-2123G及-1969G等位基因者的血浆SELP水平较低;且携带+37674C等位基因的肿瘤患者的肌肉萎缩程度及体重减少程度均较轻,故可认为SELP基因多态性与恶液质的发生率相关。
细胞因子
TNF-α
TNF-α是主要由单核/巨噬细胞产生的促炎症因子,可调节炎症及自身免疫反应。通过与细胞表面的TNF受体(TNF receptor,TNF-R)结合,激活胞内反应,从而调控多种基因的表达。TNF-α的分泌调节部分受到基因的调控。
人类TNF-α基因定位于染色体6p21.3,在-308、-238、-856、-862及-1031位点分别存在五个常见的基因多态性:G/A、G/A、C/A、C/A及T/C,在-163、-243及-375则存在三个较罕见基因多态性位点:G/A、G/A及C/T。
-308A的人群发生率约为10%~25%。多项研究发现,与-308CC基因型的人群相比,-308CA基因型人群的全血细胞在经LPS刺激后TNF-α的分泌量更多,体内的TNF-α血浆水平更高;与-308A/-238G单体型相比,-308G/-238A单体型的转录活性明显低于前者,经CD3及链球菌抗原刺激后的外周血单核细胞TNF-α产生量也显著减少。通过检测人类肝母细胞瘤细胞(HepG2)的氯霉素乙酰转移酶(chloramphenicol acetyltransferase,CAT)受体基因,发现携带-862A等位基因的细胞的TNF-α转录活性降低31%,而在151名受试者中,携带A等位单核苷酸的人群其血浆TNF-α也比其他人群低(P<0.05)。通过检测人类肝母细胞瘤细胞(HepG2)的氯霉素乙酰转移酶(CAT)受体基因,发现位于TNF-α基因启动子区域的-862C/A位点的A等位单核苷酸可使TNF-α的转录活性降低31%,而在151名受试者中,携带A等位单核苷酸的人群其血浆TNF-α也比其他人群低(P<0.05)。之前的研究猜测TNF-α基因启动子区域存在,NF-κB的结合序列,然而在体外实验,即使使用高浓度的NF-κB拮抗剂也无法抑制细胞核提取物与携带-862C等位基因的TNF-α基因启动子的结合,提示存在一种与TNF-α基因启动子结合的未知的核蛋白,-862碱基改变可能会影响到启动子与核蛋白的结合力。同样地,发现携带-1031C等位基因患者的血浆TNF-α水平也较低。
淋巴毒素(lymphotoxin-α,LTA),属于TNF家族,由淋巴细胞分泌产生。LTA基因在+252位点存在G/A多态性,+252A与血浆TNF-α水平的升高有关,且+252AA基因型的肿瘤患者预后相对较好。
IL-1β
IL-1β是一种在全身炎症刺激作用下、由巨噬细胞分泌的促炎症细胞因子,具有很强的生物学活性,包括介导炎症反应、促进其他细胞因子产生、诱导基因发生表观遗传学改变、促进血管生成等。同时,IL-1β也与神经性厌食症的发生相关。在体外实验中,白介素-1受体拮抗剂(interleukin-1 receptor antagonist,IL-1RN)可抑制IL-1β的促炎症反应。IL-1β的产生受多种因素所调控,有越来越多的证据提示,遗传因素可能有重要作用。乳腺、结肠、肺与颈部实体肿瘤患者中,IL-1β的产生增多;同时,IL-1β的水平与肿瘤患者预后呈负相关。
人类IL-1β基因定位于染色体2q13-21,全长约430 kb。在-31、-511、-1470和+3954位点分别存在C/T、C/T、C/T及G/C多态性。体内、体外实验均提示,上述位点的基因多态性可对IL-1β、IL-1RN合成及细胞因子血浆浓度产生影响。-31C/ T和-511C/T多态性位点被认为与IL-1β基因的转录活性增加相关,从而IL-1β的产生增加,血浆浓度增高。携带-31T等位基因者的IL-1β生成量较-31C等位基因者的高;而携带-31T/-511C/ -1470G单体型者的外周白细胞IL-1β基因表达水平及经脂多糖刺激后生成量均相对显著增加。同时,-31T和-511C等位基因也可能与无进展生存时间、总生存期降低相关。在体外实验,IL-1β基因的+3953C/T位点的基因多态性与IL-1β的生成增多相关;而+3953CTT基因型与IL-1受体拮抗剂的血浆水平降低有关,也与胰腺癌的生存期缩短有关。同时,+3953T等位基因被认为是胃癌患者发生恶液质的危险因素,与身体总脂肪含量减少。因此,可以认为IL-1β的基因位点多态性可能在恶液质的形成中发挥一定的作用。
IL-6
IL-6是一种具有多功能的生物活性多肽物质,主要来源于单核/巨噬细胞。作为一种多功能的细胞因子,它通过调节免疫应答、急性期反应、造血在宿主的防御机制中起关键作用。IL-6可作用于多种靶细胞,具有广泛的生物学活性,包括:B细胞的分化与成就、细胞毒性T细胞的分化及急性期蛋白的产生。
在小鼠26结肠腺癌模型(murine colon-26 adenocarcinoma model)中,IL-6水平升高可促进恶液质的发展;同时,注入抗小鼠IL-6单克隆抗体在一定程度上抑制了体重减轻和恶液质相关指标的进展。故认为IL-6在肿瘤恶液质的发生发展过程中具有的潜在重要作用。而在人体内研究则提示,在非小细胞肺癌、胰腺癌患者中,并发恶液质患者的IL-6血浆水平明显高于无体重减轻患者,且IL-6血浆水平与白蛋白水平、总蛋白水平、胆固醇及血红蛋白浓度呈负相关。
人类IL-6基因定位于人类染色体7p21,其启动子区域至少有5个已知的基因多态性位点,分别是-597G/A、-572C/G、-174G/C、-634C/G和-190C/T。研究发现,携带-174G等位基因者的空腹胰岛素水平较-174C等位基因者高,而脂联素水平则较低;除此之外,-174CC基因型与较低的去脂体重、腰围增加有关,故认为-174G/C多态性位点在肥胖症中发挥调节作用。而-174G/C多态性位点与较低的IL-6血浆浓度相关,且-174CC基因型个体的血浆C反应蛋白、TNF-α水平均比CG、GG基因型个体显著升高,且肿瘤组织中的细胞因子浓度也升高。在针对胰腺癌患者的研究提示,-634位点的G等位基因在并发恶液质患者的频率比无并发恶液质有显著性提高,且生存期较短;而-190及-572位点多态性在有/无并发恶液质之间均没有显著性差异。
IL-10
IL-10是由Th2细胞、B细胞、单核细胞和角质形成细胞分泌的免疫调节因子,既能促进又能抑制免疫反应,可能既具有肿瘤促进又具有肿瘤抑制的双重功能。
磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)-Akt-雷帕霉素靶向蛋白(mammalian target of rapamycin,mTOR)信号通路广泛存在细胞中,参与细胞生长、增殖、分化、凋亡和葡萄糖转运等多种细胞功能的调节,具有促增殖、抗凋亡作用。PI3K的活性与乳腺癌、肺癌、黑色素瘤和淋巴瘤等多种人类肿瘤的发生相关,在多种肿瘤组织,如胃肠道肿瘤、乳癌、胰腺癌等癌组织中均有Akt的过度表达及活化。
IL-10水平在Myc蛋白/mTOR驱动的肿瘤恶液质综合征小鼠模型以及结直肠癌并发恶液质患者中明显升高。在胃癌患者中,恶液质组血清IL-10水平恶液质组显著升高。Logistic多因素回归分析结果显示,校正了实际体重、肿瘤位置和肿瘤分期后,血清IL-10水平为胃癌恶液质发生的独立危险因素。其可能是因为体内IL-10的增多引发全身炎性反应,从而导致恶液质的发生。
人类IL-10基因定位于1q31-32,有5个外显子和4个内含子。在-1082、-819及-592位点分别存在G/A、T/C及C/A多态性,均可影响IL-10基因转录水平。-1082G/A位于IL-10基因的启动子区域。在两个独立的队列研究中,-1082G/A多态性位点已被证实属于促恶液质基因型位点,与肿瘤患者的生存率相关。在两个独立的队列研究中,-1082G/A已被证实属于促恶液质基因型位点,与生存率相关。-1082GG基因型个体的血浆C反应蛋白及TNF-α水平均比-1082AG、AA基因型者的显著升高;且在膳食摄入量相同的情况下,前者的体重减轻程度比后两者的更大,速率更快,可在多变量分析中被视为决定体重减轻程度的独立因素;在队列研究中,-1082GG基因型个体恶液质发生风险比-1082AA的高,约为2.3倍。故认为-1082G/A多态性位点与肿瘤患者的体重减轻情况及恶液质发生风险相关。在针对亚洲人群的研究发现,-819TT基因型的人群的总体胃癌风险降低,但不能降低幽门螺旋杆菌的致胃癌风险。而-819CC基因型者的IL-10mRNA水平比-819TT基因型者高。在一项针对IL-10基因多态性与胃癌合并恶液质的研究提示,-819CC基因型的肿瘤患者发生恶液质的风险比-819CC基因型者明显增加。除此之外,-1082G/-819C/-592C单体型携带者的IL-10水平明显比ATA单体型携带者的高。
IFN
IFN是一类具有重要要的抗病毒、抗肿瘤和免疫调节作用的细胞因子。根据同源性及受体特异性的不同,干扰素可分为3类:Ⅰ型、Ⅱ型和Ⅲ型。Ⅰ型包括IFN-α(包括多个亚型)、IFN-β、IFN-ω等,Ⅱ型只有IFN-γ;Ⅲ型是一种新型干扰素,包括IFN-λ1、IFN-λ2 和IFN-λ3。IFN-γ主要是由抗原、有丝分裂素等刺激、活化的CD4+辅助性T细胞(T helper cells,Th) -1、CD8+T细胞及自然杀伤(natural killer,NK)细胞所分泌的一类可溶性糖蛋白。IFN-γ具抗病毒,影响细胞生长分化、抗肿瘤和免疫调节等多种活性,但与Ⅰ型干扰素相比,IFN-γ具有较强的免疫调节活性,而抗病毒活性和抗肿瘤活性较弱。
IFN-γ在恶液质发生发展的调节因子仍存在争议。IFN-γ在体重调节及葡萄糖代谢方面可能有重要的调节作用。分别观察IFN-γ基因敲除小鼠及野生型小鼠在接受低脂喂食时的体重、进食量及能量消耗情况,发现IFN-γ缺乏的小鼠的体重减轻明显,存在能量负平衡及葡萄糖耐受。在肥胖患者中也发现IFN-γ水平较高。在肺癌患者中,IFN-γ较低者其生存期相对较短。而在无肿瘤负荷的小鼠中,多次给予亚致死剂量的重组小鼠IFN-γ可诱发明显的食欲减退及体重减轻;相反,在肿瘤负荷的小鼠中给予重组抗IFN-γ抗体可以使已发生恶液质小鼠的食物摄取量增加、体重减轻的速率下降及生存期延长。在体外培养的脂肪细胞中,IFN-γ可降低脂肪酸的合成。
人类IFN-γ基因定位于染色体12q24。IFN-γ基因在+874、-179位点分别存在T/A、G/T多态性。研究提示,携带+874AA基因型者的IFN-γmRNA水平及IFN-γ产生量均比+874 AT及TT型者显著减低,且IL-6水平及C反应蛋白水平也减低。同时,在内含子1区存在多态性微卫星位点:CA串联重复序列,有24、26、28及30bp 4种常见的多态性。在体外实验中发现,CA串联微卫星位点多态性可影响IFN-γ基因的转录水平。CA串联重复序列为24bp的外周血单核细胞株的IFN-γ分泌量比其他长度CA重复序列的高。而携带-179T等位基因者的IFN-γ较高,可能是因为-179T等位基因是核内激活蛋白(activator protein-1,AP-1)的潜在结合位点,后者参与基因的转录过程调控。
细胞因子受体与相关结合蛋白
TNFR家族包括TNFR1和TNFR2,两者存在于所有有核细胞上,并通过不同的信号传导途径介导细胞反应。
TNFR1广泛分布于正常细胞膜表面,也存在于多种肿瘤细胞表面,可通过激活半胱天冬酶和NF-κB活性介导凋亡,引起炎性因子、趋化因子以及抗凋亡蛋白的转录,还诱导细胞间黏附因子1和IL-6的表达。在活化的T淋巴细胞内TNFR1介导的细胞凋亡具有抗病毒效果,可有效清除感染受损细胞,维持机体内环境稳定。
TNFR1基因在-329 与+36位点分别存在G/T、A/G多态性位点。-329T等位基因可使TNFR1的基因表达增多,全身炎症反应减少;而+36GG基因型的细胞表面TNFR1数量比+36AA者多。
TNFR2信号可促进胸腺细胞分化及T细胞增殖,且脂肪细胞的TNFR2的表达数量与体质指数(body mass index,BMI)、血浆胰岛素水平相关。TNFR2 基因定位于1p36.2,含10个外显子及9个内含子。TNFR2在+676、+1663、+1668 及+1690位点分别存在T/G、G/A、T/G及T/C多态性。+676T/G可使TNFR2由TNFR2196MET变为TNFR2196ARG。在体外实验发现,与TNFR2196MET相比,TNFR2196ARG对TNF-α所引起的NF-κB活化反应降低。而+1663G、+1668T、+1690C基因型的TNFR2基因转录活性增加。
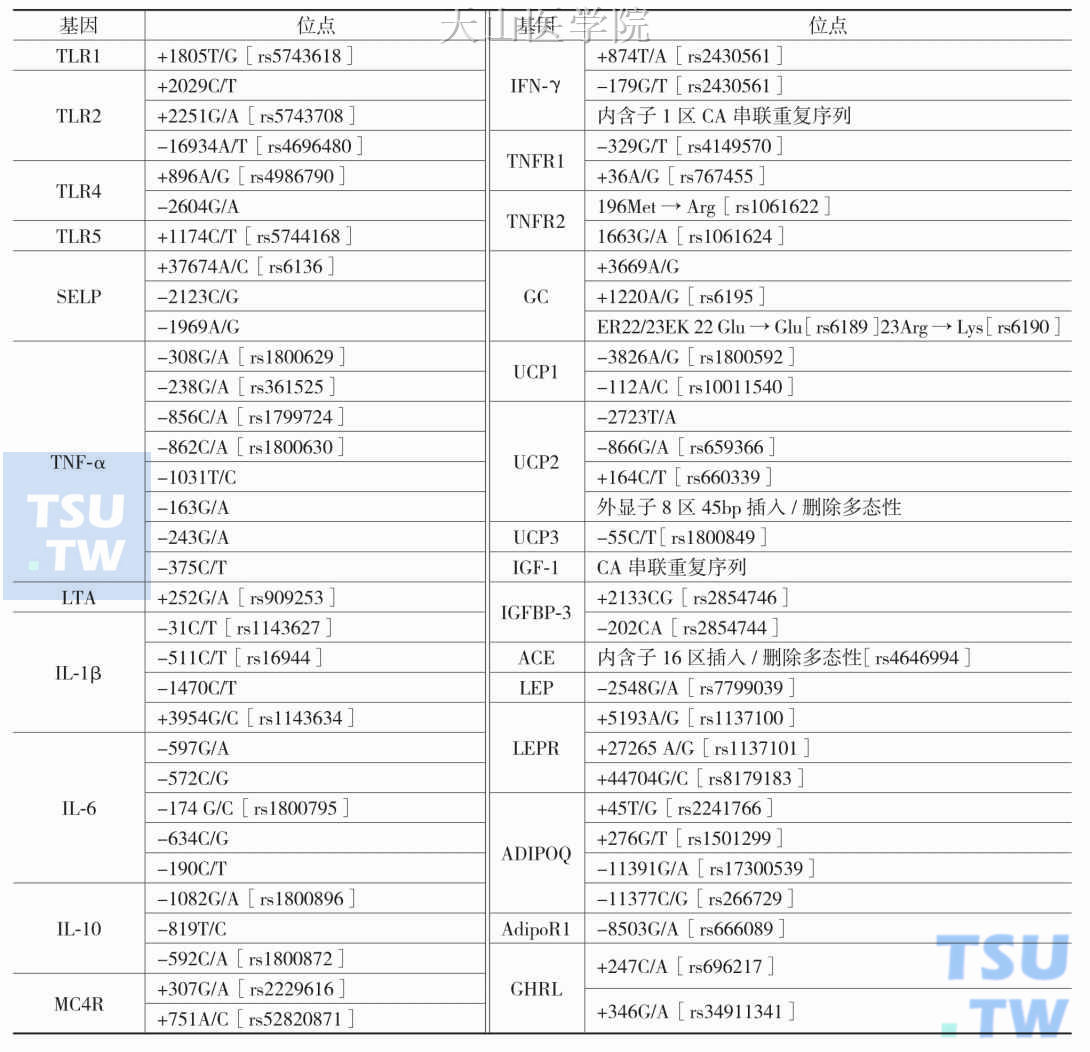
恶液质相关基因多态性位点见表2-1-2。
表2-1-2 恶液质相关基因多态性位点