病例与思考
患者,男性,42岁,因间断腹泻半年,加重2个月余入院。患者半年前无明显诱因间断出现腹泻,呈水样便,每日约3~4次,未予以在意,近2个月腹泻频率逐渐增加,每天10余次,排泄量大,无腹痛。近2个月体重下降5kg。入院查体:体温37.4℃,脉搏146次/分,呼吸22次/分,血压110/70mmHg。身高175cm,体重50kg,BMI=14.32kg/m2。神清,双颊部潮红,体态消瘦。皮肤干燥,弹性差,呈重度脱水征。腹软,无压痛,肝脾未触及,四肢肌张力减弱,双下肢肌力Ⅱ级。双上肢肌力Ⅳ级。腹部CT提示胰尾占位。血钾2.7mmol/L,尿素氮5mg/dl。经奥曲肽试验治疗腹泻明显减轻,给予补液、对症、支持治疗后患者一般状态恢复良好,血钾恢复至正常范围。行胰尾部肿物切除术,术后腹泻显著缓解。
- 患者出现腹泻的原因?
- 针对患者腹泻如何治疗?
- 奥曲肽治疗腹泻机制?
恶液质肿瘤患者常出现腹泻,加重肠道功能紊乱,黏膜免疫屏障逐步被破坏,导致患者营养物质摄入进一步减少,加重营养吸收障碍,进而加重恶液质状态。因此及时对恶液质相关腹泻进行干预及治疗有利于改善患者生存质量,延缓疾病进展。
针对腹泻症状的对症治疗
一般治疗
(1) 建立正常的排便习惯。
(2) 注意纠正水、电解质紊乱及酸中毒,补充血容量,确保有足够的水分补充。口服含盐溶液更适合患者,例如:汤、含盐的红果汁和运动饮料等。必要时行静脉补液。
(3) 适当补充维生素如维生素A、维生素B、维生素C、维生素D、维生素K及叶酸等。
(4) 避免产气食物,尤其是乳糖。急性腹泻通常与短暂的乳糖不耐受相关。
(5) 适当增加纤维素量,例如车前子、麸子皮、果胶等。
(6) 清淡易消化的流质饮食,如腹泻严重,可考虑暂时禁食,减轻胃肠道负荷。
(7) 营养支持:针对腹泻严重,摄入不足患者应遵循营养治疗原则给予适当的营养支持。
(8) 大多数恶性肿瘤患者得知病情后,在精神上受到严重打击,容易产生恐惧、急躁、焦虑心理,继而出现胃肠道自主神经功能紊乱,导致或加重腹泻症状,因此加强患者的心理辅导至关重要。
非特异性抗腹泻药物
(1) 抗胆碱能药物:阿托品(0.3~0.6mg/次,每日3次),阻断M胆碱受体,解除平滑肌痉挛;山莨菪碱(5~10mg/次,每日3次),作用弱于阿托品,但散瞳及抑制腺体分泌作用较弱,极少引起中枢兴奋症状。
(2) 收敛吸附剂:双八面体蒙脱石散(3.0g/次,日3次,两餐间服用),加强黏膜屏障的生理功能,防止有害因素对肠黏膜的侵害。
(3) 黏膜保护剂:鞣酸蛋白在口服后在肠道内释放出鞣酸,在肠黏膜表面形成保护膜,减低毛细血管的通透性,使得炎症渗出减少,同时减低了肠内有害物质对神经末梢的的刺激,有利于炎症消散和抑制肠道蠕动。
(4) 肠道蠕动抑制剂:①洛哌丁胺(分次口服,首次4mg、后每次2mg至腹泻停止,最多16mg/日),可抑制肠道平滑肌的收缩,减少肠道蠕动,延长食物在小肠停留时间,促进水、电解质及葡萄糖的吸收。止泻作用显著。②地芬诺酯(口服1~2片/次,每日2~4次):直接作用于肠道平滑肌,减弱肠道蠕动,使肠内容物通过延迟,有利于肠道水分的吸收。但长期应用可产生依赖性。③匹维溴铵(餐时吞服,首次2片、后每次1片至腹泻停止,最多8片/日)选择性胃肠道钙离子拮抗剂,缓解肠道痉挛,恢复正常的肠道运动功能,对心血管平滑肌细胞亲和力极低,常用剂量不会引起血压变化。
(5) 微生态调节剂:可以通过调节正常菌群含量及比例等纠正微生态失调,同时微生态调节剂具有定植性,排他性及繁殖性,进入机体后能够在自然的生态条件中大量繁殖,大大限制了致病的肠道微生物及其毒素与肠黏膜上皮接触,并可通过产生细菌素、短链脂肪酸,胞外酶及争夺营养等作用,对非自然的微生物产生拮抗作用。并可以作为非特异性调节因子,通过刺激机体免疫细胞,促进吞噬细胞活性增强。(一方面通过调节肠道菌群,重建肠道微生物屏障,促进多种营养物质的吸收,减少肠道对毒素的吸收,另一方面能够提高机体免疫力,改善肝功能及全身营养不良状况)。常见制剂:①双歧杆菌类如丽珠肠乐,含双歧杆菌0.5亿/粒,1~2 粒/次,早晚餐后口服;②乳酸杆菌类如多维乳酸菌制剂,含有大量活性乳酸菌及少量粪链球菌、枯草杆菌、维生素、钙、锌等;③复合制剂如培菲康,含有双歧杆菌、嗜乳酸杆菌、粪链球菌活菌胶囊210万个/粒,3~5粒/次,早晚餐后口服。
(6) 抗分泌制剂:针对持续性的、严重的分泌性腹泻,常规治疗无效时,可考虑奥曲肽治疗,推荐100µg皮下注射q8h,后可逐渐增加剂量,直到腹泻得到控制,对于接受高剂量化疗者可给予每日300µg滴注共48小时,以后剂量可增加到2400µg/ d。目前存在两种长效制剂奥曲肽:包括长效奥曲肽,20mg/月,肌注及兰瑞肽SR,20~30mg 10d,肌注。
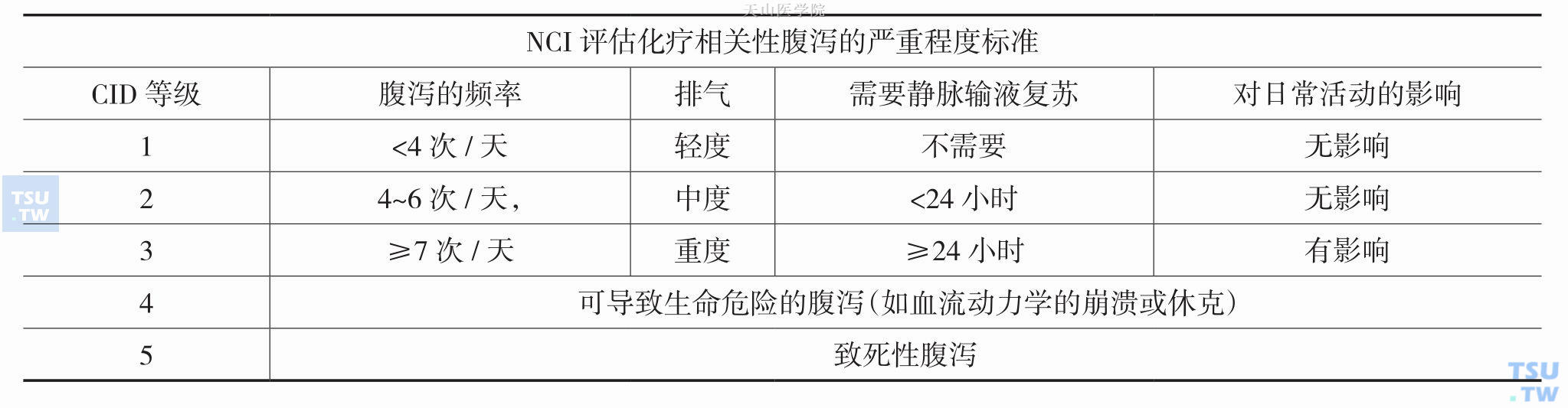
国家肿瘤研究所(national cancer institute,NCI)对于化疗相关腹泻进行分级(表9-8-1):结直肠癌是英国及威尔士致死率第二位的肿瘤病种,在接受化疗的高危Duck B、Duck C、术前新辅助及转化治疗的结直肠癌患者中,存在化疗相关性腹泻(chemotherapyinduced diarrhea,CID)的患者高达82%,其中约1/3患者存在严重的(3~4级)腹泻。这部分患者存在经洛哌丁胺和(或)地芬诺酯治疗无效,给予应用奥曲肽或奥曲肽微球制剂治疗后腹泻停止。相关数据表明,CID分级1~2级的患者应用奥曲肽则效价比较低,应用洛哌丁胺等药物更适合;3级以上的腹泻则更适宜应用奥曲肽。
表9-8-1 NCI对化疗相关性腹泻的分级
针对病因的治疗
肿瘤患者发生腹泻的根本治疗是病因治疗,首先应明确引起腹泻的因素为肿瘤相关性还是非肿瘤相关性,是肿瘤本身引起还是肿瘤治疗引起的腹泻。
针对原发病治疗
(1) 针对肿瘤压迫或刺激所致腹泻,应在患者一般状态允许的情况下尽早给予解除。
(2) 针对吸收不良综合征所致腹泻,腹泻由于胰酶缺乏、胆盐缺乏、胃肠道肿瘤或术后黏膜吸收面积减少等引起。可考虑给予消化酶及组胺受体2(histamine receptor 2,HR2)拮抗剂对症治疗。
(3) 感染性腹泻:肿瘤患者自身免疫功能较差,可能出现腹泻同时伴有发热、腹痛等感染征象;艾滋病病毒(human immunodeficiency virus,HIV)患者中约50%~90%存在腹泻症状,其主要原因为病毒(巨细胞病毒、腺病毒、单纯疱疹病毒)、细菌(沙门菌、志贺氏菌、空肠弯曲菌等)、真菌、原虫感染,以及不明原因腹泻。有效的经验性抗炎治疗及获得微生物学阳性结果后的针对性抗炎治疗十分重要。针对病原体抗菌治疗最为理想。若无法行病原学检测及药敏时,可经验性使用抗革兰阴性杆菌药物。常用磺胺类、喹诺酮类、呋喃唑酮类、小檗碱等。甲硝唑对假膜性肠炎有效。
(4) 抗生素相关腹泻(antibiotic associated diarrhea,AAD):长期应用抗生素或不适当应用可能出现抗生素相关腹泻,其主要致病菌为难辨梭状芽孢杆菌(clostridium difficile,CD),可导致假膜性肠炎(图9-8-1)。AAD主要危险因素有患者年龄<6岁或>60岁,存在基础疾病,存在免疫抑制,住院时间长,外伤、手术、鼻饲等。如存在以上危险因素,同时有长期应用抗生素病史,应警惕抗生素相关腹泻。治疗上可停用相关抗生素,有针对性的使用窄谱抗生素,同时给予营养、支持、对症治疗,适当应用微生态制剂,以期重建肠道微环境。
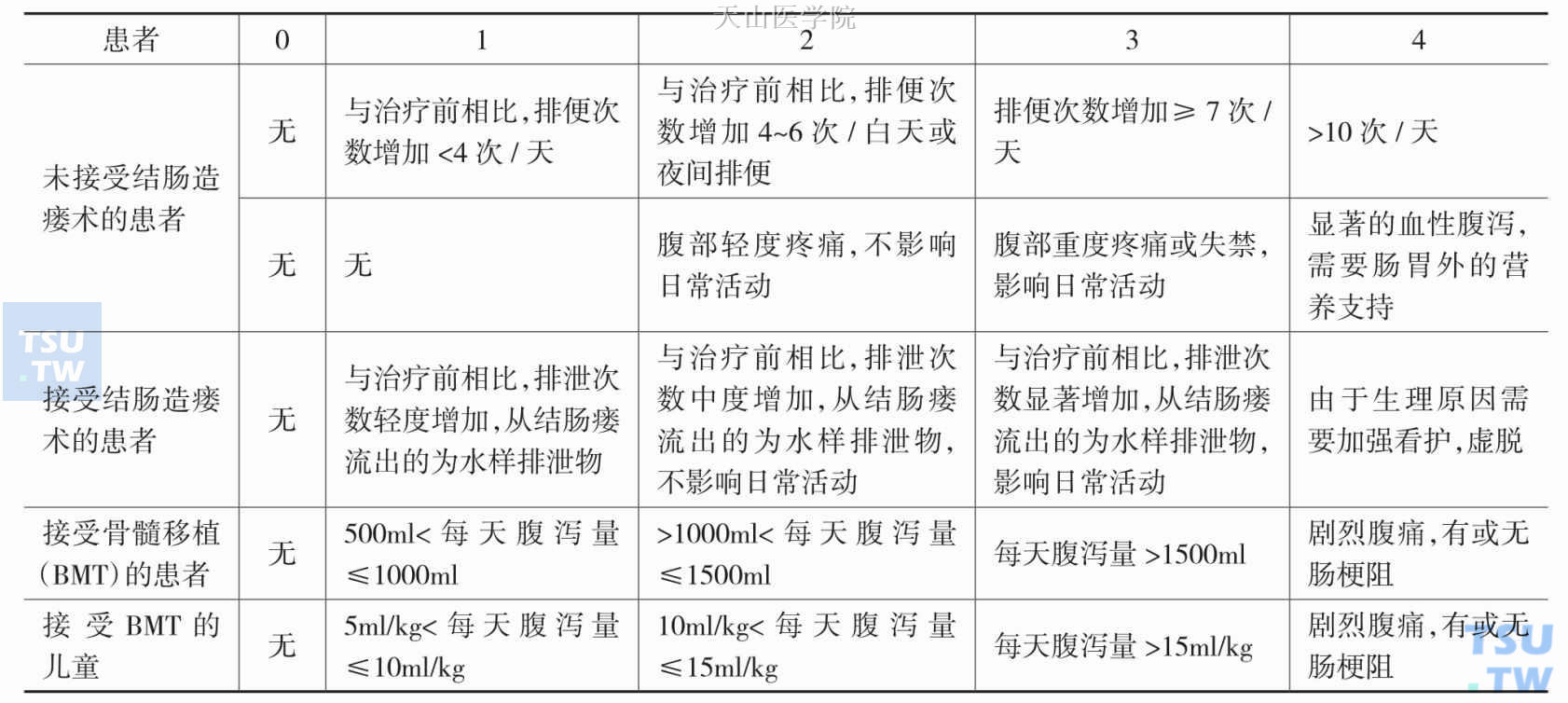
图9-8-1 NCI制定的腹泻毒性标准
(5) 异常分泌激素所致腹泻:如恶液质甲亢长期未控制,持续高甲状腺激素血症,机体分解代谢严重,常出现分泌性腹泻,经抗甲状腺治疗后恶液质可在短期内获得改善。
肿瘤治疗相关腹泻
(1) 化疗相关腹泻(chemotherapy induced diarrhea,CID):CID是临床肿瘤治疗中常见的毒性反应,有较高的发病率和病死率,各个级别腹泻报告发病率高达82%,往往对其认识不足。美国国家肿瘤研究所(National Cancer Institute,NCI)总结了不同患者不同程度腹泻的特点,见图9-8-1。
大约三分之一CID的患者出现严重腹泻(3~4级),严重影响了患者的生活质量.例如,由于腹泻易引发电解质紊乱、脱水、营养不良、肾功能不全及感染等并发症,进而导致脓毒血症甚至死亡,使患者不得不住院治疗。治疗CID相关的费用远远超过了其他治疗相关性毒性的费用。
接受伊立替康治疗的患者中有60%~80%发生腹泻,急性或迟发性腹泻均可发生。急性腹泻发生在使用伊立替康后的24小时内,通常是胆碱能受体介导的分泌性腹泻,一般选择抗胆碱药物——阿托品来治疗急性腹泻。迟发性腹泻一般发生在化疗后的24小时或24小时之后,通常也是分泌性腹泻;治疗迟发性腹泻的首选药物是洛哌丁胺,其是一种非阿片类镇痛药,通过直接影响肠道平滑肌而减弱肠道蠕动,通常首次剂量为4mg,后每4小时(或排不成形便后)应用2mg,直到患者保持12小时不发生腹泻后可停药,最大剂量不超过16mg/ d。其他用于治疗迟发性腹泻的药物还有阿托品-苯乙哌啶、奥曲肽以及鸦片酊。奥曲肽作用于上皮细胞,并且抑制胃肠激素如5-羟色胺、血管活性肠肽、胃泌素等的分泌;同时增加肠道转运时间,促进肠道电解质吸收,从而降低肠系膜血流量。鸦片酊是一种广泛使用的止泻剂,常被作为洛哌丁胺的替代物。
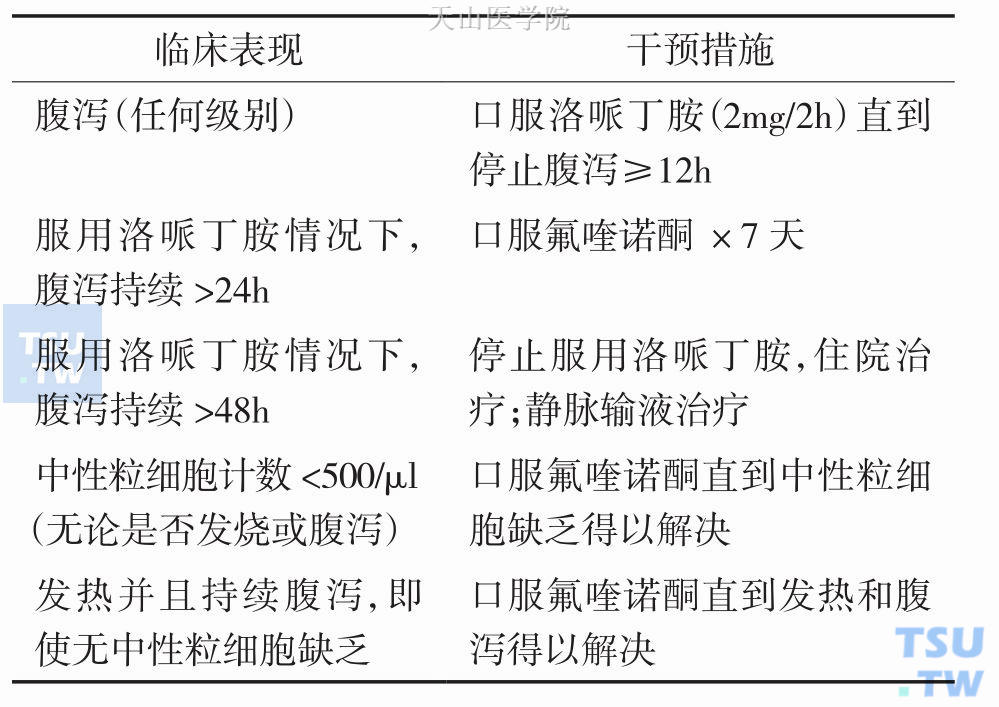
Benson等人于2004年在《临床肿瘤学》中给出了接受伊立替康、5-氟尿嘧啶等药物化疗患者腹泻的具体治疗建议,详见表9-8-2。
针对化疗后腹泻患者,Walder S建议按照图9-8-2流程进行处理。首先评估患者是否存在CID,如评估为化疗相关腹泻,则立即给予饮食管理,并给予口服洛哌丁胺治疗,12~24小时后再次评估,如完全缓解则逐渐加入固体食物,待腹泻停止12小时候停用洛哌丁胺;如出现3~4度腹泻则立即给予补液,补充电解质等对症支持治疗;如为轻度(1~2级)腹泻,则给予高剂量洛哌丁胺对症治疗;12~24小时后再次评估,如完全缓解则逐渐加入固体食物,待腹泻停止12小时后停用洛哌丁胺;如不缓解,则应立即就诊进行补液,纠正电解质紊乱等对症支持治疗。
表9-8-2 接受伊立替康、5-氟尿嘧啶化疗的患者发生CID具体治疗建议
(2) 放疗相关性腹泻:腹泻症状通常发生在放疗的第3周,当放疗联合化疗时发生率会增高,其与被照射部位及照射剂量有关。经过盆腔或腹腔照射后约50%患者发生肠炎,表现为腹部绞痛和腹泻。约3%的患者发生严重威胁生命的腹泻,而26%~49%的患者发生慢性放疗后腹泻。目前放疗导致的腹泻没有明确有效的方法预防,因此一旦出现放疗相关性腹泻,应在一般腹泻的对症治疗基础上尝试其他治疗:最近有文献报道高压氧治疗可以缓解放疗所致慢性腹泻的症状。另有报道称α2巨球蛋白治疗放射性肠炎效果良好,可应用3mg肌肉注射,每日一次,2个月为1疗程。其原理可能是通过对蛋白酶水解活性的调节而参与凝血、纤溶、激肽释放、炎症及免疫等一系列生理及病理过程,抑制血浆激肽释放酶,使之减少,减轻毛细血管渗出;同时可与多种蛋白水解酶结合,抑制其对肠壁的作用。
(3) 手术所致腹泻:①手术相关解剖结构改变所致腹泻,如胃大部切除术、胃空肠吻合术、空肠结肠吻合术经长时间的适应过程可能有所好转,暂给予一般对症处理。②全胰切除术(Wipple手术)治疗的患者常存在腹泻,是由于胰腺外分泌功能不全引起的消化不良和脂肪泻。可以通过低脂肪饮食和口服外源性胰酶得以解决。一些商业制剂制作成微囊使它们能够抗胃酸,防止酶失活。通常应用每餐30 000U的胰脂肪酶吞服,可减少脂肪泻和防止体重减低。
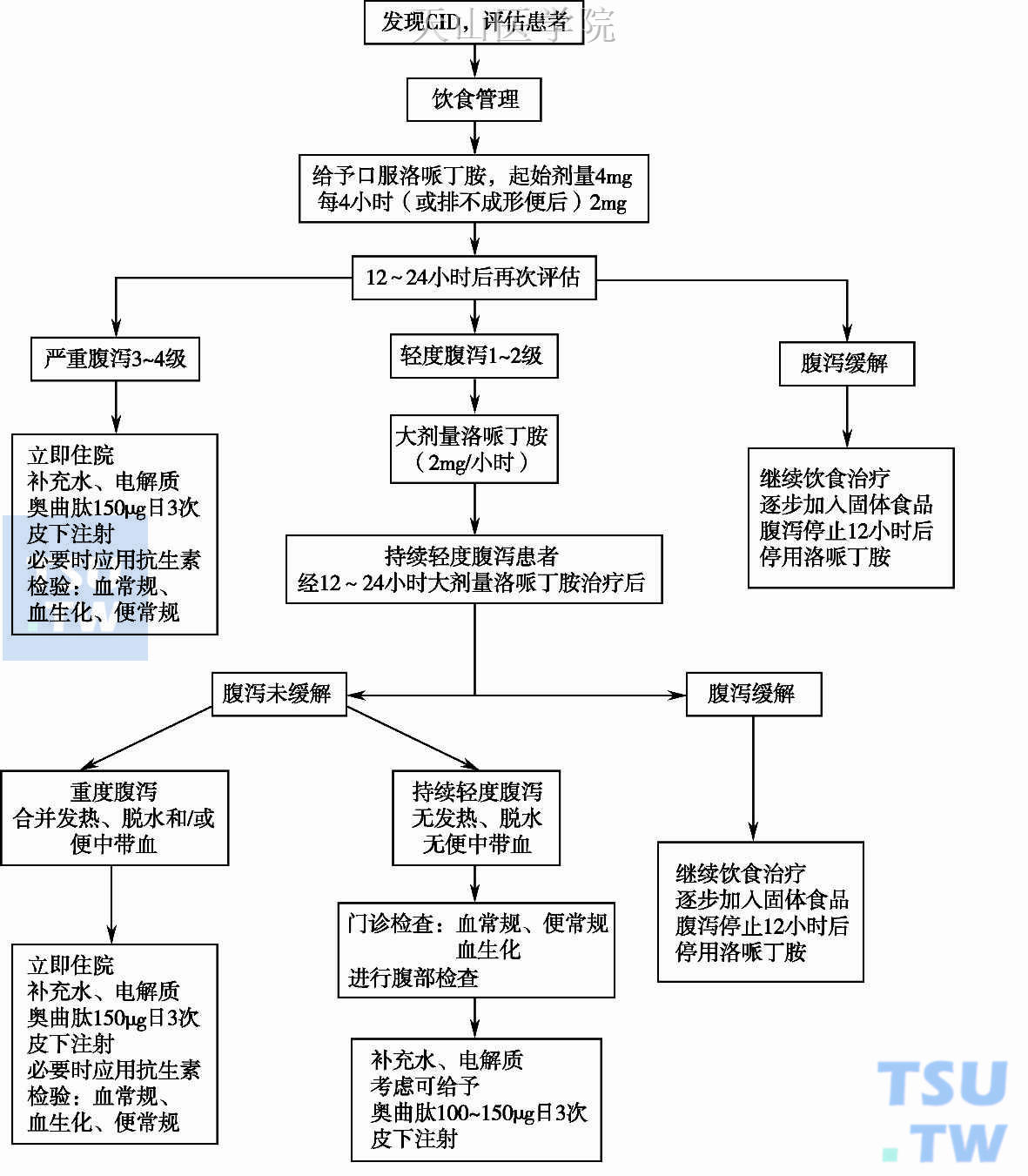
图9-8-2 化疗相关腹泻的处理流程
小结
腹泻作为恶液质肿瘤患者严重的症状之一,可以导致多种不良后果,影响其生活质量,缩短生存时间。在识别恶液质腹泻后,给予积极的对症及对因治疗可明显减轻腹泻症状,阻断或延缓恶液质进程,为进一步治疗争取宝贵的时间。同时随着对治疗相关性腹泻(treatment related diarrhea,TRD)认识的逐步深入,建立TRD的应急预案,规范TRD的诊治流程是医务工作者的一项重要任务。
思考题答案
1. 患者出现腹泻的原因:结合患者大量水样腹泻、低钾血症,双颊潮红,CT提示胰尾占位,考虑患者患有血管活性肠肽瘤:①血管活性肽(vasoactive intestinal polypeptide,VIP)瘤患者100%存在分泌性腹泻,呈水样便,无脓血,起病多缓慢,逐渐加重,病程可长达数年,腹泻开始为发作性,之后逐渐变为持续性,一日10余次,排泄量大,但不伴腹痛,腹泻量大可导致脱水和难以控制的电解质紊乱、酸中毒。②低钾血症:由于严重腹泻可导致K+从粪便中丢失(150~ 500mmol/L)。③无胃酸或低胃酸:VIP有抑制酸分泌的作用,亦可能与分泌抑酸作用的生长抑素有关,临床上无胃酸或低胃酸与腹泻的严重程度相平行,组胺或促胃液素刺激实验阴性。④面部潮红最常见。肿瘤释出的VIP是一种血管舒张肽,其生物活性是激活肠上皮细胞VIP受体促进肠细胞合成环腺苷酸(cyclic adenosine monophosphate,C-AMP),使肠道分泌水和电解质,并有胰液和胆汁分泌,故而出现霍乱样的严重水泻,常伴有严重低血钾和无胃酸(或低胃酸),亦称为胰性霍乱。
2.(1)针对腹泻一般治疗:纠正水、电解质紊乱及酸中毒,充分补液,确保有足够的水化。口服含盐溶液。增加纤维素摄入量,给予清淡易消化的流质饮食,严重时可考虑暂时禁食,减轻胃肠道负荷,应用静脉营养对症治疗。
(2) 针对病因治疗:对定位诊断明确,肿瘤无转移和无手术禁忌证者,首选手术治疗。对不接受手术或不适宜手术者可采用生长抑素衍生物治疗。
(3) 抗腹泻药物治疗:由于VIP瘤所引起的腹泻是一种非感染性的分泌性腹泻,应用奥曲肽治疗效果良好,文献报告奥曲肽可使80%~88% VIP下降,腹泻、低血钾症状得到控制并显著好转。
3. 奥曲肽是一种人工合成的生长抑素合成类似物,可以减少肠系膜血管的血流,抑制胰腺和胃肠道激素的分泌,这些激素均可以引起腹泻。另外奥曲肽还可以调节肠道水分及电解质的转运,增加肠道水及电解质的重吸收,同时还能阻断血管肠肽引起的肠腺分泌和减慢胃肠道蠕动,因此奥曲肽已经用于多种疾病引起的分泌性腹泻,如类癌综合征、Zollinger-Ellison综合征、Vemer-Morrisoil综合征、获得性免疫缺乏综合征(acquired immune deficiency syndrome,AIDS)以及糖尿病。
(吴海涛 李薇)
