在临床上,遇有下列情况时要想到高PRL血症可能:①闭经、经期缩短、月经延迟、经量稀少或经量过多;②溢乳或乳腺萎缩;③不孕;④性欲和性腺功能减退、阴毛脱落、外阴萎缩和阴道分泌物减少;⑤头痛伴视觉异常、视力减退、视物模糊或视野缺损;⑥早发性骨质疏松症;⑦肥胖伴多毛及痤疮。病史中最重要的是有无应用相关药物史以及服用和终止的时间等,有无高血压、溃疡病、精神障碍、失眠、激素治疗、月经生育史、哺乳史及其与乳溢的关系等。
在全面体检基础上,仔细检查乳腺有无溢乳、生殖器有无萎缩,并常规做视力、视野及眼底检查。诊断程序一般分3步进行。第1步为初筛检查,主要测定血睾酮总量、PRL和TSH。第2步是测定ACTH兴奋60分钟后的血17-羟孕酮(17-OHP),做午夜DXM(1mg)抑制试验,测定次晨(8:00AM)的血皮质醇;必要时测定硫酸去氢异雄酮(dehydroepiandrosterone sulfate,DHEAS)和雄烯二酮(androstenedione)。第3步是进行卵巢和肾上腺的影像检查(B超、CT/MRI或核素扫描)。
影像检查阳性支持诊断而阴性不能排除PRL瘤
颅骨X线平片
垂体瘤增大到一定程度可造成蝶鞍骨质局部破坏的X线表现(如鞍区扩大,骨质变薄或缺损等)。由此可推测垂体瘤的存在,但无法确定肿瘤大小,更无法判断微腺瘤的性质。正常鞍结节角约为110°,随着PRL瘤增大,此角可渐变为锐角,据此也可推断垂体瘤的存在。
鞍区CT/MRI
可发现直径小于3mm的微小腺瘤。CT和MRI各有优缺点,但MRI在诊断下丘脑垂体疾病尤其是垂体瘤时优于CT。这主要是因为MRI可以更好地观察垂体瘤内部结构及其与周围组织的关系,了解病变是否侵犯视交叉、颈静脉窦、蝶窦以及侵犯程度,对纤细的垂体柄是否断裂或被占位病灶压迫的细微观察效果也优于CT。垂体微腺瘤在MRI T1加权像表现为圆形的低密度影,T2加权像的密度更高。大腺瘤的影像特征类似于正常腺组织,但其内可出现囊性变或出血灶。当怀疑垂体有PRL微腺瘤时,可用钆-二乙三胺五醋酸(Gadolinium DTPA,Gd-DTPA)作冠状位MRI增强扫描,以增加微小腺瘤发现概率。MRI还可发现一些非垂体性的鞍内占位病变(如脑膜瘤及颈内动脉瘤)。用MRI诊断PRL微腺瘤时,垂体凸出度的诊断价值不及垂体高度。另一方面,虽然CT的清晰度、特异性较MRI差,但它可显示鞍底骨质破坏征象,而MRI不能显示骨质的破坏及钙化组织。垂体瘤患者一般表现为垂体形态改变,左右不对称,腺体密度不均,可见较模糊的高密度灶,大腺瘤有向垂体外扩展影像。增强CT扫描见腺垂体组织影像增强,脑垂体高度超过正常范围(正常男性<7mm,女性<8mm),垂体柄不居中。
PRL瘤的蝶鞍区CT及MRI阳性率约80%,PRL细胞增生和<2.0mm的PRL微腺瘤多不能查出。因此,阴性不能排除PRL瘤可能,如有两次的血PRL≥300μg/L可确立诊断。
缺乏垂体影像依据时根据PRL和PRL动态试验诊断PRL瘤
PRL瘤微小时,很难被常规的CT/MRI检查发现。如果临床高度怀疑为PRL瘤,而患者的血清PRL升高不明显和不升高,此时不应该放松对PRL瘤的警惕性。合适的做法是严格规范PRL测定技术要求,多次复查基础状态下的血清PRL,必要时进行PRL分泌的动态试验,并合理解释测定结果。
血清基础PRL测定
一、采血时间和要求
血清标本抽取时间并无严格限制,无需禁食。一般只要不在睡醒前采血即可。为排除脉冲分泌或静脉穿刺的影响,应重复采取血样。最好的方法是留置静脉导管,患者休息2小时后采血,每次间隔时间约20分钟,共2~6次,取其平均值。一般要求至少测定血PRL、GH、ACTH、LH、FSH和TSH,必要时还需加测相应的靶腺激素,其目的是为高PRL血症的鉴别诊断提供依据,排除PRL/GH瘤、原发性甲减、Cushing综合征或多囊卵巢综合征可能。
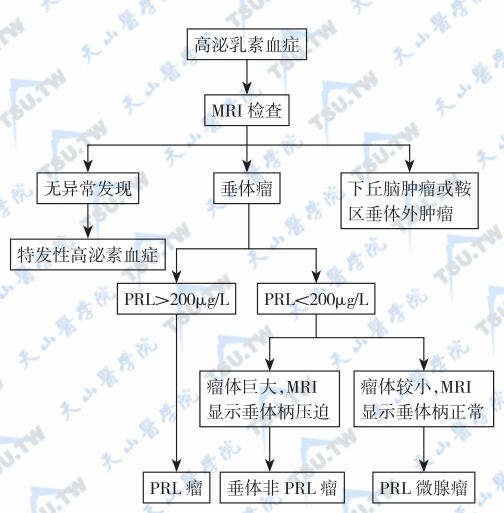
高泌乳素血症的诊断程序
二、结果分析
分析结果要考虑生理性和药物性因素的影响。血PRL基础浓度一般<20μg/L。基础血PRL 60~200μg/L的患者必须结合下丘脑-垂体影像检查判断是否为PRL瘤。高PRL血症的鉴别见图3-12-12。PRL分泌脉冲的重叠在昼夜睡眠-醒觉周期曲线上。任何年龄段女性的PRL总是高于男性,青春期后均高于青春期前,绝经期后有所下降。不论是微小PRL瘤、大PRL瘤或PRL癌,多数情况下的血PRL超过200μg/L。但必须注意的是,PRL瘤患者的血PRL偶可低于200μg/L。
根据血PRL水平诊断PRL瘤的原则是:
- 血PRL在20μg/L以下可排除高PRL血症,>200μg/L时,结合临床及垂体影像学检查可肯定为PRL瘤。
- 血PRL300~500μg/L,在排除生理妊娠及药物性因素后,即使影像检查无异常,也可诊断为PRL瘤;PRL瘤不仅血PRL升高,而且相对稳定,波动小;当PRL极度升高时,应将血清稀释后重测。
- 血PRL在200μg/L以下者,用各种兴奋或抑制(少见)试验来鉴别是否为PRL瘤。由于这些动态试验无特异性,且稳定性差,因而临床上更多地依赖于高分辨率CT/MRI。
- 少数高PRL血症患者尽管基础PRL增高,但无明显临床症状,或PRL瘤患者经药物治疗后症状好转,而PRL下降不显著,要注意循环血液中PRL组分不均一性可能。少数PRL瘤可产生较多的二聚体及多聚体PRL(巨PRL血症),巨PRL的分子量大,分子的形式多样,但生物活性低,一般可用Vitros EC-PRL免疫分析发现巨PRL分子。巨PRL血症的病因和临床表现与一般的高PRL血症相似,男性主要表现为阴茎勃起功能障碍,女性的主诉为月经异常。
- 轻至中度的血PRL升高尤其要排除原发性甲减可能。
- 一般要求同时测定GH,其意义是了解垂体的GH分泌状况,排除继发性GH缺乏症(尤其是儿童和青少年患者);确定是否为PRL/GH混合瘤,该种PRL瘤容易发展为巨大垂体瘤且对麦角生物碱衍生物和多巴胺受体激动剂不敏感。
PRL分泌动态试验
非典型病例不能单凭一项动态试验作出诊断。近年来,人们主张仅用血清PRL测定和CT/ MRI诊断PRL瘤,但在特殊情况下,PRL动态试验对于疑难病例的早期诊断仍有一定意义,一般以溴隐亭抑制试验和TRH兴奋试验的诊断符合率较高。
- 溴隐亭抑制试验:服药当天早8时(空腹)抽血测PRL,夜间10~11时口服溴隐亭2.5mg,次晨8时(空腹)再抽血测PRL。抑制率>50%支持非肿瘤性高PRL血症诊断;抑制率<50%符合垂体瘤性高PRL血症。正常人的抑制率>50%。Nakasu等曾报道1例PRL瘤患者在作溴隐亭抑制试验时,首次服药(2.5mg)3.5小时后出现休克。这种情况虽极罕见,但服溴隐亭前需注意心血管功能检查。
- L-多巴(L-dopa)抑制试验:基础状态下口服L-多巴0.5g,分别于服药前30分钟、服药时及服药后60分钟、120分钟、180分钟和6小时抽血测PRL。正常人服药后1~3小时血PRL抑制到4μg/L以下或抑制率>50%,而PRL瘤不被抑制。
- TRH兴奋试验 :TRH是生理性PRL分泌的兴奋剂之一,正常静脉给予TRH 200μg可使PRL上升,约30分钟后达到高峰。基础状态下,静注TRH 200~400μg(用生理盐水2ml稀释),于注射前30分钟、注射时及注射后15分钟、30分钟、60分钟、120分钟及180分钟分别抽血测PRL。正常人及非PRL瘤的高PRL血症患者峰值多出现在注射后30分钟,峰值/基值>3。PRL瘤者峰值延迟,峰值/基值<1.5。
- 氯丙嗪/甲氧氯普胺兴奋试验:基础状态下肌注或口服氯丙嗪30mg,或甲氧氯普胺10mg,分别于给药前30分钟、给药时及给药后60分钟、90分钟、120分钟和180分钟抽血测PRL。正常人及非PRL瘤性高PRL血症患者的峰值在1~2小时,峰值/基值>3。PRL瘤无明显峰值出现或峰值延迟,但峰值/基值<1.5。
血PRL轻度升高不能否定PRL瘤或PRL细胞增生的诊断
少数PRL瘤患者的血PRL正常或仅轻度升高,其可能原因是:
- 颗粒稀疏型PRL瘤或垂体PRL细胞增生的PRL分泌能力较弱,分泌量较低;
- 肿瘤的PRL分泌为间歇性,采血时没有捕捉到PRL分泌高峰;
- PRL瘤发生梗死或囊性变,PRL的分泌能力下降;
- 常规测试中的PRL抗体不与巨PRL反应;
- 发现的垂体结节并非PRL瘤(意外瘤),而以前的高PRL血症是其他原因所致。在这种情况下,必须进行PRL分泌的动态试验或溴隐亭治疗试验,而且不能单凭一项动态试验作出诊断。
其他激素测定有助于确定PRL瘤性质和腺垂体功能
腺垂体激素
临床怀疑PRL瘤者除测定PRL外,还应检测LH、FSH、TSH、α-亚基、GH、ACTH、睾酮及雌激素。PRL瘤长期高PRL血症导致FSH、LH、LH/FSH比值和E2或睾酮降低,其中LH/FSH比值下降更有诊断意义。PRL瘤的典型特点是血清PRL明显升高,FSH、LH、LH/FSH比值和E2均降低。血PRL对TRH、甲氧氯普胺(metoclopramide)、胰岛素、氯丙嗪等刺激无反应,亦不被L-多巴所抑制。
靶腺激素
怀疑腺垂体功能亢进或减退时,应测定相应靶腺激素水平;PRL瘤患者尿17-KS和各种雌激素分解代谢产物浓度均增加,这可能是高浓度的PRL降低5α-还原酶和3β-类固醇脱氢酶的活性所致。血总睾酮测定可作为初筛试验,但其敏感性不高。血睾酮有3种组分,即性激素结合球蛋白结合的睾酮、白蛋白结合的睾酮和游离睾酮,后两者可与睾酮受体结合,反映了睾酮的生物活性,统称为生物可用性或可弥散性睾酮,而睾酮结合的性激素结合球蛋白对生物可用性睾酮有调节作用,因而凡引起性激素结合球蛋白与睾酮结合降低的因素(睾酮过多、肥胖、GH瘤、甲减或肝病等)都能增加睾酮和雌二醇的生物可用性。
非典型PRL瘤与高促性腺激素性性腺功能减退症鉴别
PRL瘤患者的性腺功能减退表现为性欲减退、乳腺发育不良/萎缩、闭经、无排卵;血清LH升高,FSH升高或正常,E2降低而睾酮亦升高;这些表现与高促性腺激素性性腺功能减退症相似,但病因与一般的高促性腺激素性性腺功能减退症截然不同,因此必须与后者鉴别。如果临床缺乏垂体影像依据,而根据血清PRL和PRL动态试验结果又难以诊断PRL瘤时,应考虑高促性腺激素性性腺功能减退症的诊断,并寻找相应的病因。
应用排除法诊断特发性高PRL血症
特发性高PRL血症的病因不明,可能为未能发现的下丘脑病损引起。特发性高PRL血症必须先排除药物性、病理性、生理性高PRL血症后才能确立诊断。CT/MRI无异常发现,一般血PRL仅轻度升高(多<100μg/L)。少数患者可能是PRL瘤的早期表现,以后演变为PRL瘤。当高PRL血症伴有高雄激素血症和女性不育不孕时,应特别注意与多囊卵巢综合征、卵泡膜细胞增殖症、非经典型肾上腺皮质增生症、早期Cushing综合征及肾上腺雄激素分泌性肿瘤鉴别,见表3-12-13。
