卵巢皮质随增龄由厚变薄而髓质由薄变厚
婴儿期皮质区宽厚,占据整个卵巢的绝大部分;生育年龄期的皮质变薄,约占其厚度的2/3;绝经后皮质区极薄,约占卵巢的1/3。皮质区是卵泡发育和卵巢的内分泌功能区。新生儿期含有大量的原始卵泡,青春期后卵泡开始发育。卵巢髓质所占的体积恰好与皮质相反,青少年期极少,随增龄而逐渐变宽,绝经后所占的体积最大。
卵巢肿瘤主要来源于卵巢表层上皮
幼年时,生发上皮呈立方形或柱状,以后逐渐变扁平。生发上皮来自体腔上皮,其功能尚不清楚。在胎儿和儿童时期,生发上皮常完好保存,几乎覆盖整个卵巢;而在成年卵巢表面生发上皮近乎消失。“生发上皮”意味着这些细胞具有再生新的上皮细胞潜能。但是,Tennessee大学的Bukovsky等详细观察了人类的生卵过程(oogenic process),在该过程中,新生的卵子具有透明带(zona pellucida)细胞和层粒细胞(granulosa cells),而这些细胞均来自卵巢的表层上皮细胞,而后者又来源于白膜(tunica albuginea)的间充质细胞(mesenchymal cells)。因此,在整个生育期,卵巢均可生成原始卵泡,而卵巢表面的生发上皮(germinal epithelium)应该称为卵巢表层上皮(ovarian surface epithelium)。这一发现的意义是,卵巢表层上皮是卵巢癌的主要来源,其细胞形态类似于苗勒管上皮(müllerian epithelia),由于这种细胞的分化能力大,故可分别形成生殖细胞瘤(germ cell tumors)和性索-间质细胞瘤(sex cord-stromal cell tumors)。
卵泡发育是动态的演进过程
在妇女的一生中,只有400~500个卵泡能够发育成熟,其余均退化。卵泡发育是一动态演变过程,受卵巢内外多种因素的影响。卵泡和卵丘细胞(cumulus cells)之间存在双向的信息沟通(bidirectional communication);卵丘细胞来源于支持和调节卵泡发育的层粒细胞。此外,卵巢局部分泌的抗苗勒管素(anti-Müllerian hormone,AMH)、转化生长因子(TGF)、SMAD、WNT、FZD、β-连环蛋白(β-catenin)、RAS/ERK1/2 及FOXO/FOXL2 等也是调节卵泡发育和成熟的重要因子。
卵子的前身是原始生殖细胞(primordial germ cell)。妊娠第2周时,经过旺盛的有丝分裂,人原始生殖细胞数可达600万个以上,称卵原细胞,其中一部分开始减数分裂,成为原始卵母细胞(primary oocyte)。出生时,减数分裂突然停止进入双线期,可能是卵泡分泌一种抑制卵母细胞成熟的因子(oocyte maturation inhibitor,OMI)抑制了减数分裂的进程。放出第1个极体后,次级卵母细胞继续减数分裂(meiosis)。如果卵细胞未受精,减数分裂又中断;如果卵细胞受精,减数分裂继续,放出第2个极体,成为受精卵。第1次减数分裂决定着妇女一生的卵巢中可生长成熟的卵母细胞数目。成熟优势卵泡中,卵母细胞生长并完成减数分裂。在生长过程中,卵母细胞的直径从20μm发育至120μm左右,并使营养得到贮存。在始基卵泡形成过程中,卵母细胞与放射冠之间的透明带起着保护卵细胞的作用,在放射冠细胞中具有特异性精子受体,可与同种精子结合,使之得以穿透并靠近卵母细胞,对防止异种精子和阻止多精子受孕有重要意义,同时促使受精卵从输卵管向子宫移动。
始基卵泡
始基卵泡(primordial follicle)由一个停留在减数分裂前期的卵母细胞及一层扁平上皮细胞组成,其外围为基底膜,无直接血液供应,通过基底膜与其他细胞联系。在孕16周即可见到,直到出生后6个月结束。出生7个月时,卵母细胞停止继续分化与减数分裂。青春期妇女的每个卵巢含有几十万个始基卵泡,而到绝经期,始基卵泡就很难找到。
始基卵泡离开静止期向初级卵泡转化,进入成熟周期,称为始基卵泡的初次募集。始基卵泡持续分批进入募集周期,发育成熟或闭锁,直至始基卵泡耗尽为止,此时卵巢功能衰退,进入绝经期。每一始基卵泡的调控取决于卵巢的局部生长因子(生长促进因子和生长抑制因子)和卵母细胞与颗粒细胞之间广泛的细胞连接。干细胞因子(stem cell factor,SCF)是最早发现的促进始基卵泡募集的生长因子,而抗苗勒管素(AMH)是目前发现的唯一始基卵泡生长抑制因子。母亲患营养不良时,可改变女婴卵巢发育的凋亡基因功能,影响卵巢的正常发育。
初级卵泡
初级卵泡(primary follicle)为未发育的卵泡。每个初级卵泡中含有一个卵母细胞,周围由一层梭形或扁平细胞围绕。新生儿卵巢内约有60万个以上的初级卵泡,青春期下降到30万~40万个。开始生长时,基底膜内的颗粒细胞由扁平形变为立方形,并经过有丝分裂迅速增殖,细胞由单层变为多层。卵母细胞不断增大,并分泌凝胶状糖蛋白,覆盖整个卵母细胞(透明带),使卵母细胞与外周的颗粒细胞分隔。外周颗粒细胞不断增殖成复层,排列成辐射状(放射冠,corona radiata)。放射冠细胞的许多纤细突起与透明带相连,成为颗粒细胞与卵母细胞物质交换的渠道,具有这种结构的卵泡称为初级卵泡。
次级卵泡
次级卵泡(secondary follicle)由进一步分裂增殖的颗粒细胞和达到最终生长期的卵母细胞构成。这时成熟卵母细胞直径可达120μm。在颗粒细胞增生的同时,邻近卵泡的间质细胞移行,靠近基底膜,平行而成行地围绕整个卵泡,形成放射状排列的类上皮细胞(epithelioid cell),最终发育成卵泡内膜与外膜。卵泡内膜与基底膜紧邻,细胞多,富含毛细血管。细胞呈卵圆形或梭形,核圆,卵泡生长的后期细胞增大,胞质富含类脂滴。其细胞的结构特征与分泌类固醇激素的内分泌细胞相似,具有合成和分泌雌激素的功能。卵泡外膜与周围结缔组织无明显分界,纤维多而血管较少。此时,卵泡有独立的血液供应(分别来源于卵泡内膜及外膜),并形成两套互相连接的毛细血管网。但毛细血管不穿过基底膜、颗粒细胞或卵母细胞。
三级卵泡
三级卵泡(tertiary follicle)的特点是卵泡膜进一步增厚,颗粒细胞之间出现含液体的小空隙,它们逐渐合并成为一个较大的卵泡腔或卵泡窦(follicular antrum),腔内充满清亮的黏性液体(由颗粒细胞分泌和血浆渗出而成),卵泡液中含有较高浓度的雌激素。颗粒细胞和卵泡膜细胞间形成特殊的隙间连接(gap junction)。隙间连接是由连接子(connexon)相互衔接而成,每个连接子包括六个相同的哑铃形蛋白质亚基——连接素(connexin,CX),连接子即CX的六聚体穿膜蛋白。由连接子组成通道。在卵母细胞及颗粒细胞间也形成隙间连接,通过隙间连接通道进行信息和能量物质传递,参与细胞间物质交换的代谢耦联和电信号传递的电耦联,允许小分子物质从颗粒细胞进入卵母细胞。同时,隙间连接通道实现的细胞间信号转导是保证卵泡发育及卵子形成的高度协调性调节机制,并影响卵巢激素的分泌功能。
囊状卵泡
这一时期的卵泡体积快速增大。不断扩大的卵泡腔将卵母细胞及其周围的颗粒细胞推向卵泡的一端,形成卵丘。到囊状卵泡(vesicular follicle)成熟时排卵,此时卵泡直径可达15~20mm。人类初级卵泡发育成排卵前卵泡的时间平均需10~14天。
卵子成熟与排卵
胎儿出生时,初级卵母细胞已进入第1次减数分裂的前期,并长期停留于此阶段,直至青春期才开始分批完成减数分裂。第1次减数分裂时,染色体均等地分到两个子细胞中,但只有一个子细胞(次级卵母细胞)接受了绝大部分胞质,另1个小的子细胞成为第1极体。第1次减数分裂开始于胚胎时期(胚胎12~13周),直到成人卵泡发育到排卵时才完成。释放出第一极体后,次级卵母细胞的核立即进入第2次减数分裂,并停止于中期,只有卵细胞受精后才能完成第2次减数分裂,染色体再次均等分裂,胞质大部分停留在成熟的卵细胞中,另一细胞成为第二极体,两次减数分裂的结果产生了带有单倍数染色体的成熟卵细胞(下图)。
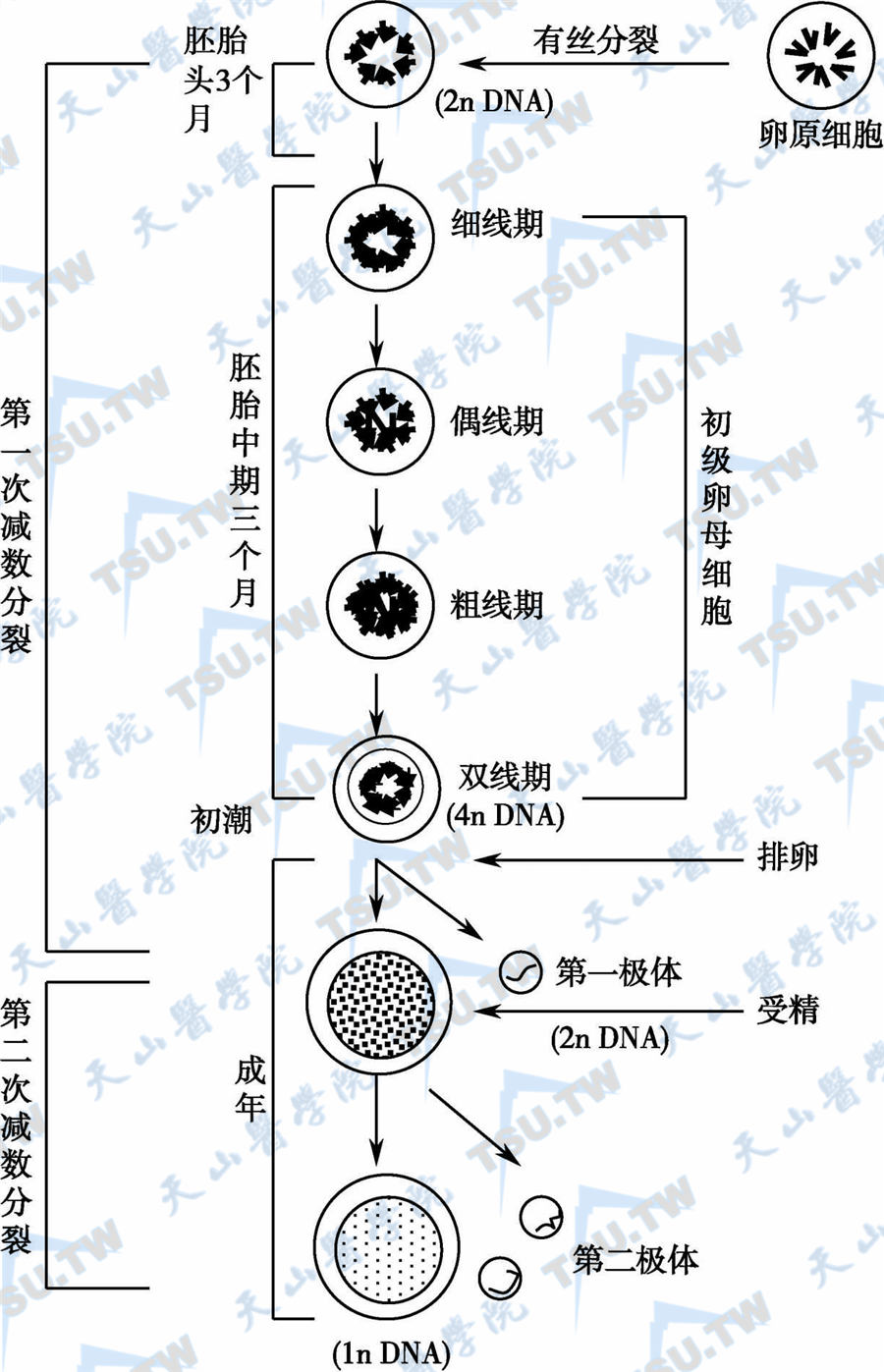
卵原细胞的分裂和成熟
注:卵原细胞在胚胎头三个月完成有丝分裂,胚胎中期(4~7月)开始进入第1次减数分裂,并停留在减数分裂前期(双线期),初潮排卵时完成第1次减数分裂,释放第一极体,进入第2次减数分裂,受精后完成第2次减数分裂和形成第二极体
排卵前,卵泡17β-E2分泌不断增加,对神经内分泌中枢起正反馈兴奋性调节,使FSH和LH释放增加。随着促性腺激素的高峰出现,排卵前卵泡出现一系列结构和生化变化,最终使成熟的卵母细胞排出(排卵)。卵巢约每隔28天排卵1次,排卵时间约在月经周期的第12~16天。一般情况下,左右两侧卵巢交替排卵,每次排卵1个,但也可能由一侧卵巢连续排卵或1次排卵1个以上。
闭锁卵泡发生于卵泡发育的任何阶段
位于皮质疏松结缔组织中的卵泡可分为两类,即非生长卵泡(原始卵泡或始基卵泡)和生长卵泡。在整个生殖期,大部分(90%~95%)是非生长卵泡。生长卵泡分为初级卵泡、次级卵泡、三级卵泡、囊状卵泡和闭锁卵泡(follicular atresia)等数种(下图),其中闭锁卵泡可发生于任何阶段。出生时,卵巢内的卵泡约200万个。青春期前,受垂体促性腺激素作用,初级卵泡成批发育,但均在未达到成熟前闭锁。性成熟后,下丘脑-垂体-卵巢轴的调节功能建立,每个月有多个卵泡发育,通常只有一个卵泡发育成熟、排卵并形成黄体。黄体退化后由结缔组织替代,成为白体。闭锁卵泡的大小不一,大部分发生在早窦腔期,直径超过1μm。较早出现颗粒细胞核固缩、核溶解,最先出现在离卵子最远的颗粒细胞中。募集的始基卵泡或者发展成熟的囊状卵泡并排卵或退变闭锁。生育年龄妇女的每个月经周期有多个卵泡发育,但仅有1~2个优势卵泡发育成熟并排卵,其他卵泡在不同发育阶段萎缩闭锁。卵泡闭锁主要受促性腺激素、性腺激素和卵巢局部非类固醇激素和细胞因子的调节。目前认为,初级卵泡和窦前卵泡的闭锁主要由卵细胞凋亡引起,而窦状卵泡及排卵前卵泡的闭锁都是由于卵泡中颗粒细胞首先凋亡引起的。
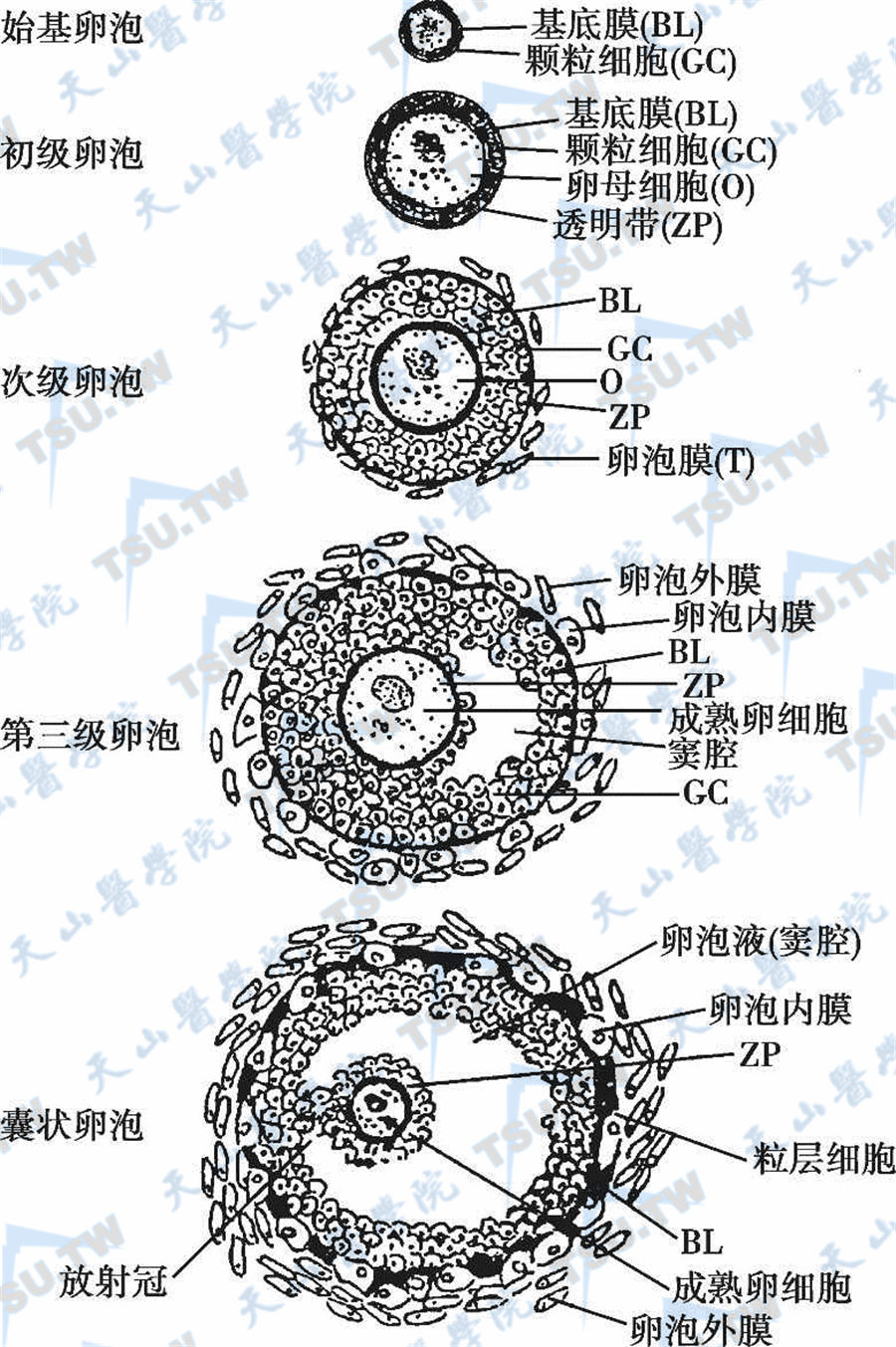
卵泡生长发育过程中的形态变化
间质细胞/粒层黄体细胞/卵泡膜细胞分泌类固醇性激素
间质细胞
间质细胞(interstitial cells)由卵巢基质的间叶细胞衍化而来,主要分泌类固醇雄激素(主要是雄激素),受LH和HCG刺激发生形态变化。人的卵巢含有4种主要的间质细胞,即原始间质细胞、次级间质细胞、卵泡膜间质细胞及门细胞。原始间质细胞最先发生,在胚胎12~20周时就可在胚胎卵巢中被辨认,其形态类似于胚胎睾丸中早期的Leydig细胞,含有分泌性腺类固醇激素的超微结构。次级间质细胞是由闭锁卵泡的卵泡膜细胞过度增生所致,保留卵泡膜细胞类固醇合成的超微结构特征,并继续对LH有反应,产生雄激素;但所受支配的神经及对儿茶酚胺的反应不同。神经冲动刺激次级间质细胞结构变化及激素分泌,并能将从大脑皮质传来的信息直接传递到卵巢。三级卵泡的泡膜间质细胞亦分泌雄激素,它在次级卵泡形成时,从分化的间叶细胞转化而成,含有合成雄激素的某些酶及LH受体,受次级卵泡局部的影响,LH刺激其转化成具有产生类固醇雄激素超微结构的内分泌细胞。卵泡闭锁后卵泡膜细胞发展成次级间质细胞。
粒层黄体细胞和卵泡膜细胞
粒层黄体细胞(granulosalutein cells)和卵泡膜细胞(theca cells)主要分泌孕酮与雌激素及少量的雄烯二酮。一般认为,孕酮由颗粒黄体细胞分泌,而雌激素则主要由卵泡膜黄体细胞分泌。排卵后,卵泡壁塌陷并形成皱襞。在LH高峰后,颗粒细胞体积迅速增大,呈卵圆形或多角形,称为粒层黄体细胞(granulosa-lutein cell),胞质内出现大量滑面内质网和管状线粒体嵴,呈现分泌类固醇激素的特性。粒层黄体细胞在5-羟色胺(5-HT)刺激下,合成和分泌孕酮,细胞膜上的5-HT受体被激活后,通过cAMP信息传递途径调节HCG-cAMP的作用,这些系统的调节紊乱可导致黄体期功能不全(luteal phase defect)。除下丘脑-垂体-卵巢激素系统外,黄体细胞类固醇激素的合成还受许多其他因素的调节,包括NPC-调节系统、胰岛素/ IGFs系统、免疫因子系统、垂体腺苷环化酶活化肽调节系统、金属蛋白酶/金属蛋白酶抑制因子系统和内皮素(endothelin)/一氧化氮(NO)/一氧化氮合酶(NOS)系统等。
成熟卵巢的黄体直径1~3cm(下图),外观不规则,突出卵巢表面。黄体细胞产生大量孕酮(黄体中期最高),每天可达40mg。黄体也分泌一定量的雌激素(主要是17β-E2)和雄烯二酮。妊娠时,两种黄体细胞的形态变化更明显。如未受精,排卵后9~10天黄体开始退化,不再分泌孕酮和雌激素。黄体细胞发生脂肪变性,萎缩退化,细胞间积聚透明物质,并逐渐由结缔组织代替,最后形成白色瘢痕(白体,corpus albicans)。
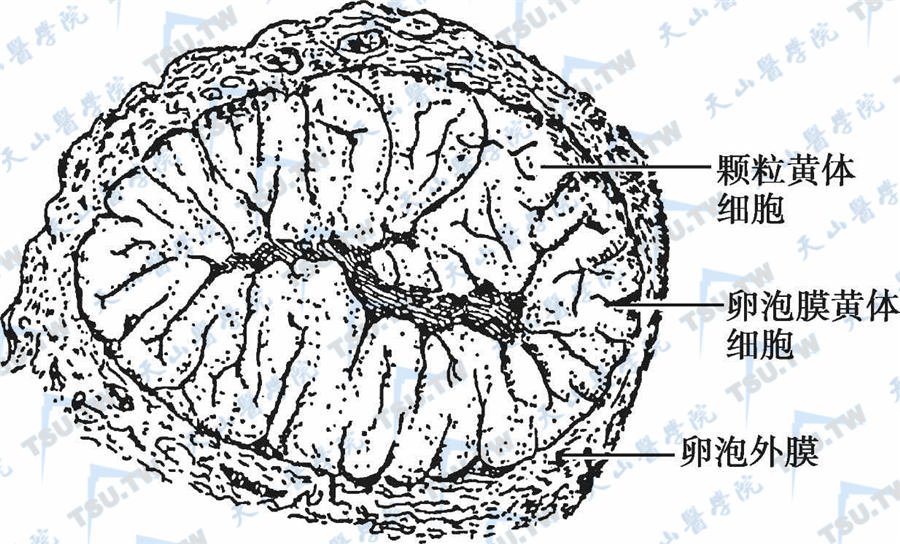
卵巢黄体;注:成熟卵巢黄体直径1~3cm,呈花菜样突出卵巢表面
卵巢髓质主要是由疏松的结缔组织构成,内含丰富的动脉、静脉、淋巴管及神经等。
