高钙血症(hypercalcemia)是恶性肿瘤患者最常见的内分泌方面并发症,称为肿瘤相关性高钙血症(tumor related hypercalcemia),约占所有肿瘤患者的10%。恶性肿瘤患者高钙血症的发生率约为每年15/10万。住院的高钙血症患者的最常见原因是恶性肿瘤。引起高钙血症的原因有3种情况:①癌瘤骨转移,使骨质破坏,骨钙直接进入血液;②肿瘤分泌异源性PTH相关肽(PTH-related peptide,PTHrP)或PTH(少见);③肿瘤分泌除PTHrP或PTH以外的其他骨吸收因子。
有人提出异源性PTH分泌综合征的定义是不论有无骨转移,瘤组织产生并释放PTH样物质,引起高钙血症和低磷血症。有人将肿瘤相关性高钙血症称为假性甲旁亢。
机体具备抵抗高钙血症和低钙血症的精细调节机制,这些调节系统主要由肾脏、甲状旁腺、胃肠和骨骼组织组成,涉及的调节因子主要有PTH、维生素D、降钙素和PTHrP等(下表)。
血钙调节机制

高钙血症是上述调节机制紊乱的结果。一般包括两个方面,即恶性肿瘤分泌PTHrP,引起高钙血症,而血清PTHrP又使肾脏生成过多的cAMP,促进钙的重吸收。肿瘤转移至骨组织后,肿瘤细胞具有破骨细胞样活性,通过溶骨作用进一步升高血钙。
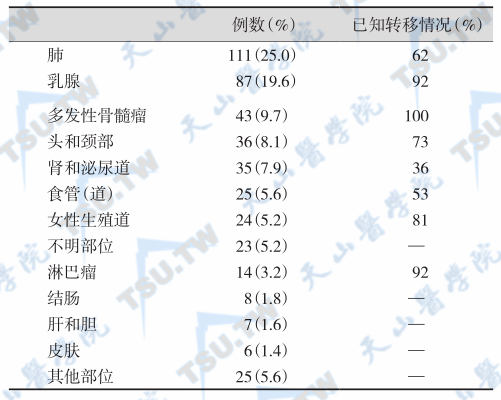
引起高钙血症的肿瘤以肺癌、乳腺癌和多发性骨髓瘤最常见(下表),3者约占肿瘤相关性高钙血症总数的50%,以肺癌引起高钙血症最多见,但几乎所有的小细胞肺癌从不引起高钙血症,约2/3肺癌患者出现高钙血症时已有骨转移;而其他实体癌多为鳞状细胞癌或肾癌。胃(肠)癌、前列腺癌、淋巴瘤和白血病极少引起高钙血症,但成人T细胞白血病可出现高钙血症。嗜铬细胞瘤也可以分泌PTHrP,从而引起高钙血症。
肿瘤相关性高钙血症的病因
PTHrP是恶性肿瘤相关性高钙血症的主要病因,包括甲状旁腺在内的许多正常组织分泌PTHrP,这些组织的PTHrP分泌是由细胞外液的Ca2+浓度决定的。PTHrP与PTH的1型受体结合,其氨基端1~34肽段可完全表达PTH的生物活性。当血钙升高而PTH水平正常时,提示高钙血症是由PTHrP所致的骨吸收增加引起的。绝大部分恶性肿瘤患者的骨吸收由体液因子诱发,而多发性骨髓瘤和大部分乳腺癌患者的高钙血症与局部溶骨性细胞因子有关。常见的体液因子是PTHrP,而1,25-(OH)2D在淋巴瘤患者高钙血症中起重要作用。
肿瘤分泌升高血钙的体液因子
肿瘤分泌升高血钙的体液因子主要有PTHrP、1,25-(OH)2D和前列腺素,偶见于PTH及其他细胞因子。肿瘤分泌PTHrP和骨浸润破坏是引起高钙血症的两个主要因素,PTHrP促进骨吸收而骨吸收过程中释放的生长因子又促进肿瘤增殖,形成肿瘤浸润与骨吸收之间的恶性循环。
PTHrP
异源性PTH分泌瘤内的PTH分子不裂解成N端及C端片段,故一般临床上使用针对C端部分的抗血清而建立的RIA法,其血浆PTH值较原发性甲状旁腺功能亢进时水平低。此外,异源性PTH分泌瘤与异源性CRH/ACTH分泌瘤相似,血中可能存在着不同程度的无活性的PTH原。PTHrP结构与PTH相似,两者结合的受体相同,故引起的生物反应相似。PTHrP通过促进骨吸收,增加肾脏对钙的重吸收,尿钙排泄减少而引起高钙血症;同时PTHrP增强肾小管抑制磷的重吸收作用,从而尿磷排泄增多,导致低磷血症。恶性肿瘤分泌PTHrP可能受钙受体的调节,钙受体激动剂可刺激正常或肿瘤细胞分泌PTHrP。
一、PTHrP功能
在生理情况下,PTHrP的主要功能是:①胎儿发育时,调节细胞增殖分化;②在成人中,作为调节皮肤、乳腺和毛囊等组织增殖分化的一种细胞因子。PTHrP对细胞分化主要起局部调节作用,仅部分是通过与PTH相同的受体结合,参与骨骼和肾脏钙、磷代谢的调节,故只有当肿瘤产生大量PTHrP时,PTHrP才进入血液循环,激活骨骼和肾脏中PTH/PTHrP受体而产生高钙血症。
PTHrP的N末端含PTH的同源序列,因此通过骨吸收和肾重吸收钙而引起高钙血症,但是PTHrP只促进破骨细胞的活性,对成骨细胞仅有微弱作用,而PTH可促进骨吸收和骨形成。PTHrP刺激生长板软骨细胞增殖,延长软骨骨化。在胎儿期,PTHrP由长骨骨端的软骨膜细胞(perichondrial cells)和软骨细胞分泌。破骨细胞和癌细胞是PTHrP的作用靶点,促进成骨细胞生成RANKL,进一步激活破骨细胞前身细胞和溶骨过程。溶骨时释放的IGF-1和TGF-β与肿瘤细胞上的受体结合,活化有丝分裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK),其后果是肿瘤细胞增殖,并释放PTHrP。
二、PTHrP引起高钙血症机制
大约80%的肿瘤相关性高钙血症患者的血PTHrP升高,一些神经内分泌肿瘤也可分泌其他的趋钙激素(如PTH和1,25-(OH)2D),引起高钙血症;淋巴浸润性疾病(lympho-proliferative disorders)增加1α-羟化酶活性,使1,25-(OH)2D的生成过多。血钙极度升高主要见于甲状旁腺癌和CIH。髓袢利尿剂仅在血容量正常情况下,才有促进钙排泄作用,因而补充血容量应该是治疗CIH高钙血症的首要步骤。肿瘤分泌的PTHrP主要通过以下两种机制引起高钙血症:①作为激素,对靶器官(骨骼和肾脏)起调节作用而致高钙血症;②直接激活骨转移灶附近的破骨细胞,引起局部溶骨性高钙血症。
根据肺癌和肾癌等无骨转移灶时也出现高钙血症,可提示肿瘤相关性高钙血症主要是由PTHrP的激素样作用引起的。目前伴PTHrP升高的高钙血症有两个方面问题互相矛盾,难以合理解释。第一,PTHrP的急性作用是刺激肾脏合成1,25-(OH)2D,但恶性肿瘤患者血中1,25-(OH)2D偏低[而原发性甲旁亢患者的血1,25-(OH)2D正常或升高]。可能由于恶性肿瘤患者的高钙水平抑制1,25-(OH)2D的生成,从而抵消了PTHrP的急性刺激作用。当静滴二磷酸盐治疗恶性肿瘤相关性高钙血症时,血钙下降后可观察到患者血1,25-(OH)2D迅速升高,这将在一定程度上对上述现象作出合理解释;第二,高水平的PTHrP使骨吸收增加而骨形成降低,表明骨形成与骨吸收作用之间失耦联(uncoupling),但原发性甲旁亢或持续静脉滴注PTHrP时,通常骨吸收和骨形成都明显增加;恶性肿瘤发生骨形成-骨吸收作用失耦联可能与患者身体虚弱、制动或肿瘤分泌的其他细胞因子抑制成骨细胞的活性有关。
1,25-(OH)2D
约半数伴高钙血症的淋巴瘤患者的1,25-(OH)2D水平呈不适当升高。在少数研究中发现,这些患者的淋巴组织在体外培养时能使25-(OH)D转换为1,25-(OH)2D。血钙正常的淋巴瘤患者通过25-(OH)D前体合成1,25-(OH)2D,导致血钙水平升高并抑制PTH生成。血钙正常的淋巴瘤患者对维生素D反应敏感性较高钙血症的淋巴瘤患者明显,淋巴瘤患者的高尿钙比高血钙更常见,这至少可部分抵消1,25-(OH)2D不适当增加的作用。结节病与此相似,肾脏外合成1,25-(OH)2D增加,导致高钙血症。
前列腺素和细胞因子
前列腺素可刺激破骨细胞的骨吸收并增加cAMP。伴高钙血症的非转移性肿瘤组织中有高浓度的前列腺素E,前列腺素E在体外刺激破骨细胞的骨吸收,给动物服前列腺素合成抑制剂可降低高钙血症和血清PTHrP,而注射前列腺素可以诱发高钙血症。破骨细胞活化因子、IL-1α、IL-1β、TGF-α、TGF-β、TNF-α、TNF-β、CSF和EGF等可由肿瘤细胞或转移的淋巴细胞、单核细胞和巨噬细胞产生。细胞因子通过以下几个机制刺激骨吸收作用:①活化破骨细胞;②刺激原始破骨细胞的增殖;③促进前列腺素E合成。通过前两种机制发挥作用的溶骨可称为局部溶骨性高钙血症。
RANKL以前称为破骨细胞分化因子(osteoclastic differentiation factor,ODF)。现已明确,ODF主要是由局部肿瘤细胞合成的或由细胞因子(如IL-1、IL-6、TNF-α和TNF-β等)诱导PTHrP分泌。
肿瘤分泌PTH或骨转移使血钙升高
多发性内分泌腺瘤可同时发生原发性甲旁亢和其他恶性肿瘤,当患者出现恶性肿瘤(尤其是小细胞肺癌)、高钙血症和血PTH升高应考虑异源性PTH综合征的诊断。虽然肿瘤骨转移可引起转移灶局部的溶骨增加导致高钙血症,但大多数肿瘤相关的高钙血症并不是由于骨转移引起的。例如,前列腺癌细胞分泌ET-1、成纤维细胞生长因子(FGFs)、骨形成蛋白(BMPs)、肾上腺髓质素(adrenomedullin,AM)和血小板衍生生长因子(platelet-derived growth factor,PDGF),肿瘤细胞也生成蛋白酶(主要是酸性磷酸酶,PSA),后者将PTHrP、TGF-β 和IGFs从其与结合蛋白结合的复合物中解离出来,生成具有刺激成骨细胞活性的片段,最终引起高钙血症(下图)。
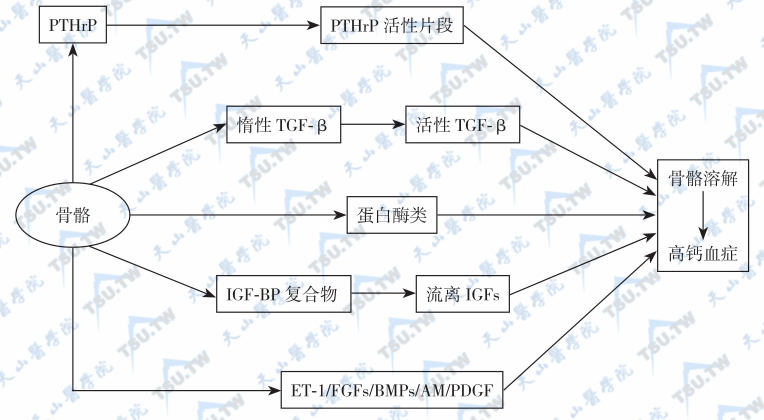
前列腺癌成骨性骨转移伴高钙血症的发病机制
注:前列腺癌细胞分泌ET-1、成纤维细胞生长因子(FGFs)、骨形成蛋白(BMPs)、肾上腺髓质素(adrenomedullin,AM)和血小板衍生生长因子(PDGF),肿瘤细胞也生成蛋白酶(主要是酸性磷酸酶,PSA),后者将PTHrP、TGF-β和IGFs从其与结合蛋白结合的复合物中解离出来,生成具有刺激成骨细胞活性的片段。
细胞膜上的钙受体(CaR)在抵御高钙血症中起了关键作用。但是肿瘤细胞的CaR功能常发生变异,对升高的细胞外液钙浓度失去抑制作用,引起PTHrP分泌而导致高钙血症。PTHrP作用于CaR,并在其他生成因子的协助下,产生溶骨作用和细胞因子释放,PTHrP还与成骨细胞上的1型PTH受体(PTHR1)结合,刺激NF-κB受体激活物(RANK)配体(RANKL),促进骨吸收。
