药物治疗要遵守下列基本原则:
- 不过分强调某一治疗措施而排斥另外的防治方法;
- 强调早期预防和早期治疗;
- 治疗方法、疗程选择应考虑疗效、费用和不良反应等因素,尤其要注意治疗终点(减少骨折发生率)评价,一般应包括椎体骨折、髋部骨折和外周骨骨折发生率;必须注意的是,观察降低非椎体骨折率的药物起效时间是椎体骨折的2倍或更长;
- 服药依从性(compliance)是决定疗效的重要因素,应尽量选择长效制剂(每周1次、每月1次、每半年1次或每年1次)。
具备以下情况之一者需给予药物治疗:
- 骨质疏松症(骨密度T值≤-2.5)患者(无论是否有过骨折);
- 骨量低下者(骨密度-2.5<T值≤-1.0)存在1项以上骨质疏松危险因素(无论是否有过骨折);
- 无骨密度测定条件时,具备以下情况之一者也需考虑药物治疗:已发生过脆性骨折、OSTA筛查为“高风险”、FRAX®工具计算出髋部骨折概率≥3%或任何重要骨质疏松性骨折发生概率≥20%。
骨质疏松治疗是一种长期的过程,特殊药物治疗的整体规划是:
- 首先选用一种抗骨吸收药物治疗,建议没有禁忌证者选择二膦酸盐类,因为其降低脊椎骨折的贡献率最高(下表),治疗PMOP药物的有效性见下表。一般认为,脆性骨折手术后或疼痛明显患者可首选降钙素;绝经后妇女可用选择性雌激素受体调节剂(SERM);
- 治疗2~3年后,采用骨密度、骨生化指标或其他影像检查评估疗效,如果疗效肯定而骨折风险仍较高,应继续治疗1~2个疗程,然后进行再评估,直至BMD达到正常范围;
- 如果疗效不满意或患者不能长期耐受,应改用另一种抗骨吸收药物,并加用骨合成促进剂,如PTH、锶盐等(即序贯治疗,sequential treatment);2~3年后评估疗效,必要时重复治疗;
- 不能耐受某种药物者应更换其他药物。
抗骨吸收药物降低脊椎骨折的贡献率
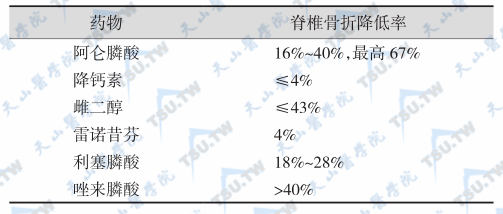
治疗PMOP药物的有效性
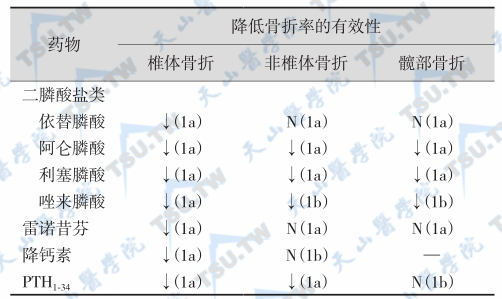
注:1a证据水平是指RCT研究资料的荟萃分析结论;1b证据水平是指RCT研究结论;↓代表降低;N代表无疗效(no effect)
二膦酸盐是应用广泛的抗骨吸收制剂
二膦酸盐(bisphosphonates)是目前最重要的一类抗骨吸收制剂。其结构与内源性骨代谢调节剂焦磷酸盐类似,它将易在酸性环境下水解或被焦磷酸酶破坏而失活的焦磷酸盐中的P-O-P键更换成P-C-P结构,故在体内性质稳定。该类化合物在低剂量时即可抑制骨吸收。60年代末,Fleisch等首先将其进行临床研究,最初用于治疗变形性骨炎(Paget骨病),继而用于治疗肿瘤相关性骨溶解和高钙血症。近年来开展了许多二膦酸盐防治骨质疏松的大规模、多中心临床试验,证明该药疗效确切。90年代以来,在已开发合成的30多种二膦酸盐中,已有10余种应用于临床,并成为防治各种代谢性骨病的主要药物之一。
名称和种类
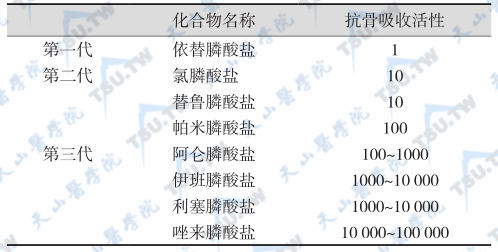
按化学结构,一般将二膦酸盐分为三代。在第一代二膦酸盐的结构中,侧链为直链取代基,代表药物有依替膦酸二钠或依替膦酸(etidronate,Eti);第二代二膦酸盐在其侧链中引入了氮原子,代表药物有替鲁膦酸(tiludronate,Til)、氯膦酸(clodronate,Clo)和帕米膦酸盐(pamidronate,Pam);第三代则具有环状侧链,代表药物有阿仑膦酸盐(alendronate,Ale)、利塞膦酸盐(risedronate,Ris)、伊班膦酸盐(ibandronate,Iba)和唑来膦酸盐(zoledronate,Zol)。
化学结构及构效关系
二膦酸盐中的P-C-P基本结构是该类药物活性的必要条件,其抑制骨吸收的强度取决于侧链R1和R2的类型,并与碳链的长度及链端结构有关。因此通过改变碳链的长度及与碳原子连接基团,可显著改变其理化性质和生物特性。在碳原子的1位引入羟基可增加活性,侧链链端引入末端氨基则活性加强(如帕米膦酸盐和阿仑膦酸盐);用烷基取代末端氨基活性进一步增强(如帕米膦酸二钠和伊班膦酸盐);如使侧链环化,又可增强活性。各种二膦酸盐抑制骨吸收的强度依次为:依替膦酸二钠<替鲁膦酸钠=氯膦酸二钠<帕米膦酸二钠<帕米膦酸二钠=阿仑膦酸钠<利塞膦酸钠=伊班膦酸钠<唑来膦酸钠。如果以第一代代表药物依替膦酸二钠活性为1计,那么新合成的第三代代表药物利塞膦酸盐活性则大于10 000。部分二膦酸盐的结构和抗骨吸收活性见下表。
部分二膦酸盐的抗骨吸收活性
药理机制
由于不同的二膦酸盐特性各异,药理机制可能不完全相同。该类药物的共同之处在于均能与骨组织中膦酸钙结合,继之抑制羟磷灰石结晶及其非结晶前体物质的形成、生长和吸收溶解,而且抑制其吸收比抑制其形成、生长所需要的量要低,即在低剂量时就足以发挥抗骨吸收作用。其抗骨吸收作用主要是通过直接作用于成熟型破骨细胞,干扰细胞内代谢并导致破骨细胞凋亡。此外,二膦酸盐也可能作用于成骨细胞,抑制后者产生刺激破骨细胞的细胞因子,起到间接抑制骨吸收作用。在体内,二膦酸盐可通过几种不同途径抑制破骨细胞介导的骨吸收。是一类与钙有高亲和力的人工合成化合物,各种二膦酸盐的分子结构及其差异见下图。
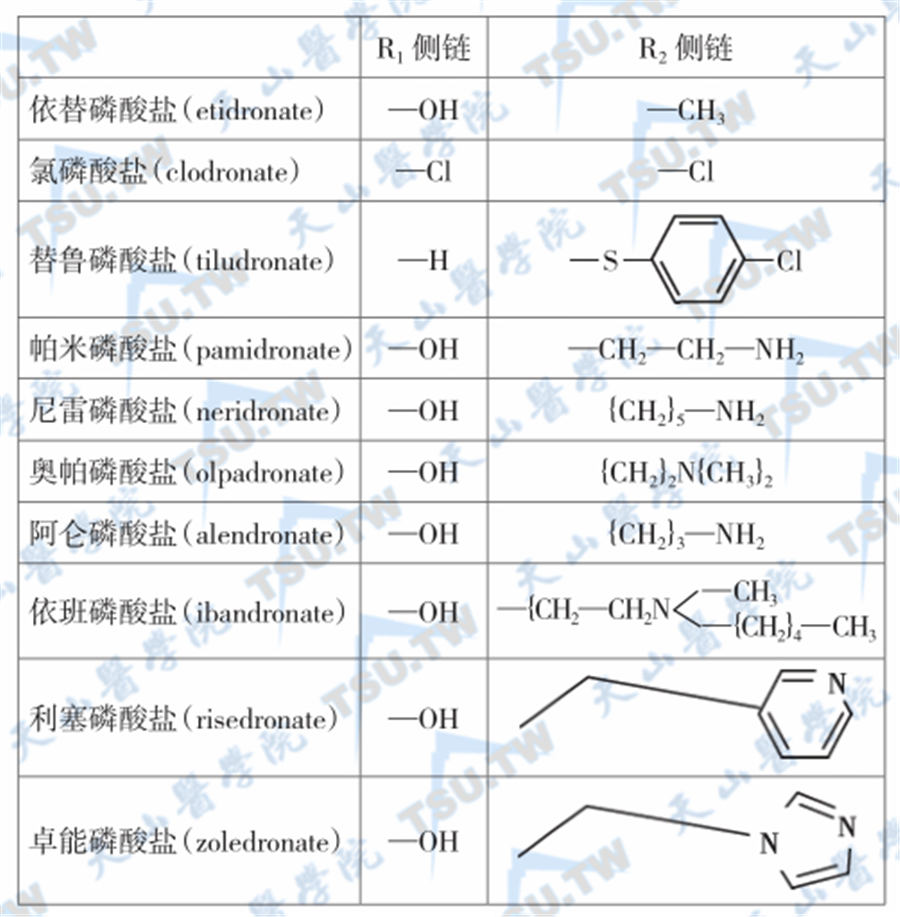
各种二磷酸盐的分子结构及其差异
一、对破骨细胞的作用
二膦酸盐对骨羟磷灰石具有高度亲和力,在骨重建部位,尤其是破骨细胞骨吸收处的浓度高,故推测该类药抑制骨吸收的可能途径是对破骨细胞的直接作用。clodronate、etidronate和pamidronate均可在体内、外引起破骨细胞的退行性变(如固缩、凝聚和细胞碎裂),提示二膦酸盐通过细胞毒效应直接损伤破骨细胞。etidronate、clodronate、pamidronate和risedronate在浓度≥10-7M时导致动物破骨细胞凋亡。alendronate可通过细胞表面整合素干扰破骨细胞与基质蛋白结合。
诱导破骨细胞凋亡将抑制骨吸收,但人破骨样细胞和鼠破骨细胞的体外研究显示,alendronate、pamidronate和etidronate抑制骨吸收的效应不伴破骨细胞数目减少,因此,二膦酸盐也可能引起破骨细胞其他生物学行为的变化而抑制骨吸收。例如,经二膦酸盐处理后的破骨细胞缺乏刷状缘(膜),因此骨吸收能力显著下降。
二膦酸盐还可破坏破骨细胞的细胞骨架并导致肌动蛋白环(actin ring)丧失,阻止骨吸收。由于骨吸收处的破骨细胞具有高度的代谢活性,因此抑制细胞代谢也可间接抑制骨吸收。但二膦酸盐亦可促进溶酶体酶释放,增强刷状缘内ATP依赖性质子泵活性,酸化微环境。
二、对破骨细胞前身细胞的作用
二膦酸盐作用于破骨细胞前身细胞,阻止破骨细胞生成,间接抑制骨吸收。Boonekemp等发现,pamidronate阻止破骨细胞前身细胞募集、分化或融合,但clodronate和etidronate则无此作用。因为pamidronate和其他含氮二膦酸盐不能阻止破骨细胞前身细胞增殖,亦不能抑制其迁徙至骨表面细胞融合处。Hughes等发现,一些二膦酸盐可阻止骨髓培养中的破骨样细胞生成。但体外不影响破骨细胞生成的二膦酸盐也可抑制骨吸收,提示还可能存在其他作用途径。
三、对成骨细胞的作用
二膦酸盐抑制成骨细胞因子释放。在体外用10-7M ibandronate或10-6M clodronate处理成骨样CRP10/30细胞,之后与破骨细胞共培养24小时,可抑制骨吸收,将破骨细胞与经二膦酸盐处理的成骨样细胞共培养也可获得类似效应,提示成骨细胞释放一种可溶性因子而抑制骨吸收。这些可溶性因子分子量小(<10kD),作用于破骨细胞前身细胞而阻止破骨细胞生成。同样,用二膦酸盐处理UMR106成骨样细胞和颅骨成骨细胞也可引起破骨细胞释放骨吸收抑制因子。
四、对巨噬细胞的作用
巨噬细胞对二膦酸盐的反应与破骨细胞类似。二膦酸盐可抑制巨噬细胞增殖、迁徙,缩短其寿命,导致细胞凋亡。pamidronate、alendronate还可引起巨噬细胞一过性急性期反应,刺激巨噬细胞释放IL-6、TNF-α。这可能是二膦酸盐能抑制关节炎性病变的机制之一。
五、对肿瘤细胞的作用
二膦酸盐已成为肿瘤性高钙血症和与肿瘤转移相关性溶骨性骨病的首选治疗。在骨转移性骨肿瘤动物模型中,二膦酸盐可抑制肿瘤病变,可能是抑制破骨细胞活性的间接后果,也可能与阻止肿瘤刺激生长因子的释放有关。pamidronate和incadronate可使体外人骨髓瘤细胞凋亡。二膦酸盐还可抑制乳腺癌细胞黏附,阻止肿瘤转移至骨骼。
六、二膦酸盐作用的分子靶位
二膦酸盐作用的分子靶位及其抑制骨吸收的精确机制仍未被证实。二膦酸盐可抑制破骨细胞的蛋白质合成和糖酵解、减少乳酸生成。alendronate可抑制蛋白酪氨酸磷酸酯酶(PTP),但对丝氨酸和苏氨酸磷酸酯酶无影响,tiludronate可抑制破骨细胞骨吸收,对破骨细胞质子泵活性亦有抑制作用。
结构与内源性焦磷酸更为接近的二膦酸盐(如clodronate、etidronate和tiludronate)在细胞内积聚,从而抑制破骨细胞功能和导致破骨细胞凋亡。更强效的含氮二膦酸盐(如pamidronate、alendronate、risedronate、zoledronate和ibandronate)作为类异戊二烯二膦酸类似物起作用,抑制FPP合酶和甲羟戊酸盐途径的其他酶系,阻止类异戊二烯化合物(FPP 和GGPP)的生物合成,引起破骨细胞活性丧失和凋亡。尽管二膦酸盐可分成药理上截然不同的两类,一类抑制蛋白prenylation,另一类被代谢成ATP类似物,可能在每一类中不同的二膦酸盐还有其他的作用机制,有待进一步研究。
药代动力学
二膦酸盐具有独特的药代动力学特征。由于它们的亲脂性弱,所以肠道吸收率低,生物利用度1%~10%,新一代的二膦酸盐(如alendronate)通常少于1%,当与食物尤其是含钙的食物一起摄入时,吸收率更低,因此,给药必须与进食分开。二膦酸盐至少应在早餐前30分钟摄入,咖啡和果汁能减少其吸收,应该用白开水送服。
二膦酸盐的P-C-P键可以完全抵抗酶的水解,alendronate、clodronate、etidronate、pamidronate、tiludronate的吸收、贮存和排泄均以原型形式进行,经吸收入血的二膦酸盐约有5%和血浆蛋白结合,在循环血中T1/2 15~60分钟,分布容积0.3~1.3L/kg。二膦酸盐自血浆中迅速清除,20%~80%在骨骼中沉积,其余部分自尿中排除。在骨骼中,二膦酸盐沉积于矿化部位,被嵌入骨骼中的二膦酸盐的半衰期很长,只有当它所沉积的骨骼被吸收时才被释放出来(一般需要数年甚至数十年)。因此,二膦酸盐在不同的动物种属中,因其不同的骨转换率,半衰期可长达1~10年。
由于二膦酸盐在体内不被代谢,吸收量的50%左右于24小时内以原形经尿排出。服药后24~48小时内可发挥抑制骨吸收作用。骨组织吸收期约1个月,骨形成期约3个月(约4个月为一骨重建周期),经3~4个月,骨吸收和骨形成间达到新的平衡。
适应证
二膦酸盐类药物主要用于治疗有明显骨吸收增强的疾病,最初临床用于治疗Paget骨病,目前仍是治疗该病的首选药物。近年来随着研究的不断深入,二膦酸盐类药物的临床应用范围逐渐扩大,某些新开发的品种也成为治疗肿瘤相关性骨溶解及高钙血症的首选药物,对于各种骨质疏松的疗效也得到了大量多中心临床研究的证实,其治疗适应证见下表。
二膦酸盐类药物治疗适应证

在治疗骨质疏松症方面,目前仅推荐此类药物用于高转换型骨质疏松症患者,尤其是老年性和绝经后骨质疏松有雌激素替代治疗禁忌证(如乳腺癌、子宫内膜癌)者,对男性骨质疏松症和儿童期发病的特发性骨质疏松症,可作为候选药物。同时,二膦酸盐类药物也为糖皮质激素性骨质疏松症的首选药物。各种二膦酸盐的剂型与最佳治疗对象见下表。
几种二膦酸盐的剂型与适应证
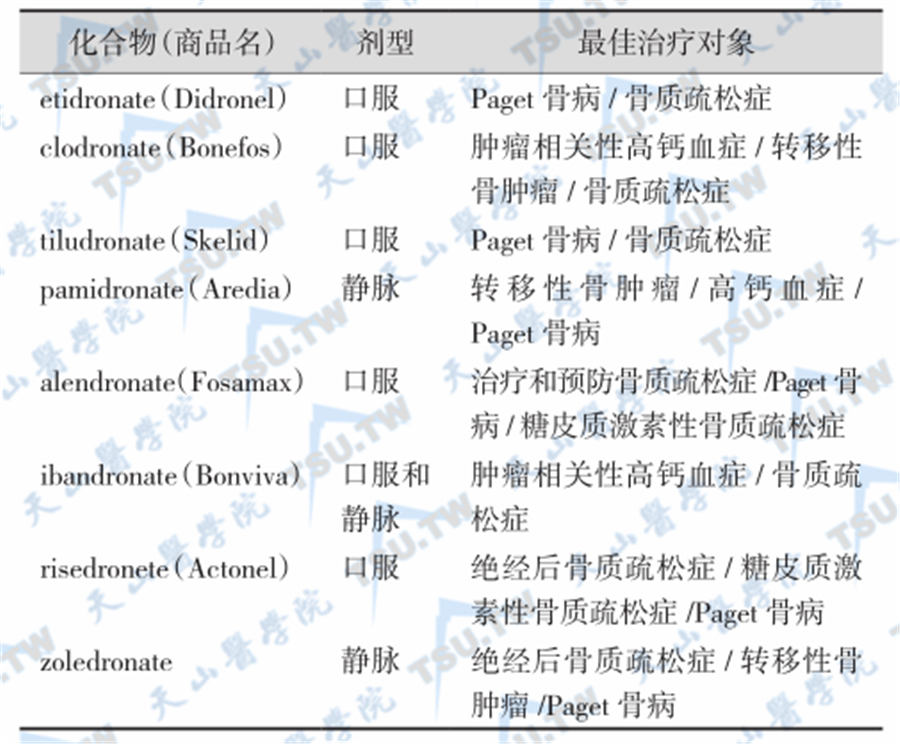
制剂和用量
见下表。目前已有十多种二膦酸盐制剂可供选用,但美国批准用于骨质疏松治疗的二膦酸盐类只有阿仑膦酸盐(alendronate)、伊班膦酸盐(ibandronate)、利塞膦酸盐(risedronate)和唑来膦酸盐(zoledronate)。目前,我国常用的有3种:①etidronate(Didronel,1-羟基乙磷酸钠,邦特林)400mg/d,于清晨空腹时口服,以200ml清水送服,服药后30分钟内不能平卧和进食,服药1小时后方可进餐或饮用含钙饮料。通常需隔月1个疗程,每个疗程2周。②帕米膦酸盐(pamidronate,Aredia,3-氨基-1羟基乙磷酸钠)注射液,用前用注射用水稀释成3mg/ml浓度后加入生理盐水中,缓慢静脉滴注,至少不得短于24小时,每月注射1次,可连用3次,此后改为每3个月注射1次或改为口服制剂。本药的用量要根据血钙和病情而定,一般每次用量20~90mg,两次给药的间隔时间不得少于1周。由于本药未被美国FDA批准,因此需要进一步观察和评价其疗效与安全性。③阿仑膦酸盐(alendronate,Fosamax,4-氨基-1羟丁基乙磷酸钠)常用量10mg/d,服药期间无需间歇;新的口服制剂(福善美)为每片70mg,每周1片;另一种阿仑膦酸盐制剂每片含阿仑膦酸盐70mg和VD 32 800U;服用该制剂者不需要加服VD。④新型二膦酸盐制剂有唑来膦酸、氯膦酸(clodronate)、英卡膦酸(incadronate)、伊班膦酸盐等可酌情选用。有些二膦酸盐可以每周或每年使用1次,明显提高了依从性,减少了不良反应,如伊班膦酸盐(ibandronate,IBN)口服剂型每月150mg和唑来膦酸盐(zoledroate,TIU)静脉注射每年5mg。
二膦酸盐类药物的使用剂量
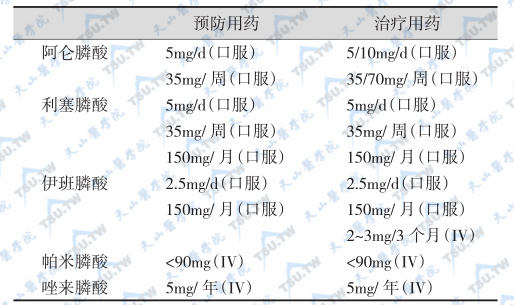
注:tiludronate含环状侧链,但一般认为属第二代二膦酸盐制剂(发现年代较早,其抗骨吸收活性与pamidronate和alendronate相似)。抗骨吸收活性以etidronate=1为基值。表中给出的剂量是绝经后骨质疏松症的推荐量,其他疾病应作相应的调整。美国FDA未批准pamidronate用于治疗绝经后骨质疏松症。
为了探索合适的用药时间,在FIT研究的基础上又进行了延长5年的临床观察(FIT long-term extension,FLEX),发现在停用alendronate后对骨的影响仍可保持数年,服药5年后停药并不出现骨折危险性增加。有椎体骨折史和BMD甚低的高危患者继续服药3~5年对降低骨折有益。一般认为,二膦酸盐的疗程应持续3~5年,且药物的依从性高,即服药率(medication possession ratios,MPR)≥80%。3~5年后进行再评估,如果骨折的风险解除或很低,一般可以考虑停药,如果骨折的风险仍然较高或发生了新骨折,则继续服药2~3年。
唑来膦酸的禁忌证包括:
- 输注唑来膦酸时,患者存在低钙血症;
- 患者对任何一种二膦酸盐过敏;
- 肌酐清除率<35ml/min;
- 妊娠和哺乳者;
- 正在应用其他二膦酸盐治疗者。
伊班膦酸盐已被SFDA批准的适应证为治疗绝经后骨质疏松症。临床研究证明,增加骨质疏松症患者腰椎和髋部骨密度、降低椎体及非椎体骨折风险。用法:静脉注射剂,每3个月1次,间断静脉输注伊班膦酸盐2mg,入250ml生理盐水,静脉点滴2小时以上。注意肾脏肌酐清除率<35ml/min的患者禁用或慎用。利塞膦酸钠已被SFDA批准的适应证为治疗绝经后骨质疏松症和糖皮质激素诱发的骨质疏松症。有些国家也批准治疗男性骨质疏松症。研究证明,增加骨质疏松症患者腰椎和髋部骨密度、降低发生椎体及非椎体骨折的风险。用法:口服片剂5mg,每日1次或片剂35mg,每周1次,服法同阿仑膦酸盐。注意胃及十二指肠溃疡、反流性食管炎者慎用。唑来膦酸注射液已被SFDA批准的适应证为绝经后骨质疏松症。临床研究证明,能增加骨质疏松症患者腰椎和髋部骨密度、降低发生椎体及非椎体骨折的风险。用法:静脉注射剂,唑来膦酸5mg加入250ml生理盐水,静脉滴注至少15分钟以上。每年用1次。肾脏肌酐清除率<35ml/ min的患者慎用。
疗效观察与治疗失败
二膦酸盐的疗效确切,目前没有发现“药物抵抗”现象,但是临床上的确存在无效或疗效很差的情况。一般原因是:
- 患者合并了VD缺乏症或其他继发性骨质疏松性疾病,使二膦酸盐的作用明显减弱;
- 判断疗效的方法一般用自身基础BMD作为标准;
- 药物制剂、剂量和用法不当;
- 患者属于正常或低的骨代谢转换类型,二膦酸盐需与促进骨合成药物联合应用才能取得较好疗效;
- 依从性差,没有坚持服药或服药不规范。
如果患者口服二膦酸盐的漏服次数在20%以下,一般认为其治疗依从性好,在此基础上可以评价药物的有效性。使用药物6~12个月后的BMD≥2%为有效,而低于基线BMD值或发生了新骨折则认为无效。
不良反应与禁忌证
对二膦酸盐过敏者禁忌使用。因缺乏足够的临床试验,二膦酸盐不适用于儿童和孕妇,也不宜在下列疾病患者中使用:①消化性溃疡与食管炎;②栓塞性病变者及出血倾向;③肾功能不全;④骨折急性期。
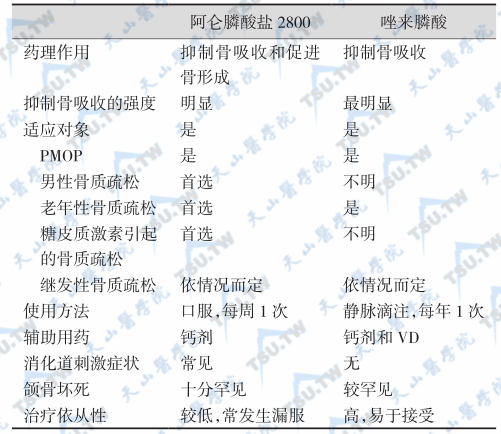
根据各种制剂的特点选用,严格遵照正确的用药方法(如阿仑膦酸盐应在早晨空腹时以200ml清水送服,进药后30分钟内避免平卧和进食)。有食管炎、活动性胃及十二指肠溃疡、反流性食管炎者慎用。目前临床应用的阿仑膦酸盐有10mg/片(每日1次)和70mg/片(每周1次)两种,后者服用更方便,对消化道刺激更小。每年使用1次的唑来膦酸(zoledronate)可进一步提高依从性。阿仑膦酸盐2800 (每片含阿仑膦酸盐70mg和VD3 2800U)和唑来膦酸盐(5mg)的适应对象和应用选择有一定区别(下表)。该类药物的主要不良反应在消化道,研究提示,食管黏膜细胞在5天内可更新,每周服药1次,7天的治疗周期可使食管黏膜有充足时间愈合。唑来膦酸盐静脉注射后数日内,可能出现一过性药物反应,如发热、肌肉疼痛、流感样症状、头痛、关节痛等不适,一般经对症处理后自然消退。从2011年9月1日FDA公布的唑来膦酸静脉注射制剂(商品名Reclast)安全性报告看,少数患者可发生严重肾损害,引起的急性肾衰甚至需要透析处理。因此,已有肾功能障碍(肌酐清除率<35ml/min)、失水、使用利尿剂和高龄患者禁用唑来膦酸。
阿仑膦酸盐和唑来膦酸盐的作用比较和应用建议
近年有应用含氮二膦酸盐(aminobisphosphate)出现下颌骨坏死(osteonecrosis of the jaw)的报道。一般发生率为0.001%,肿瘤患者为0.5%~4%。下颌骨坏死常见于恶性肿瘤化疗或发生于原有拔牙、口腔感染、牙周病、吸烟、糖尿病、慢性肾病病史的患者。
对于骨代谢转换率低下的患者来说,长期大量的二膦酸盐是否引起骨坏死或因骨的代谢进一步抑制而诱发骨折的问题值得关注。临床上要特别注意:
- 长期(>5~10年)二膦酸盐治疗可损害骨矿化,故一般主张第一代二膦酸盐间歇给药;
- 用药期间需补充钙剂;
- 消化道反应较多见,偶可发生浅表性消化性溃疡(发生率约1%~3%)或药物性肝炎;阿仑膦酸盐(alendronate)等对胃和食管的毒性作用类似于水杨酸类和非甾体类抗炎药物,但只要应用得当,此类药物并不改变胃肠黏膜的通透性。有食管憩室和食管裂孔疝等的患者忌用;
- 静脉注射可导致二膦酸盐-钙螯合物沉积,故血栓栓塞性疾病、肾功能不全者禁用;
- 已有颌骨病变或慢性牙科疾病者慎用,警惕颌骨或牙坏死可能;
- 治疗期间追踪疗效,并监测血钙、磷和骨吸收生化标志物;
- 骨折后至少2周内避免使用抗骨吸收药物,尤其是强作用的二膦酸盐类;
- 含氮二膦酸盐虽然抑制了骨吸收,但不能减少破骨细胞的数目或者甚至增加其数量,并延长其寿命,有时还能诱导巨大多核破骨细胞形成,这种细胞呈凋亡状态,没有黏附骨基质能力,应注意与骨巨细胞瘤或Paget骨病鉴别。
伴巨大破骨细胞代谢性骨病的鉴别

降钙素具有较好的止痛和抗骨质疏松效果
适应证和禁忌证
降钙素为骨吸收抑制剂,PROOF研究显示,虽提高椎体BMD有限(+1.2%),但能明显降低椎骨骨折率,骨活检显示有改善骨结构。降钙素主要适用于:①高转换型骨质疏松。②骨质疏松性疼痛:按WHO的VAS分级时,降钙素能使疼痛有所减轻,降钙素的急性止痛作用与下丘脑的网状结构的降钙素受体结合、升高内啡肽水平、抑制前列腺素分泌的中枢止痛效果有关,而慢性止痛作用主要与缓解骨丢失有关。止痛作用一般在应用降钙素的第2周出现(亦有更早出现者)。③变形性骨炎。④急性高钙血症或高钙血症危象。可单用降钙素,或与二膦酸盐、钙剂、VD等联合应用,但联合应用的效果是否优于单用有待进一步确定。慢性不明原因性高钙血症和低转换型PMOP不宜用降钙素盲目治疗。
制剂与剂量
主要有:①鲑鱼降钙素(salmon-calcitonin,密钙息,miacalcic)为人工合成的降钙素,抑制破骨细胞的活性为人或猪天然降钙素的20~40倍。每日皮下或肌内注射50~100U,有效后减量。如需长期使用,可每周注射两次,每次50~100U。②鳗鱼降钙素每周肌注两次,每次20U,或根据病情酌情增减。③鲑鱼降钙素鼻喷剂,100U/d,其疗效与注射剂相同。
注意事项
应用降钙素制剂前需补充数日钙剂和VD。有过敏史者慎用或禁用。降钙素可通过胎盘,孕妇禁用,以防止胎儿低钙血症和继发性甲旁亢。长期应用易发生“脱逸”现象,其原因未明。
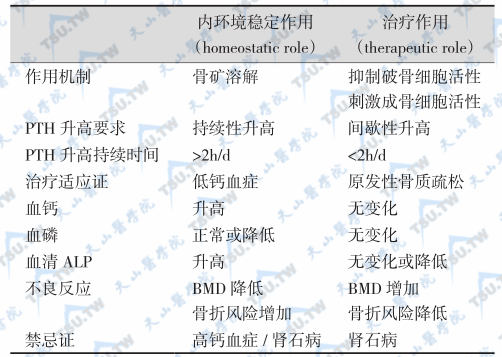
小剂量间歇性PTH促进骨形成并降低骨折风险
PTH不同的给药方法可引起完全不同的生物效应(下表)。持续性给药使血清PTH居于稳定的升高状态时,不但没有治疗骨质疏松作用,反而导致与高PTH血症相似的反应,即促进骨骼溶解,降低骨密度,增加骨折风险。相反,小剂量PTH可升高BMD,降低骨折率。对老年性骨质疏松、雌激素缺乏的年轻妇女、男性骨质疏松和糖皮质激素所致的骨质疏松也有治疗作用。PTH可单独应用或与雌激素、降钙素、二膦酸盐、VD联合使用。疗程6~24个月。间歇用药时,为防止皮质骨“偷盗”(总BMD增加,皮质骨BMD下降),必须加用其他药物(如二膦酸盐)。用PTH治疗21个月后,BMD升高,椎体骨折率明显降低(65%)。非椎体骨折率下降45%。临床实验表明,PTH对老年性骨质疏松、雌激素缺乏的年轻妇女、男性骨质疏松和糖皮质激素所致的骨质疏松有治疗作用。但是疗程短于2周时,很难获得骨量增加,而再加用降钙素也未观察到附加疗效;改用高剂量(PTH 800U/d,65μg/d)和较长疗程(28天)后,骨转换明显加快,腰椎BMD和股骨颈BMD增加。
不同给药方法引起的不同效应
新型PTH类似物SDZ PTS 893的化学稳定性更好,对骨的同化作用较hPTH1-34强25倍,对皮质骨的外膜和内膜尤强;PTH1-7的残基主要激活cAMP/PKA通路,而28~34位残基主要激活PKA通路。hPTH1-31NH2(ostabolin)是腺苷酸环化酶选择性PTH促效剂。改造PTH1-31NH2序列中的残基能防止椎骨松质骨的丢失,增加小梁骨容量和厚度,较hPTH1-31NH2更有效。若对PTH的长度再加修饰,如缩短PTH的片段为hPTH1-28NH2,仍能充分激活cAMP,改变其中某些残基后则作用更强,间歇注射(5nmol/d)具有明显的促成骨作用。
现有数种方案可供选择:①单用PTH(或活性PTH片段,如hPTH1-84、PTH1-31、PTH1-34、PTH1-36和PTH1-38等),400~800U/d,给药1周至1个月或数月;②PTH加用钙剂、雌激素等。治疗反应随剂量变化而变化:①注射PTH1-34后出现短暂的生化活性高峰,肾脏的磷酸盐最大重吸收率出现在6~8小时。②长期反应与剂量有关,注射500U/d,并加用雌激素4周后,尿钙、尿磷无变化,将PTH加至800U/d,血钙、ALP、前胶原羧基扩展肽、尿羟脯氨酸和尿钙均明显增加。③PTH1-34合并雌激素治疗1年,骨形成大于骨吸收,获得正钙平衡。④PTH与雌激素联合治疗6个月后,髂骨和脊椎骨的BMC增加,BMC在停药后可维持约1年。如改为雌、孕激素补充治疗。
但是,PTH治疗出现的反应与正常动物或人的药理学观察结果不尽一致,其原因未明。应用PTH制剂后,血浆中出现一种能与PTH结合的“结合物”,使PTH失效,甚至导致甲旁减,停药后又消失,其性质未明,是否属于一种抗PTH受体抗体物质有待进一步研究。
PTH与其他药物联合使用的指征、药物选择、疗程等均需进一步研究。患者对rhPTH治疗的总体耐受性较好,部分患者可能有头晕或下肢抽搐的不良反应。有动物研究报告,rhPTH可能增加骨肉瘤风险,因此对于合并Paget骨病、骨骼疾病放射治疗史、肿瘤骨转移及合并高钙血症的患者,应避免使用rhPTH。
锶盐促进骨形成并降低骨折风险
雷奈酸锶(strontium ranelate)由2个稳定锶原子和一个雷奈酸分子组成,锶盐促进VD合成和骨矿化并增加骨形成单位与BMD。2006年获得欧洲经济共同体国家批准治疗骨质疏松。雷奈酸锶为众多国际骨质疏松指南(亚洲、欧洲、澳大利亚、英国等)推荐的用药,2008年列入新版《中国骨质疏松骨折诊疗指南》。2g锶的绝对生物利用度为25%,3~5小时达峰,2周达稳态,半衰期60小时;通过肾、肠清除;本药可促进骨形成,改善骨微结构),长期耐受性佳,中度肝肾损害者无需调整剂量,但不推荐重度肾损害者使用。
不良反应为恶心和腹泻,但较轻且短暂。对近7000例患者5年的研究表明,不良反应总体发生率与安慰剂组明显差别。恶心和腹泻较轻且短暂。临床应用过程中发现极为罕见的超敏反应,一般于治疗开始后3~6周发病,表现为嗜酸性粒细胞增高和药物疹。出现此种情况必须立即停药并且不能再次使用本品。雷奈酸锶药物总体安全性良好,可作为绝经后骨质疏松患者的一线治疗药物。常见的不良反应包括恶心、腹泻、头痛、皮炎和湿疹,一般在治疗初始时发生,程度较轻,多为暂时性,可耐受。少数对该药发生超敏反应,临床上发现服药后出现皮疹的情况应尽快停药,密切观察。具有高静脉血栓风险的患者应慎用雷奈酸锶。
雌激素补充预防PMOP
雌激素缺乏是PMOP的首要病因;低雌激素状态或绝经后补充雌激素可预防或减少雌激素不足引起的骨量丢失,并能纠正与雌激素不足有关的其他健康问题,如更年期综合征等。因此,雌激素补充治疗(estrogen replacement treatment)是绝经后骨质疏松症的首选防治方案。由于雌激素在体内的作用部位广泛,故如何安全、有效和合理地使用ERT,使之发挥最大的有益作用是人们一直关注和研究的问题。
ERT作用机制
虽然雌激素作为骨吸收抑制因子,已在临床应用多年,但具体作用机制尚不完全清楚。具体概括起来有以下几种可能:
一、对钙调节激素的影响
雌激素可通过钙调节激素——降钙素、PTH和1,25-(OH)2D间接对骨骼起作用。雌激素既可促进降钙素的分泌,抑制骨吸收;又可降低PTH对血钙波动的反应性,抑制PTH的分泌,减少骨吸收;还可增强肝脏的25-羟化酶和肾脏的1α-羟化酶的活性,提高1,25-(OH)2D的水平,促进肠钙吸收。
二、雌激素受体调节作用
成骨细胞、破骨细胞及肠道、肾皮质上皮等可表达雌激素受体(ER)。ICI 182 780和他莫昔芬等可调节雌激素的受体功能。一般认为,雌激素通过ER对成骨细胞的增殖、分化、对机械应变的适应性应答及基质蛋白的合成有直接促进作用,而且成骨细胞上的ER表达与细胞周期有关,其主要功能是通过ER直接诱导破骨细胞凋亡、直接抑制破骨细胞的骨吸收活性和对其他组织细胞特别是产生细胞因子的细胞的作用,间接对绝经后的骨代谢产生影响。
三、细胞因子或生长因子介导作用
雌激素缺乏可大量产生多种细胞因子如IL-1、IL-6、TNF-α、M-CSF和GM-CSF等,这些细胞因子相互作用形成网络,使骨吸收增强。雌激素抑制造血干细胞、单核细胞和成骨细胞产生刺激破骨细胞增殖与分化、激活成熟破骨细胞和抑制破骨细胞凋亡的细胞因子,使加速的骨吸收过程被抑制。
雌激素促进成骨细胞合成和分泌OPG,有利于预防绝经后骨丢失;刺激成骨细胞分泌IGF-1和胰岛素样生成因子结合蛋白3(IGFBP-3),IGF-1是骨形成的强有力促进剂,促进胶原、骨连蛋白和骨桥素的合成,增加骨基质沉积率;减少胶原酶转录、加速胶原酶的降解,有利于维持骨中的胶原基质。雌激素在体内促进骨形成,增加骨量的作用中至少部分作用是通过影响这些生长因子的产生,促进骨形成来实现的。
四、对细胞凋亡的作用
雌激素对骨吸收的抑制作用至少部分通过诱导破骨细胞凋亡,缩短破骨细胞的寿命来介导。雌激素对成骨细胞和骨细胞凋亡的作用取决于细胞类型。既有刺激作用,也有抑制作用。
ERT方案和实施
一、ERT人群选择
应对骨质疏松高危人群(下表)进行BMD或骨生化指标测量。对于没有ERT禁忌证的绝经后妇女,应以ERT作为首选防治方案。
绝经后妇女骨质疏松危险因素

二、雌激素制剂与剂量
雌激素根据化学结构分为天然和合成两大类。天然雌激素主要包括雌二醇(estradiol,E2)、雌酮(estrone,E1)、雌三醇(estriol,E3)和结合雌激素(conjugated estrogen,CE)。天然雌激素的优点是对肝脏的代谢影响较弱,比较符合生理,易于监测血雌激素水平。其中E2的雌激素活性最强,是体内起主要作用的雌激素。E2在胃肠道很少吸收并易被灭活,故多采用经皮肤使用。微粒化17β-E2(micronized estradiol)后可在消化道迅速吸收。E1的雌激素活性弱于E2,纯E1目前不用ERT,但有四环素-雌酮用于预防去卵巢大鼠骨丢失的研究。E3为E2和E1的代谢产物,雌激素活性弱,经阴道使用可达较高的血浓度,如经阴道用0.5mg和口服8~12mg可获得相似的E3血浓度。CE是从孕马的尿里提取的混合物,45%为硫酸雌酮,55%为各种马雌激素,在体内代谢较复杂。合成雌激素主要有己烯雌酚(diethylstibestrol,DES)、炔雌醇 (17-ethinyl estradiol,EE)和乙炔雌三醇环戊醚(尼尔雌醇,维尼安)。DES是甾体类具有强雌激素活性的药物,一般不用于ERT。EE是避孕药的主要成分,对肝脏的代谢影响大,也不用于ERT。尼尔雌醇是雌三醇的衍生物,口服吸收后储存于脂肪,缓慢释放,为长效雌激素。
- 维尼安(Weinian):口服吸收后在体内脂肪组织内贮存,缓慢释放,能选择性地作用于阴道而对子宫内膜影响较小。每片1mg和5mg,为E3衍生物,口服1次5mg,1月1次,症状改善后维持量为1次1~2mg,1个月2次,每3个月加1次孕激素(P)(MPA 4.8mg/d,或妇康片2.5~5mg/d,用10~14天)。
- 盖福润(Zinci Glycerinum):为复合制剂,每粒胶囊含炔雌醇0.0025mg、甲睾酮0.625mg、磷酸氢钙112.5mg等21种有效成分。对缓解更年期症状效果好,对骨质疏松效果略差。每天2粒,3周为1疗程,疗程间停服1周。症状控制后或轻症者药量减半或遵医嘱。每3个月加1次孕激素(P),用法如前。
- 倍美力(Premarin):是天然合成型雌激素,用途较广,可用于功能失调性子宫出血、回奶、调经等。每片0.625mg,1次1片,服22天。保留子宫者后7~10天加用孕激素。
- 补佳乐(Progynova):每片含戊酸雌二醇1mg,为天然雌激素,副作用较小。适宜于雌激素治疗的一切适应证。每日1片,服22天,后7~10天加用孕激素。
- 利维爱(Livial):每片含7-甲异炔诺酮2.5mg(tibolone,ORG-OD14),是一种合成甾体激素,与其他甾体激素一样,可代谢成许多化合物,其中△4异构体,具有弱孕及雄激素作用,其他代谢产物3α-OH与3β-OH,具有弱雌激素作用,其雌激素活性只有炔雌醇的1/10~1/50。同时,其代谢产物强烈抑制雌酮向雌二醇转化,故无乳腺癌及子宫内膜癌发生的危险。
- 克龄蒙(Climen):为序贯用药,适用于围绝经期妇女。每天1片,服21天,前11天服用每片含戊酸雌二醇2mg,后10天服复方克龄蒙,每片含戊酸雌二醇2mg、孕酮1mg。
- 妇舒宁(Oesclim):是一经皮贴膜,使用简单,一般无副作用,个别局部有刺激作用。不保留子宫者用之较好。保留子宫者需加用孕激素。每周2次,即3~4天更换1次。用24~28天后停药2~7天,或每月使用12天。
- 诺更宁(Kliogest):为雌、孕激素联合制剂,每片含17β-E2 2mg和醋酸炔诺酮1mg。用于连续给药,使无月经周期,对子宫内膜安全性强,提供长期保护,每天1片,服用简便,适于绝经后妇女。
- 诺康律(Trisegeous):为雌、孕激素三相片,模拟自然的月经周期,适于绝经期妇女。12片蓝片,每片含E2 2mg;10片白片,每片含E2 2mg,醋酸炔诺酮1mg;6片红片,每片含E2 1mg。
ERT理想的剂量形式应当避免副作用、保留有效性、模拟绝经前雌激素浓度,提供正常E2∶E1比率(1∶1),提高依从性和满意度,由于内源性E2的半衰期<1小时,理想的方式是E2以恒定速率持续释放。为达到阻止骨丢失的最佳效果,血清E2水平大约是60pg/ml(滤泡早中期水平)。量-效关系研究表明,结合马雌激素(CEE)0.625mg/d、17β-E2 2mg/d、微粒化E2 0.5mg/d对减少绝经后妇女骨丢失是足够的;经皮E2 50μg/d似乎能降低脊柱和股骨颈骨丢失;尼尔雌醇(CEE3)每2周服药1次,1~2mg/次,能防止骨丢失。近年来也有研究表明,0.3mg/d的CEE或酯化E2就能预防骨丢失;微粒化E2 0.25mg/d和1.0mg/d对骨吸收指标降低的作用是相同的,因此提出目前所推荐的雌激素剂量,特别是对65岁妇女可能高出维持骨健康所需要的量,低剂量由于副作用少,易于接受且对子宫内膜刺激小,需要加用的孕激素剂量也减少。另外,很多临床观察发现,雌激素的有效剂量存在个体差异,因此ERT的新趋势是应用小剂量和个体化用药。
ERT开始时间
一般认为在绝经后5年内给予ERT治疗可获得较大益处。由于老年妇女骨折危险较大,所以只要ERT有在较年轻的妇女中相同的效能,她们仍能得到最大的短期益处。近来研究表明,ERT对65岁以上已有骨质疏松的妇女也是有效的,而且一些研究发现,雌激素对老年妇女骨量的作用较年轻的妇女更大,因此对这部分人仍不能放弃ERT。
ERT给药途径
目前临床上可利用的给药途径有口服给药、经皮肤给药、皮下埋植给药、阴道置药和鼻喷给药。但不同的给药途径各有其特征。
- 口服给药:为首选途径,简单、方便。为了补充肠壁失活和肝脏首过效应,必须投以较大剂量,以取得治疗的雌激素水平,这就导致E1水平较绝经前妇女高得多,也致投药间歇内雌激素水平波动较大,而且有促进胆结石形成、增加肾素底物和凝血因子、减少抗凝血因子和增加性激素结合球蛋白(SHBG)等危险。
- 经皮肤给药:非肠道给药避开了肝脏代谢和肝脏首过效应,药物直接吸收进入体循环,使血清E1、E2的浓度较口服稳定,还具有降低总胆固醇和降低低密度脂蛋白作用,但经皮给药仍可引起皮肤反应,依从性不能保证,而且吸收不稳定。对有症状的胆囊疾病兼高危患者,经皮给药途径更好。皮肤贴剂有estraderm、Oestrogel、system/evorel、Menorest、妇舒宁等。
- 皮下埋植:皮下埋植E2 25~50mg,埋植1次的有效维持时间4~6个月,提高了依从性,理论上可提供适量的E2,如果合用孕激素宫内节育器,还可能取消撤退性出血,而且费用相对便宜,但E2的量不能随意控制,个体之间血E2差异较大。
- 阴道置药:阴道黏膜血运好,阴道给药(阴道栓式霜剂)可使雌激素吸收入血,对泌尿生殖道的效果好,但用药不方便,药物吸收不稳定。
- 鼻喷给药(脉冲雌激素治疗,pulsed estrogen therapy):雌二醇鼻喷给药是一种脉冲雌激素治疗方式,目前此类制剂有Aerodiol,每天1喷,剂量300μg。由于避开了肝脏首过效应,对血脂有利,可降低脂蛋白[Lp(a)]、载脂蛋白(apoB)、总胆固醇(CHO)和低密度脂蛋白胆固醇(LDL-C),不影响凝血因子、血管紧张素原和胰岛素水平,是一种安全、有效和易被接受的ERT途径。
ERT配伍方式
一、单用雌激素
仅适用于子宫切除不需保护子宫内膜的妇女。主要为连续用药方式。应注意对子宫完整的妇女,即使周期性使用雌激素(如每周期30天,用雌激素25天,停药5天)也不能防止子宫内膜增生。
二、雌激素与孕激素合用
应用雌激素的有子宫的妇女应加用孕激素。孕激素在激素替代治疗中的作用主要是对抗子宫内膜增生,降低子宫内膜癌危险。目前以衍生于孕酮的甲羟孕酮(MPA)使用较多。孕激素的用量随雌激素用量而变化。可分为以下2种方式:①雌-孕激素序贯应用:模拟生理周期,在用雌激素的基础上每月加用孕激素10~14天,又分为周期性及连续性两种方案。周期性方案即每月停药4~7天:在每月的前25天,每日使用雌激素,孕激素通常加用在周期的第12~16天,25天之后雌-孕激素均停用,患者通常发生阴道出血。连续性方案:每日使用雌激素,在每月的第1~14天或每月最后的10~14天加用孕激素,正常撤退性出血通常发生在孕激素使用10天后,连续序贯方案便于患者使用。雌-孕激素序贯法阴道出血率高但较规律,适应于年龄较轻、绝经早期能够接受周期性阴道出血的妇女。②雌-孕激素连续联合应用:雌-孕激素每日联合使用,适应于年龄较大,不愿有周期性阴道出血的妇女,但在用药半年内常有难以预料的阴道出血。
三、单用孕激素
可周期性或连续性使用,前者适用于绝经过渡期,如每天用MPA 10mg,共用5~7天,如果阴道出血发生在停药后7~10天,说明患者体内雌激素水平不低,暂不需使用雌激素。月经不规律的患者每3个月使用孕激素1次,可防止子宫内膜增生及判断体内雌激素状态。
四、雌激素与雄激素合用
绝经后妇女体内绝对雄激素水平仅为青年期的50%;但椎骨骨质疏松的绝经后妇女与正常绝经后妇女相比,其雌激素浓度相似,而雄激素水平低于后者,可见雄激素在绝经后骨量的维持中有重要作用。临床研究表明,雄激素加入激素替代治疗可预防骨丢失和刺激骨形成,有利于骨质疏松的预防和治疗。而且由于女性性欲情绪中枢存在雄激素受体,雄激素还能增进性欲,改善情绪精神心理状态。但是雄激素降低高密度脂蛋白等的危险仍有待进一步研究。
利维爱(7-甲基异炔诺酮,Tibolone)是一种人工合成的激素,它在体内的代谢产物具有弱的孕-雌-雄激素作用。每日2.5mg能有效防治PMOP而且未发现对血脂明显的不良影响,无不规则阴道流血。利维爱对乳腺和子宫内膜无刺激作用,不具有通过ER拮抗雌激素的生物作用,它通过局部代谢和对性甾体类激素代谢酶的抑制而起作用,未观察到静脉血栓和心血管事件。
五、ERT与其他药物联合应用
ERT与钙剂、VD和二膦酸盐联合应用较单独使用更优越。
疗效监测
- 疗效监测:常用BMD测量来监测对ERT的效应,绝经后雌激素产生减少时,许多骨转换指标明显增加,超过基值(50%~100%),高的骨转换与较多的骨丢失相关联,当ERT执行时,如果有效,在3~6个月内这些指标下降,骨吸收指标的改变先于骨形成指标。
- 副作用监测:雌激素与子宫内膜癌、乳腺癌、血栓性疾病和胆囊疾病有关,其中雌激素使用者最关心的是子宫内膜癌和乳腺癌危险。在雌激素治疗期间应定期用B超监测子宫内膜,乳腺红外线和钼钯X线照相检查乳腺。
ERT禁忌证
一、绝对禁忌证:主要有妊娠、未明确诊断的异常生殖道出血、急性栓塞性静脉炎或血栓栓塞性疾病、已知或怀疑有雌激素依赖性肿瘤(乳腺癌或子宫内膜癌)、急性肝病、最近有过心肌梗死、脑血管意外和短暂性脑缺血发作等。
二、相对禁忌证:主要有慢性肝炎、胆囊炎、糖尿病、严重缺血性心脏病、高血压、偏头痛和癫痫。患有上述疾病者应慎用ERT。对于有子宫肌瘤、子宫内膜异位症的绝经后妇女可在GnRH激动剂的辅助下行ERT。
三、HERS/WHI研究 :1998年公布的心脏雌激素/孕酮补充研究(heart and estrogen/progestin replacement study,HERS)结果提示冠心病二级预防用ERT替代治疗应取慎重态度。2002年,美国内分泌学会紧急转发美国国家医科院(NIH)心脏、肺和血液研究所(NHLBI)声明:作为“妇女健康行动”(WHI)一部分的用雌激素加孕激素方案(CEE 0.625mg/ d加MPA 2.5mg/d)治疗绝经后妇女的试验,由于被试验妇女侵袭性乳腺癌发病率的增加(26%),超过该试验不良反应的极限,且总体统计已表明危险大于益处而宣布终止。这项随机、对照、多中心的临床试验涉及16 608名50~79岁妇女,原准备持续治疗8.5年,于2005年结束。经过5.2年随访决定终止。这项多中心的临床试验也同时发现与服安慰剂组相比,用雌激素加孕激素治疗组的结果是:
- 冠心病急性发作事件增加29%,有害比率(hazard ratio,HR)为1.29;
- 脑卒中增加41%,HR为1.41;
- 凝血事件发生率加倍,肺动脉栓塞HR为2.13;
- 结、直肠癌及骨折发生率减少,结肠癌HR为0.63,髋部骨折HR为0.66。综合指数HR为1.15。
绝对数字为:用雌激素加孕激素治疗的害处是可使每1万人每年增加7次冠心事件、8次脑卒中、8次肺动脉栓塞及8次侵袭性乳腺癌。其益处是减少6次结、直肠癌及5次髋部骨折。在评议WHI研究资料后,美国一独立顾问委员会(专门审查试验结果及被试验人员安全性的委员会)作出决定:该临床试验应予以终止。
选择性雌激素受体调节剂具有许多优点
SERMs是一类与雌激素受体(estrogen receptor,ER)相互作用产生组织特异性的化合物。其结构多样,与ER有高度亲和力,同时有ER激动和拮抗两种作用,其作用的差异及差异程度随药物、组织、种族及体内激素水平的不同而异。
ER的配基即雌激素类化合物,一般可分为三类:
- 完全的ER激动剂如17β-E2。在凡是有ER的组织如子宫、乳腺及骨组织等处均表现为ER的激动剂;
- 完全的ER拮抗剂如ICI 182 780。该物质也有甾体结构,在有ER的任何组织均表现为ER的拮抗剂;
- SERMs类,兼有ER激动剂和ER拮抗剂的混合功能,其功能有组织或细胞特异性。
即在一些组织或细胞表现为ER激动剂的功能,而在另一些组织或细胞表现为ER拮抗剂的功能。当体内激素水平改变时,其功能也可能发生改变,如他莫昔芬(tamoxifen,TAM)在乳腺表现为ER拮抗剂作用,但在子宫内膜表现为ER激动剂作用。当绝经后妇女雌激素水平低下时,TAM在骨组织表现为ER激动剂,有雌激素活性,抑制骨吸收致骨量增加;但在有生育力的妇女,服用该药期间骨量降低,在该状态下,TAM在骨组织表现为ER拮抗剂作用。
根据化学结构,SERMs有以下几类:
- 三苯乙烯类(triphenylethylenes),如氯米芬(clomiphene)、TAM及其衍生物、托瑞米芬(toremifene)、屈洛昔芬(droloxifene,DRL)和艾多昔芬(idoxifene);
- 色满类(chromans),如lerormeloxifene;
- 苯并噻吩类(benzothiophenes),如雷洛昔芬(raloxifene,RLX)和LY353381;
- 萘类(naphthalenes),如CP336 156。其中以TAM为代表的三苯乙烯类被认为是第一代SERMs,雷洛昔芬则是新研制成功的第二代SERMs,有其独特的选择性作用特性。
绝经后妇女服用雷洛昔芬60mg/d两年后,BMD在股骨增加1.2%,脊椎和髋骨增加1.6%,总骨质增加1.4%。SERMs 对BMD的增加不如ERT,但SERMs中的TAM和雷洛昔芬等可降低腰椎骨质疏松性骨折的危险。TAM对骨的保护作用在健康的绝经后妇女中也得到证实。在一项应用TAM预防乳腺癌的3年大规模研究中观察到,TAM可使腰椎BMD每年增加1.17%,而且髋骨则增加1.71%,且第1年增加显著,这与雌激素的作用在第1年最显著也完全相似。除此之外,TAM对前臂骨的远端也具有保护作用,虽然不如对腰椎明显,但可维持BMD不下降,与对照组比较差异有显著性,生化检查显示TAM可以显著降低绝经后妇女的血骨钙素和尿羟脯氨酸的水平,但值得注意的是TAM治疗可引起绝经前乳腺癌患者及健康妇女的骨丢失和BMD下降与TAM在绝经后妇女中的作用不同。
不同ER配基可在不同组织或细胞表现不同活性。现已发展多种SERMs并在临床应用,其中以长期以来作为乳腺癌治疗辅助用药的他莫昔芬为代表,其雌激素样活性可保存骨质,降低总胆固醇浓度,缺点是因刺激子宫内膜而使绝经后妇女子宫内膜癌发生率增加,故限制了其长期的使用。目前,除raloxifene外的SERMs基本都超不出TAM的优势范围,克服不了与TAM同样的缺点。对SERMs及其药物研究开发正在方兴未艾阶段,由于雌激素作用分子机制的阐明以及雌激素受体ERβ及其基因转录调节的发现,大大促进了对于SERMs及其临床应用的研究,尤其是SERMs对生殖系统、心血管系统及中枢神经系统的作用还有待研究。它们具有潜在的抗肿瘤作用,也对某些绝经后妇女的多种慢性病(包括绝经后骨质疏松等)有潜在的益处,对SERMs的深入研究将有助于开发理想的雌激素或雌激素/SERMs联合应用方案以获得对HRT的期望效果。
新型SERM的作用增强而不良反应进一步下降。例如,拉索昔芬(lasofoxifene)和巴多昔芬(bazedoxifene)为一种“纯”的SERM,该药对乳腺和子宫内膜完全无雌激素样作用,对骨的作用更强而不良反应更低。在将来的研究中,要首先解决SERM应用中的下列问题:①其他SERM是否有致癌作用;②进一步阐明SERM的作用机制和药理机制;③明确SERM治疗范围、效果、剂量和不良反应等。
植物雌激素预防PMOP
植物雌激素(phytoestrogen)来源于植物,其结构与雌激素相似。流行病学调查表明,亚洲人消费含植物雌激素丰富的传统膳食,患前列腺癌、乳腺癌、心血管疾病、骨质疏松等的危险率低于西方人群,日本、中国台湾、中国香港妇女发病率明显低于欧美妇女,这种差异部分与膳食摄入植物雌激素量不同有关,亚洲人消费金雀异黄素为20~80mg/d,而美国人估计为1~3mg/d。东方人的排泄物(尿、粪)中植物雌激素的含量较西方人高10~20倍,为东方人饮食结构中含有丰富的植物雌激素所致。
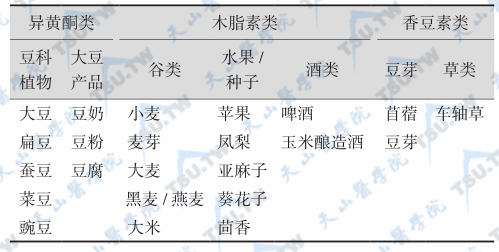
植物雌激素的化学结构与雌激素相似,主要包括三类化合物:异黄酮类(isoflavones)、香豆素类(coumarins)和木脂素类(lignans)。异黄酮类化合物主要有两种:金雀异黄素(genistein)和黄豆苷元(daidzein),它们在植物中以结合形式(如糖苷)存在,分别称为染料木苷(genistin)和大豆苷(daidzin),其前身分别为磨嘴豆素A和芒柄花黄素。异黄酮类化合物主要存在于豆类食物(如黄豆、磨嘴豆等)。香豆素类化合物(如香豆雌酚,coumestrol)主要存在于发芽植物(如豆芽中)。木脂素类化合物包括肠内酯(enterolactone)和肠二醇(enterodiol)两种,主要来源于豆类、水果和蔬菜;亚麻类食物中的木脂素类化合物含量尤为丰富。植物雌激素化合物及其来源见下表。由于异黄酮类化合物为植物雌激素主要组成成分,且人类大部分植物雌激素来源于大豆,故对异黄酮类化合物研究较多。另各种豆制品中植物雌激素含量与豆类加工过程和它们在特殊分类产品中的相对含量有关。如豆奶和豆粉中异黄酮类化合物含量较低,大部分大豆食物中的金雀异黄素含量为1~2mg/g蛋白。
植物雌激素分类和各自食物来源
结构
黄酮类化合物含黄酮核基本结构。有2个酚环,中间以吡啶杂环相连。金雀异黄素为4′-7二羟异黄酮,黄豆苷原为4′、5、7三羟异黄酮,黄豆黄素为7、4′二羟,6-甲氧异黄酮。
吸收与分布
在植物中,异黄酮类化合物以糖苷形式存在,其吸收和利用需要一系列的分解与结合反应。首先,糖苷形式的植物雌激素在肠道被糖苷酶作用,分解为游离型苷原被吸收,主要吸收部位为小肠,大肠亦能吸收一部分,吸收率为10%~40%。吸收后的异黄酮类化合物在肝脏与葡萄糖酸或硫酸结合,结合型产物可随胆汁再分泌到肠道,在肠道微生物的作用下产生苷原再吸收入血循环,形成肠肝循环。木脂素类化合物主要吸收部位为结肠,亦可形成肠肝循环反复吸收。它们的吸收和生物利用度受多种因素的影响。如性别、个体差异、肠道微生物效应、膳食成分等。高碳水化合物饮食刺激黄豆苷原分解为牛尿酚;膳食中纤维素影响金雀异黄素血、尿中浓度,而对黄豆苷原无影响。黄豆苷原和金雀异黄素的血浆半衰期约7.9小时,6~8小时达高峰浓度,根据这些数据可认为维持稳定植物雌激素血浆浓度应持续分次补充。
代谢和排泄
植物雌激素的代谢产物活性更高。金雀异黄素代谢为对乙基酚,而黄豆苷原代谢为牛尿酚、氧-去甲基安哥拉紫檀素。黄豆苷原、金雀异黄素、牛尿酚、氧-去甲基安哥拉紫檀素为人和动物体液中检测到的主要植物雌激素成分。木脂素类化合物代谢产物为肠内酯和肠二醇。大部分异黄酮化合物被肠道微生物降解和代谢,其代谢产物吸收入血后由尿液排出,亦可随胆汁从粪便排泄。尿排泄量为吸收量的7%~30%。木脂素化合物及代谢产物一部分通过肾排泄,另一部分随胆汁通过粪便排出,其在尿和胆汁中以糖苷酸结合形式存在,而在粪中为未结合形式。
药学机制
植物雌激素对阻止因雌激素缺乏所致骨丢失有一定效果。比较异黄酮类化合物代谢物牛尿酚与雌二醇结构,发现两者两端羟基的距离几乎相等,这奠定了异黄酮类化合物与雌激素受体结合的结构基础。木脂素类化合物与他莫昔芬结构相类似。植物雌激素具有微弱雌激素兴奋效应,与雌激素受体结合亲和力较雌二醇弱,异黄酮类化合物雌激素效应为雌二醇的1/1000,5mol/L金雀异黄酮与10-10~10-9mol/L的雌二醇活性相当,而传统东方饮食的日本人血浆植物雌激素浓度很高,为雌二醇血浆浓度的1000倍。植物雌激素同时具有雌激素样拮抗效应,可认为是一种选择性雌激素受体调节剂(SERM),植物雌激素在内源性雌激素浓度高时发挥雌激素拮抗效应,相反则表现为激动剂作用,但发挥何种作用取决于它们的浓度、作用的靶组织雌激素受体数目、受体亚型分布等。
依普黄酮(ipriflavone)为合成的异黄酮类化合物衍生物,其化学结构与黄豆苷原和金雀异黄素相似。依普黄酮为骨吸收抑制剂和骨形成增强剂。口服依普黄酮后迅速被吸收,吸收部位为小肠,进入循环后到达肝脏,大部分在肝脏被代谢,其代谢产物已证实的有7种,黄豆苷元为其中主要一种,约占10%。口服依普黄酮,半衰期为9小时,达峰值时间为2.5小时,峰值浓度为66.5ng/ml。研究表明,依普黄酮增强雌激素对骨保护作用,而无直接雌激素样作用,此外,依普黄酮还抑制骨吸收。体外试验表明依普黄酮及其代谢产物抑制骨吸收,主要通过抑制破骨前身细胞募集和分化,刺激甲状腺分泌降钙素、降钙素抑制破骨细胞骨吸收,促进钙盐沉积,抑制破骨细胞对PTH的反应。
毒副作用与禁忌证
流行病学调查认为正常水平植物雌激素摄入对人体无害,故无绝对禁忌证。一般剂量是安全的,膳食中补充的植物雌激素无明显毒副作用。但大剂量时可能出现如下副作用:①老年人认知能力可能下降;②在体外,可诱发细胞染色体变化;③对正在生长发育啮齿动物大脑发育有不利影响;④具有干扰内分泌平衡的潜在危险:如影响生育能力,动物试验表明大剂量摄入香豆雌醇导致长期排卵停止。另外植物雌激素可能对甲状腺素、胰岛素及胰高血糖素浓度有影响。
α-骨化醇和骨化三醇治疗骨质疏松症
适当剂量的活性VD能促进骨形成和矿化,并抑制骨吸收。研究表明,活性VD对增加骨密度有益,能增加老年人肌肉力量和平衡能力,降低跌倒危险,进而降低骨折风险。α-骨化醇口服0.5μg/d,骨化三醇口服0.25~0.5μg/d,治疗骨质疏松症时应用上述剂量的活性VD总体是安全的。长期应用应在医师指导下使用,并定期监测血钙和尿钙水平。在治疗骨质疏松症时,应与其他抗骨质疏松药物联合应用。
其他药物治疗骨质疏松症
正在研究的制剂很多,主要有以下几种:
一、BMP/活化素及其拮抗剂:BMP与其受体结合或与活化素受体样激酶-3/-6(activin receptor-like kinase-3,ALK-3,activin receptor-like kinase-6,ALK-6)结合后,刺激成骨细胞、软骨细胞成熟,但也同时诱导破骨细胞生成和促进骨丢失。活化素是BMP的一种相关蛋白,可促进FSH分泌,可溶性活化素Ⅱ受体与IgG-Fc融合后,可抑制骨吸收,增加骨形成,故可用于治疗骨质疏松症。
二、IGF-1:GH直接刺激骨转换,并通过对成骨细胞的作用增加骨内膜面的生长,增加肌量,促进肠钙吸收,间接增加骨量。IGF-1可使骨形成和骨吸收增加,提高骨的代谢转换率。促进成骨,维持骨量,尤其是皮质骨的完整性。
三、促合成激素类药物:可作为男性患者的辅助用药。女性缺乏雄激素同样导致骨质疏松,但由于雄激素的致雄性化作用而限制了使用。硫酸去氢表雄固酮(DHEAS)对PMOP是否有治疗意义未明。
四、钙受体拮抗剂:可促进内源性PTH分泌和骨形成,增加BMD。
五、组织蛋白酶K(cathepsin K)抑制剂:可降低骨吸收80%,选择性组织蛋白酶L多肽酸抑制剂可预防骨丢失。
六、Src酪氨酸激酶抑制剂:抑制骨吸收,有望成为治疗骨质疏松的新药。
七、RANKL拮抗剂和Wnt激动剂:体内存在可溶性Wnt信号抑制剂,骨髓瘤细胞产生大量的可溶性Wnt信号抑制剂,而Dikkopf-1(DKK-1)抑制成骨细胞活性。因而,iDDKK-1 mAb(BHQ880)能中和DKK-1,治疗多发性骨髓瘤,对骨质疏松也可能有一定疗效。Denosumab属于Wnt激动剂,有较好的抗骨质疏松作用。
八、骨硬化素抑制剂或骨硬化素中和抗体:骨硬化素促进骨吸收,抑制骨形成,因而抑制骨硬化素能促进骨形成,减少骨丢失。
九、维生素K:四烯甲萘醌是维生素K2的同型物,是γ-羧化酶的辅酶,在γ-羧基谷氨酸的形成过程中起着重要作用。γ-羧基谷氨酸是骨钙素发挥正常生理功能所必需的。动物试验和临床试验显示,四烯甲萘醌可以促进骨形成,并有一定抑制骨吸收的作用,但仍需要更多临床研究证实。四烯甲萘醌一般作为骨质疏松的辅助药物使用,成人口服15mg,1日3次,饭后服用(空腹服用时吸收较差,必须让患者饭后服用)。主要不良反应包括胃部不适、腹痛、皮肤瘙痒、水肿和转氨酶轻度升高。禁忌用于服用华法林的患者。
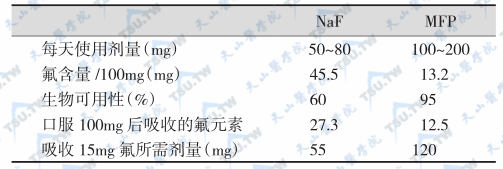
十、氟化物:能提高BMD。口服NaF后,30分钟达到血浓度峰值,吸收率达95%以上。单氟磷酸盐 (monofluorophosphate,MFP)为一种新型的氟制剂,氟化钠(NaF)和MFP的药动学特点及区别见下表。
NaF和MFP药动学特点
氟化物的作用机制未完全阐明,对骨组织的影响如下:①促进新骨形成;②增加BMC。老年性骨质疏松和PMOP为氟化物的适应证。应用本药后可明显提高BMD值。消化性溃疡、胃炎、妊娠期、骨折未愈、肾功能不全和骨质软化症患者禁用。目前用于临床的有氟化钠和一氟膦酸盐(特乐定),后者每片含一氟膦酸谷氨酰胺134mg、葡萄糖酸钙500mg、枸橼酸盐500mg,每日口服3次,每次1片。每片相当于含氟元素5mg和钙元素150mg。宜于进餐时嚼碎后吞服。长期应用氟化物虽可增加BMD,但骨的强度和骨的其他生物质量却下降,可能与氟化物结合到羟磷灰石结晶中有关。如果真有适应证,则应用小剂量,而且必须与其他骨吸收抑制剂联合应用。长期应用者要注意监测血氟、防止氟中毒。此外,还应注意如下几点:①避免钙和VD缺乏,同时补充钙剂和VD制剂。②血氟浓度维持在较低水平,以5~10μmol/L为宜。③尽量使用缓释制剂,或采用间歇疗法,避免发生高氟血症。④同时应用抗骨吸收药物(如ERT、SERM和二膦酸盐等)。⑤疗程不超过3~4年。⑥肾功能不全者应减量或禁用。⑦如血清ALP超过基础值50%,应减量或停用。
十一、中药:国内已有数种经SFDA批准的骨质疏松治疗中成药。多数有缓解症状、减轻骨痛的疗效。中药关于改善骨密度、降低骨折风险的大型临床研究尚缺乏,长期安全性需获得更规范、更严谨的证据。
联合用药提高疗效
抗骨质疏松药物的联合应用较为复杂,要考虑到药物间的相互影响,尚缺乏大样本、长时间的临床研究。目前已有的骨质疏松联合治疗方案大多以骨密度变化为终点,其对抗骨折疗效的影响尚有待进一步研究。总体来说,联合使用骨质疏松症治疗药物应评价潜在的不良反应和治疗获益,此外,应充分考虑药物经济学问题。联合应用方案有两种形式,即同时联合方案及序贯联合方案。
联合治疗方案
钙剂及VD作为骨质疏松症的基础药物,可以与骨吸收抑制剂或骨形成促进剂联合使用。通常情况下,对于骨吸收抑制剂及骨形成促进剂,不建议同时应用相同作用机制的药物治疗骨质疏松症。研究显示,同时应用双膦酸盐及甲状旁腺素制剂,不能取得加倍的疗效。
序贯联合方案
目前尚无明确证据表明各种抗骨质疏松药物序贯治疗(sequential therapy)的禁忌证。一般可根据个体情况,酌情选择骨形成促进剂和骨吸收抑制剂,能较好维持疗效,临床上是可行的。值得注意的是,应用序贯联合方案时,需要定期(一般为每年1次)评估疗效,以决定治疗的疗程和剂量。使用抗骨吸收药物治疗后仍发生骨折,或骨量继续下降,或骨代谢转化率明显升高,或对某些药物过敏时应考虑序贯治疗。特立帕肽(teriparatide,20μg/d)促进骨形成,主要适应于对二膦酸盐疗效不佳和骨代谢转换率较低的患者。
根据需要进行药物治疗转换
停用二膦酸盐,使用雷奈酸锶1年的患者,其骨微结构有明显改善,骨小梁由杆状变为板状,因而可作为药物治疗转换(treatment switch)的选择方案之一。药物治疗转换中,应特别注重各种骨质疏松治疗药物的不良反应(下表)。
骨质疏松治疗药物的不良反应
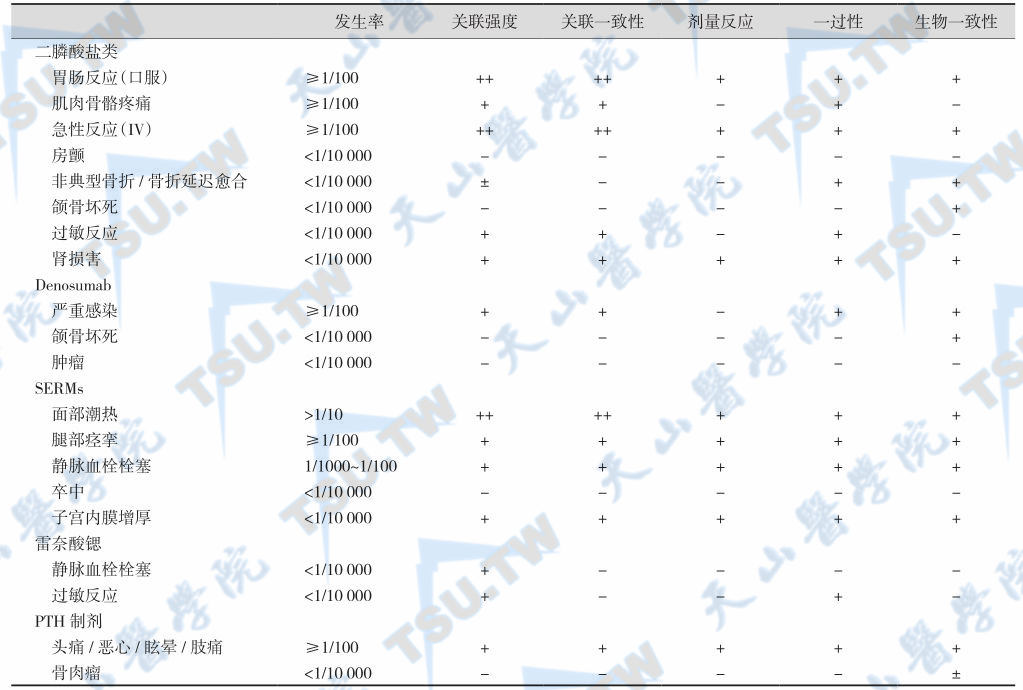
注:++:强烈证据;+:一般证据;±:证据不一致;-:无证据。
治疗依从性是决定疗效的重要因素
治疗过程中,应注意观察患者的依从性,良好的依从性有助于提高抗骨质疏松药物降低骨折的疗效。每6~12个月观察中轴骨骨密度变化有助于评价药物的疗效。在判断药效时,应充分考虑骨密度测量有意义的最小变化值(least significant change,LSC),评价和计算LSC可参考国际临床骨密度测量协会网站(www.ISCD.org)。注意外周双能X线骨密度测量(pDXA)和定量骨超声(QUS)等评价外周骨骼骨密度或骨质量方法不能反映脊柱及髋部对于药物治疗反应,因此不适于监测药物疗效。
骨转换生化指标可以在药物治疗后1~6个月发生明显变化,通过测量其变化可以了解骨吸收抑制剂或骨形成促进剂的作用效果,因此,骨转换生化指标常常被用作大样本临床研究的观察终点之一。有利于预测疗效、增加药物治疗依从性。但由于骨转换生化指标存在较大变异、不同测量方法间的结果也有差别,评价个体的疗效需要充分考虑骨密度最小有意义的变化值LSC,同时尽可能采用相同的采血时间和测量方法。
骨质疏松性骨折治疗应注重个体化原则
骨质疏松性骨折(osteoporotic fractures)亦称脆性骨折(fragile fractures)。目前尚无统一的定义和标准,通常是指由于轻微创伤(如站立高度或较低处跌倒)引起的骨折,所谓“轻微创伤”是指正常人可以耐受的低冲击性、低能量性外力作用。骨质疏松性骨折治疗的难点是:
- 高龄患者的整体状况差,并发症多;
- 骨折后康复能力低下,骨折愈合时间明显延长;
- 骨量和骨质量差,容易发生再次骨折或多发性骨折;
- 粉碎性骨折的处理困难,预后不良,常伴有骨折后骨不连接或骨坏死。
理想的骨折治疗是不加重局部损伤而整复骨折,骨折固定应尽可能不妨碍肢体活动。早期功能锻炼并配合药物治疗,使骨折愈合和功能恢复达到理想的程度。
骨折的整复和固定有手术和非手术两种方法,应根据骨折的具体部位、损伤程度和患者的全身状况决定,但无论选择哪种治疗方法都应以不影响骨折愈合为前提。对老年人骨折的整复和固定应以方法简便、安全、有效为原则。应选择创伤小、关节功能影响小,尽早恢复伤前生存质量为目的,在具体方法上不应强求骨折的解剖复位,而应着重于功能恢复和组织修复,降低死亡率,减少并发症及致残率。由于老年人骨折的自身修复能力降低,并存疾病较多,手术耐受性差,增加了手术治疗的风险。应权衡手术与非手术治疗利弊,作出合理选择。除了防治骨折局部并发症外,对高龄患者还需积极防治下肢深静脉血栓形成、脂肪栓塞综合征、坠积性肺炎、泌尿系感染和压疮等并发症。
脊柱骨折应根据病情合理选择手术或非手术治疗方法。由于胸腰段脊柱活动度大,又是脊柱应力集中的部位,应根据病情合理选择。有脊髓、神经根压迫和严重压缩性骨折时,考虑手术减压,并依据骨质量酌情选用内固定术,同时积极抗骨质疏松治疗。脊柱微创——经皮椎体成形术(vertebroplasty)和后凸成形术(kyphoplasty)适用于新鲜而不伴脊髓或神经根症状、疼痛严重的椎体压缩性骨折。
髋部骨折的治疗除骨折本身外,还应针对并发症和伴随疾病进行处理。可根据患者情况,对骨折采取手术治疗或非手术治疗。手术治疗包括内固定、人工关节置换和外固定器等。同时治疗骨质疏松。
老年人骨质疏松性桡尺骨远端骨折多为粉碎性骨折,且累及关节面,骨折愈合后易残留畸形,常造成腕关节和手指功能障碍。一般采用手法复位,可用夹板或石膏固定,或外固定器固定。对于少数不稳定的骨折可考虑手术处理。
外科治疗同时积极治疗骨质疏松,改善骨质量,防止再次发生骨折,但长骨骨折后至少2周内或1个月内慎用抗骨吸收药物。如为非急救手术,应在手术前加强营养,合理使用药物,提高BMD和骨质量。一般应针对病因和骨的代谢转换率状况,选用1~2种药物。但到手术前的1~2周内停用抗骨吸收药物,以防对破骨细胞的过度抑制而影响骨痂形成。骨质疏松患者骨科手术后,抗骨吸收药物治疗的意见不一,为慎重起见,可在手术后1个月后开始治疗。手术后的抗骨质疏松治疗应是综合性的,在使用药物的同时需特别重视运动和营养、钙剂和VD的补充。(廖二元)
