蛋白质代谢紊乱在恶液质(cachexia)发病中起着重要作用。与单纯饥饿所致体重丢失不同的是,恶液质主要表现为肌肉蛋白和脂肪组织消耗,瘦体组织下降,内脏蛋白丢失反而不明显。生理条件下,机体通过对蛋白合成和分解的平衡调节保证了肌肉块的稳定,而病理条件下,疾病本身或者宿主因素,能够改变正常的代谢调节过程。肌组织蛋白质丢失可以是蛋白合成减少、降解增加,或是两者兼而有之。作为生物体重要的“垃圾”清除系统之一,泛素-蛋白酶体系统(ubiquitin proteasome system,UPS)在恶液质状态下肌肉蛋白的分解过程中发挥重要作用。
生物体内存在三种主要蛋白降解系统:①自噬溶酶体系统,主要分解胞外蛋白和细胞膜受体;②钙依赖的降解系统,当发生组织损伤、坏死和自溶时被激活;③泛素-蛋白酶体系统,主要参与胞内蛋白清除,且降解过程需要消耗ATP。研究表明,泛素-蛋白酶体系统在包括肿瘤、饥饿、糖尿病、感染、糖皮质激素以及去神经支配等原因造成的肌肉消耗中起主要作用。
泛素分子和蛋白酶体是该系统的重要参与者。泛素(ubiquitin,Ub)是一个包含76个氨基酸残基的高度保守的多肽,分子量约为80kD,因其广泛存在于各类组织和细胞中而得名。泛素紧密结合形成小分子球蛋白,分子内含有一个疏水核心和大量氢键,稳定性好,保证了泛素循环的有序运行。泛素与其他蛋白的连接点位于通过折叠形成的突出C末端延伸部位的76位甘氨酸。泛素具有广泛的生物学功能,如细胞周期调控、细胞分化、细胞凋亡、胚胎形成、抗原呈递、炎症反应、DNA损伤修复以及信号传导等。泛素对靶蛋白的修饰至少有以下三种方式:底物蛋白与单个泛素分子结合,即单泛素化(mono-ubiquitination);底物蛋白同时与多个泛素分子结合,即多个泛素化(multiple monoubiquitination);单泛素化的底物还能进一步被多个泛素化和多泛素链化(polyubiquitination),即多个泛素分子首先形成泛素链,再与单泛素化底物特异性结合(图2-8-1)。
蛋白酶体存在于细胞核和细胞质中,泛素化修饰底物蛋白进入26S蛋白酶体而被降解。26S蛋白酶体由1个20S圆柱状蛋白酶催化中心和2个环状19S亚单位组成。其中20S蛋白酶包括4个重叠的环状结构,每个环含有7个多肽亚基。2个α亚基位于外侧,2个β亚基位于内侧,故通常把20S蛋白酶记为α7β7β7α7。催化中心位于β环上,而α则与底物识别相关。19S亚单位被称为帽状复合物,参与底物识别、转运和降解中心的暴露。
蛋白质被泛素-蛋白酶体系统降解需经过以下过程:①靶蛋白的泛素化;②靶蛋白的降解。三种重要的酶共同介导了靶蛋白泛素化过程:泛素活化酶(ubiquitin activating enzyme,E1)、泛素结合酶(ubiquitin conjugating enzyme,E2)和泛素连接酶(ubiquitin-protein ligase,E3)。E1水解ATP后与泛素分子C端形成硫酯键,然后E1将活化的泛素递交给E2,最后泛素在E3的募集作用下,从E2转移到靶蛋白上,或者靶蛋白首先与E3结合,泛素再转移过来。泛素化的靶蛋白最终进入26S蛋白酶体而被降解,而泛素分子则从泛素链中分离开来,从而实现重复利用。关于E1的作用机制及具体数目尚不明确,在人类组织中至少已发现了40多种E2及700多种E3。且E3具有高度的底物特异性,通过识别和结合特异的靶蛋白序列或降解决定子(degron),即N末端法则实现对靶蛋白的选择性降解。其中,两种肌组织特异性的泛素连接酶,即MAFbx/ Atrogin-1和MuRF-1与肌蛋白的降解密切相关。
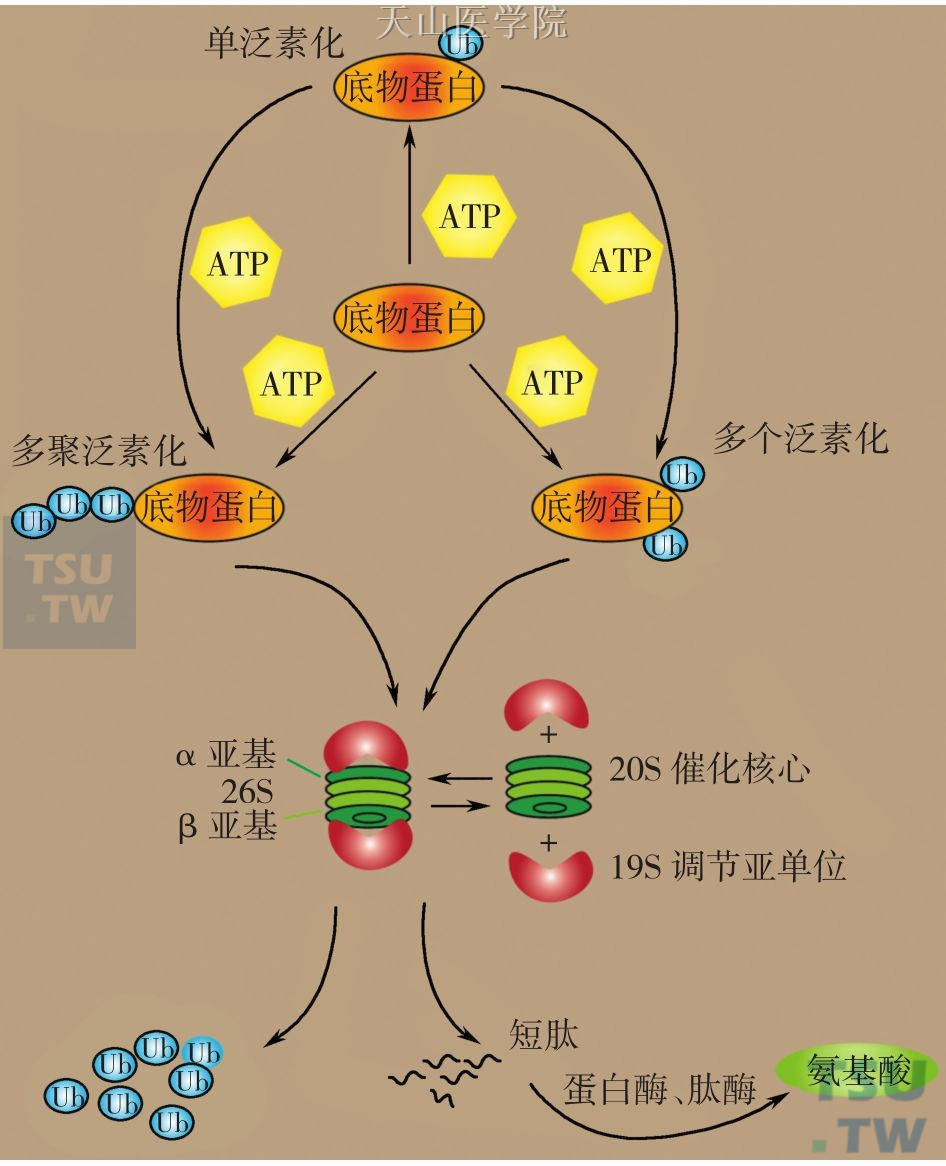
图2-8-1 靶蛋白泛素化修饰的方式
