蛋白质是生物体含量丰富、功能复杂、种类繁多的生物大分子,约占人体干重的45%。蛋白质是各种生命活动的物质基础。人体必须经常补充足够质和量的蛋白质才能维持正常的生理活动。常用于确定人体蛋白质需要量的方法为氮平衡法(nitrogen balance method),因蛋白质的元素组成特点是其含氮量较为恒定,多种混合蛋白质的含氮平均值约为16%。食物中的含氮物质绝大部分是蛋白质,非蛋白含氮物的含量很少,可以忽略不计。蛋白质经分解代谢所产生的含氮物质主要由尿、粪排出。所以,测定每天蛋白质氮的摄入量与尿及粪中排氮量,即可得出机体的氮平衡状况。
蛋白质降解:所有生命体的蛋白质都在不断更新。人体每日更新体内蛋白质总量的1%~2%,其中主要是肌肉蛋白质。70%~80%释放的氨基酸被重新利用、合成蛋白质,剩下的20%~25%被降解。体内各种组织蛋白的更新速度很不一致,它们的半寿期(half time t1/2为减少其浓度50%所需的时间)相差很悬殊,更新速度快的蛋白质,其半寿期仅为数秒钟或几小时(如肝细胞中的某些酶,尤其关键酶,如HMGCoA还原酶);以中等速度更新的蛋白质,它们的半寿期约在10天(如肝细胞中的大部分蛋白质、血浆中的多种蛋白质等);也有一些组织蛋白质的更新速率较慢,其半寿期常超过数月(如结缔组织中的胶原蛋白、核内的组蛋白等)。骨骼肌蛋白降解一般可分为三条蛋白质降解途径:溶酶体降解途径、钙激活降解途径和选择性泛素化-蛋白酶体降解途径。
非选择性溶酶体降解途径
此途径无需ATP的参与,故又称为非ATP依赖性蛋白质水解途径。细胞内溶酶体(lysosome)的主要功能是进行细胞内消化,可降解从细胞外摄入的蛋白质、细胞膜蛋白和胞内长寿蛋白质。溶酶体含有多种蛋白酶,包括半胱氨酸蛋白酶的组织蛋白酶(cathepsin)B、H和L,以及天冬氨酸蛋白酶的组织蛋白酶D。根据完成生理功能的不同阶段可将其分为初级溶酶体、次级溶酶体和残体。初级溶酶体由高尔基体分泌形成,含有多种水解酶原,只有当溶酶体破裂,或其他物质进入,酶才被激活。初级溶酶体内的水解酶包括蛋白酶(组织蛋白酶)、核酸酶、脂酶、磷酸酶、硫酸酯酶、磷脂酶类等60余种,这些酶均属于酸性水解酶,反应的最适pH为5左右。初级溶酶体膜有质子泵,将H+泵入溶酶体,使其pH降低。次级溶酶体是正在进行或完成消化作用的消化泡,内含水解酶和相应底物,异噬溶酶体(phagolysosome)消化外源的物质,自噬溶酶体(autophagolysosome)消化来自细胞本身的各种组分。残体又称后溶酶体(post-lysosome),已失去酶活性,仅留未消化的残渣。残体可通过外排作用排出细胞,也可能留在细胞内逐年增多。
钙激活降解途径
此途径包括钙激活蛋白酶Ⅰ和Ⅱ,主要涉及组织损伤、坏死和自噬等生理和病理过程。
选择性泛素化-蛋白酶体降解途径
此过程需有ATP参与,故此途径又被称为ATP依赖性蛋白质降解途径,这一途径中的蛋白水解酶类的最适pH为7.8,故又称碱性蛋白酶类,通过此途径降解的蛋白质为异常蛋白质(如氨基酸序列异常的蛋白质)、损伤(如被氧化)的正常蛋白质和细胞内短半寿期的蛋白质。该蛋白质降解途径往往与钙激活降解途径协调一起降解肌原纤维蛋白。主要降解过程概述如下:首先是泛素(ubiquitin)与被选择降解的蛋白质共价连接,然后是蛋白酶体(proteasome)识别被泛素标记的蛋白质并将其降解(图3-4-1)。泛素是一个由76个氨基酸残基组成的小肽,因其广泛存在于真核细胞而得名。泛素与底物蛋白质的共价连接是非特异性的,连接即底物蛋白质带上了泛素标记,称为泛素化(ubiquitination),泛素化是通过3个酶促反应而完成的。第一个反应是泛素C-末端的羧基与泛素激活酶(ubiquitin-activating enzyme,E1)的半胱氨酸通过硫酯键结合,这是一个需要ATP的反应,此反应将泛素分子激活。在第二个反应中,泛素分子被转移至泛素结合酶(ubiquitin-coniugating enzyme,E2)的巯基上。随后,由泛素蛋白连接酶(ubiquitinprotein ligase,E3)识别待降解蛋白质,并将活化的泛素转移至蛋白质的赖氨酸的ε-氨基,形成异肽键(isopeptide bond)。而此泛素分子中赖氨酸的ε-氨基又可被连接下一个泛素,如此重复反应,可连接多个泛素分子,形成泛素链(ubiquitin chain)。肌肉的E3包括(MAFbx)/Atrogin-1和MuRF-1。蛋白酶体是存在于细胞核和胞质内的ATP-依赖性蛋白酶,主要降解异常蛋白质和短寿蛋白质。蛋白酶体是一个26S的蛋白质复合体,由20S的核心颗粒(core particle,CP)和19S的调节颗粒(regulatory particle,RP)组成。CP是由2个α环和2个β环组成的圆柱体,2个α环分别位于圆柱体的上下两端,而2个β环则夹在2个α环之间。每个α环由7个α亚基组成,而β环由7个β亚基组成,CP中心形成一个空腔。CP是蛋白酶体的水解核心,活性位点位于2个β环上,β环7个β亚基中有3个亚基具有蛋白酶活性,可催化不同的蛋白质降解。2个19S的RP分别位于圆柱形核心颗粒的两端,形成空心圆柱的盖子,由18个亚基组成,其中某些亚基识别、结合待降解的泛素化蛋白,6个亚基具有ATP酶活性,与蛋白质的去折叠、使蛋白质定位在CP有关。当泛素化的蛋白质与调节颗粒的泛素识别位点结合后,调节颗粒底部的ATP酶水解ATP获取能量,使蛋白质去折叠,去折叠的蛋白质被转位至核心颗粒的中心腔,β亚基内表面的活性部位水解蛋白链的特异肽键,产生一些约由6~9个氨基酸残基组成的肽链。释放出的多肽被进一步被三肽基肽酶Ⅱ(tripeptidyl peptidase,TPPⅡ)和多种氨基肽酶降解为氨基酸(图3-4-1)。
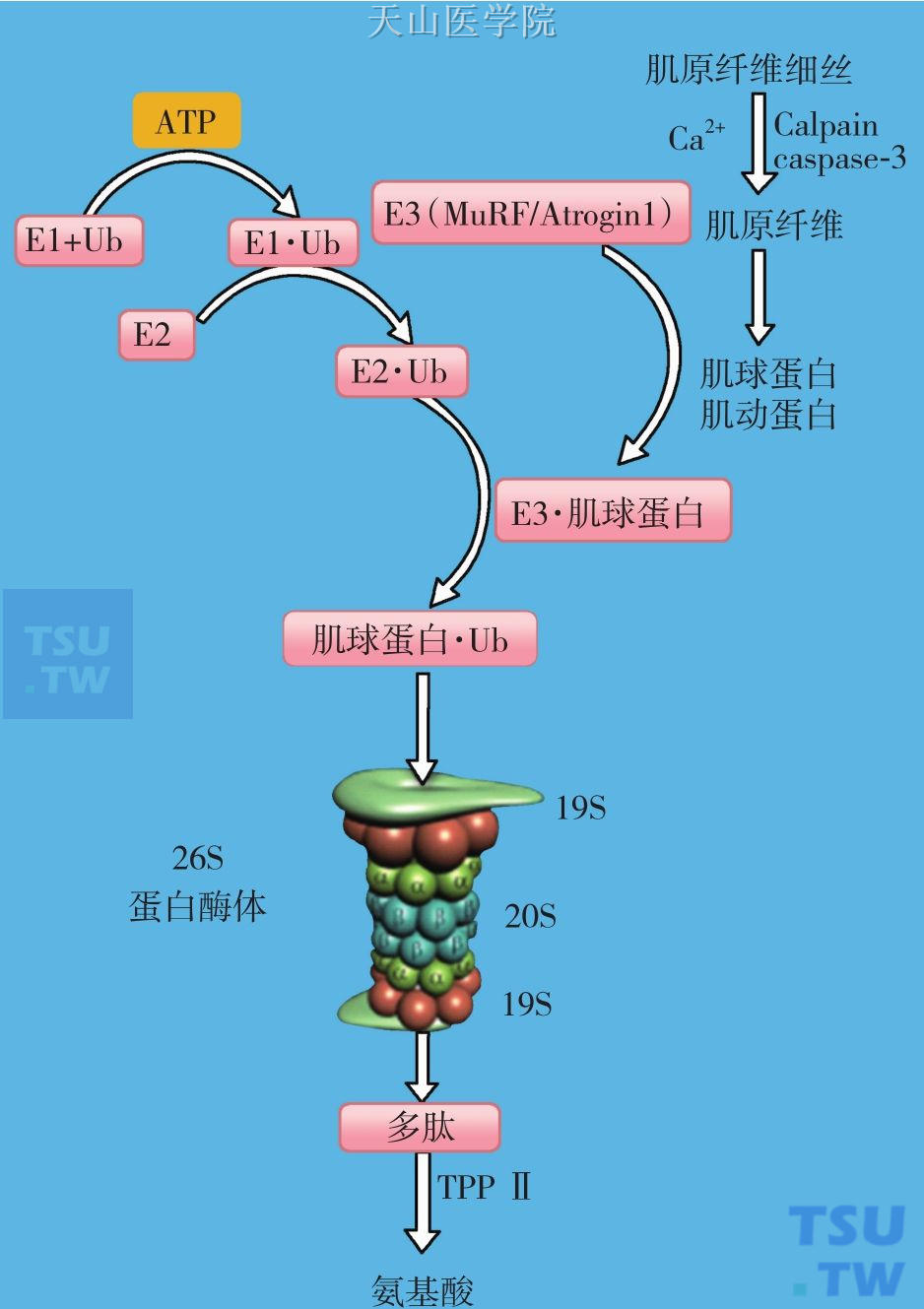
图3-4-1 泛素化-蛋白酶体的蛋白质降解;E1,泛素活化酶;E2,泛素携带蛋白;E3,泛素蛋白连接酶;Ub,泛素
