- 良性肿瘤
- 多形性腺瘤(pleomorphic adenoma)
- 肌上皮瘤(myoepithelioma,myoepithelial adenoma)
- 基底细胞腺瘤(basal cell adenoma)
- Warthin瘤(Warthin tumour)
- 嗜酸性腺瘤(oncocytoma,oncocytic adenoma)
- 管状腺瘤(canalicular adenoma)
- 皮脂腺瘤(sebaceous adenoma)
- 导管乳头状瘤(ductal papilloma)
- 囊腺瘤cystadenoma
- 恶性肿瘤
- 腺泡细胞癌(acinic cell carcinoma)
- 黏液表皮样癌(mucoepidermoid carcinoma)
- 腺样囊性癌(adenoid cystic carcinoma)
- 多形性低度恶性腺癌(polymorphous low grade adenocarcinoma)
- 上皮-肌上皮癌(epithelial-myoepithelial carcinoma)
- 非特异性透明细胞癌(clear cell carcinoma,not otherwise specified)
- 基底细胞腺癌(basal cell adenocarcinoma)
- 皮脂腺癌(sebaceous carcinoma)
- 乳头状囊腺癌(papillary cystadenocarcinoma)
- 低度恶性筛状囊腺癌(low-grade cribriform cystadenocarcinoma)
- 黏液腺癌(mucinous adenocarcinoma)
- 嗜酸细胞腺癌(oncocytic carcinoma)
- 唾液腺导管癌(salivary duct carcinoma)
- 腺癌(adenocarcinoma)
- 恶性肌上皮瘤(malignant myoepithelioma)
- 癌在多形性腺瘤中[carcinoma in pleomorphic adenoma(恶性混合瘤malignant mixed tumor)]
- 鳞状细胞癌(squamous cell carcinoma)
- 小细胞癌(small cell carcinoma)
- 分化癌(undifferentiated carcinoma)
- 成涎细胞瘤(sialoblastoma)
- 其他癌(other carcinoma)
由于半多能双储备细胞理论的广泛影响,多年以来,对唾液腺肿瘤形态发生的研究均建立在此基础上,形成了唾液腺肿瘤起源的储备细胞理论。20世纪80年代后期,以Dardick为首的一些学者提出了唾液腺肿瘤发生的多细胞理论,此学说认为,唾液腺内的所有细胞均有可能导致肿瘤的产生,唾液腺肿瘤形态的多变性并非是干细胞多向分化的结果,而是肿瘤细胞发生了不同分化所致。
储备细胞理论:早在20世纪70年代,Regezi和Batsakis就在半多能双储备细胞概念的基础上提出了唾液腺肿瘤起源的双细胞理论,认为唾液腺肿瘤来源于排泄管储备细胞和闰管储备细胞这两种未分化储备细胞。其中排泄管储备细胞与唾液腺的鳞状细胞癌、黏液表皮样癌、乳头状黏液腺癌有关,而闰管储备细胞与多形性腺瘤、肌上皮瘤、管状腺瘤、嗜酸细胞腺瘤、腺样囊性癌、腺泡细胞癌、腺癌有关。以后,随着研究的不断深入和一些新类型肿瘤的发现和命名,出现了大量有关唾液腺肿瘤组织和形态发生的报道。实验证明,上述某些观点并不正确,而且仅用双细胞理论来解释唾液腺肿瘤的组织发生是较为片面的。例如已有研究证实某些类型唾液腺肿瘤的发生与纹管等导管细胞的关系密切。持唾液腺中存在储备细胞观点的学者认为,不论是排泄管细胞、闰管细胞还是其他导管细胞,它们都是以储备细胞的形式存在于正常唾液腺中,当这些细胞发生肿瘤转化时,它们的不同分化导致了多种不同形态唾液腺肿瘤的形成。为了与后述的多细胞理论相区别,我们将此类学说归纳为储备细胞理论在此予以介绍。由于半多能双储备细胞理论的深远影响,唾液腺肿瘤发生的储备细胞理论目前仍得到许多学者的认同。
下面我们在储备细胞理论基础上对各类唾液腺上皮性肿瘤组织发生的认识逐一阐述。肿瘤分类根据WHO(2005)的唾液腺肿瘤分类。
良性肿瘤
多形性腺瘤(pleomorphic adenoma)
多形性腺瘤组织结构中上皮、肿瘤性肌上皮和黏液、软骨样结构混合存在。上皮、肌上皮构成导管、条索状、片状、蜂窝状结构,并常见鳞状化生。对多形性腺瘤组织来源的研究,一是探讨其黏液样及软骨样组织的组织发生,即它们是上皮来源还是间叶来源,二是对肿瘤中上皮组织来源的研究。
多形性腺瘤中除存在上皮成分外,还常见黏液样及软骨样组织。这些黏液软骨样组织在形态上与间叶组织颇为相似,故曾认为黏液软骨样组织来源于间叶组织,因而肿瘤并非来源于单个胚层,而是两个胚层的混合,所以多形性腺瘤也被称为混合瘤。以后,免疫组化标记和电镜观察发现,黏液软骨区的肿瘤细胞可不同程度地表达keratin、vimentin、actin、S-100、desmin、GFAP等,细胞内还可见张力丝、肌微丝等结构,这些特点与肌上皮细胞相似,提示黏液软骨区中的肿瘤细胞为肌上皮来源。对黏液软骨区的基质进行组织化学分析表明,它们主要由酸性黏多糖构成。电镜组织化学进一步证实,黏液区的物质与肿瘤性肌上皮细胞内的某些包含物相同,表明这些细胞外基质是肿瘤性肌上皮细胞的产物。以上研究结果表明,黏液及软骨区为肌上皮细胞来源,多形性腺瘤虽然在形态上具有异质性,但仍为纯上皮源性肿瘤。
早在60年代,就有学者开始对多形性腺瘤的起源细胞进行研究。Eversole(1971)曾猜测多形性腺瘤的起源与分泌管储备细胞有关,Regezi和Batsakis(1977)则认为闰管储备细胞是多形性腺瘤的起源。但是他们的观点在当时尚缺乏实验依据。以后,大量光镜、电镜、免疫组化、免疫荧光等研究发现,肿瘤细胞存在两种分化。一种细胞keratin、EMA阳性,可见细胞间连接,细胞内见张力丝,表现为导管细胞的特征;另一种细胞表达keratin、vimentin、actin、S-100、desmin、GFAP等,细胞内可见张力丝、肌微丝,与肌上皮细胞的特点相似。结果表明,肿瘤主要由肿瘤性导管细胞和肌上皮细胞构成,肌上皮细胞常位于导管细胞外周,或成片排列,并与黏液软骨区内的细胞相移行。由于肿瘤细胞存在导管上皮和肌上皮的双向分化,而闰管储备细胞具备这种双向分化的能力,故认为多形性腺瘤来源于闰管储备细胞。
肌上皮瘤(myoepithelioma,myoepithelial adenoma)
肿瘤较少见,由肌上皮构成,组织结构排列成实体型、黏液样和网状。肿瘤细胞可有四种类型:梭形细胞、浆细胞样细胞、上皮样细胞和透明细胞。在同一肿瘤中,常可见上述细胞混合存在。
电镜下见,浆细胞样和上皮样细胞胞质中可见肌微丝、中间丝,胞膜上可见密斑,上皮样细胞中还可见张力丝和细胞间桥粒连接。部分细胞内还可见分泌囊泡和胞吐现象。免疫组化标记显示肿瘤细胞中keratin、S-100α、S-100β呈程度不等的阳性。上述结果表明,肿瘤细胞兼具上皮细胞和平滑肌细胞的特征,其结构特点与位于导管腺泡单位中的肌上皮细胞有一定的相似性。由于储备细胞理论认为肌上皮细胞是由闰管细胞分化而来,故推测肿瘤来源于闰管储备细胞。
基底细胞腺瘤(basal cell adenoma)
早期基底细胞腺瘤和管状腺瘤一起被统称为单形性腺瘤,以后发现两者在发生部位、组织结构和细胞特点上均有所不同,因而被分列为两种肿瘤。
基底细胞腺瘤中,基底部的细胞排列整齐,其周围有清楚的基底膜样结构包绕,间质中无多形性腺瘤中的黏液样成分。肿瘤细胞有四种排列方式:实体型、小梁状、小管状和膜型。
免疫组化研究表明,所有肿瘤细胞keretin阳性,其中腔面细胞CEA、EMA阳性,部分肿瘤细胞S-100、GFAP阳性,提示肿瘤并不像其名称所示由单一的基底细胞构成,肿瘤中还存在肌上皮细胞,虽然在部分基底细胞腺瘤中,肌上皮的成分较少。由于肿瘤不是由单一细胞构成,故多认为此肿瘤来源于多潜能储备细胞。此外,最近俞光岩等报道,部分膜型基底细胞腺瘤来源于纹管基底细胞。但多数研究表明,基底细胞腺瘤的超微结构提示其来源于未分化干细胞,这些未分化干细胞以储备细胞的形式位于闰管。有时在同一肿瘤中,同时可见基底细胞腺瘤和腺样囊性癌的组织结构图像,提示两肿瘤有着共同的细胞来源。因而认为大部分基底细胞腺瘤来源于闰管储备细胞。
Warthin瘤(Warthin tumour)
也称腺淋巴瘤(adenolymphoma)、乳头状淋巴囊腺瘤(papillary cystadenoma lymphomatosum)。肿瘤细胞排列成腺样、囊状以及乳头囊状结构,内衬双层特征性的嗜酸性上皮细胞,间质为多少不等的淋巴组织,其中可有淋巴滤泡形成。
鉴于腺淋巴瘤中淋巴组织丰富,故推测肿瘤的发生与淋巴组织有一定的关系。大量分析表明,约有60%~86%的腺淋巴瘤的发生部位与淋巴结有关。由于此肿瘤最常见于腮腺区,故肿瘤常位于腮腺内、外淋巴结内。对肿瘤上皮的光镜、电镜及免疫组化研究发现,肿瘤细胞内含大量线粒体和溶酶体,并可见富含酪氨酸的晶体,氧化酶和酸性磷酸酶活性增高,提示其结构和功能与正常唾液腺的纹管细胞相似。此外,观察发现,腮腺内淋巴结内常可见残留的唾液腺上皮,并常伴不同类型的化生。故推测腺淋巴瘤来源于腮腺内、外淋巴结内的异位导管上皮,主要是纹管上皮细胞。腺淋巴瘤的形成经过了异位上皮增生、镜下可见的微腺瘤的形成、临床可见的肿瘤的形成这样几个阶段。但也有少数学者的免疫组化研究结果提示,排泄管也有可能参与了肿瘤的形成。
明确腺淋巴瘤中丰富的淋巴组织是原本就存在的,或是肿瘤形成后反应性增生的结果,对于提示肿瘤的组织发生有着重要的意义。大部分免疫组化研究结果显示,淋巴成分中以T淋巴细胞为主,伴有少量B淋巴细胞,且T、B的排列颇似正常淋巴结,提示这些淋巴结成分是原本就存在的。但也有实验表明,肿瘤中的淋巴成分是特异的细胞反应,含大量分泌IgA、IgE的浆细胞,表明肿瘤中出现了过度的免疫反应。此外,淋巴样组织中还存在大量的肥大细胞、组织细胞、巨噬细胞等,与炎症反应相似。这些都说明腺淋巴瘤中存在着淋巴组织的反应性增生。临床上确有一些腺淋巴瘤发生在原本淋巴组织很少的部位,如腭部。免疫组化标记表明,发生在淋巴组织较少部位的腺淋巴瘤,其丰富的淋巴成分可能是淋巴组织反应性增生的结果。
由此可见,目前认为,大部分腺淋巴瘤来源于淋巴结中的异位唾液腺上皮,其中与纹管上皮的关系最为密切。同时,部分肿瘤中丰富淋巴间质的形成与淋巴组织的反应性增生也有关,尤其是发生于原本淋巴组织较缺乏部位的肿瘤。
嗜酸性腺瘤(oncocytoma,oncocytic adenoma)
肿瘤少见,由界限清晰的嗜酸细胞构成,细胞形态和腺淋巴瘤中肿瘤上皮细胞形态相像,不同的是间质中无丰富的淋巴组织。细胞排列成实体型、小梁状和小管状,常同时存在亮细胞和暗细胞。
嗜酸性细胞的结构特点与腺淋巴瘤中肿瘤细胞的特点十分相似,细胞内含丰富的内质网和线粒体,以及富含酪氨酸的晶体,氧化酶和酸性磷酸酶活性增高,其结构特点与纹管细胞类似。免疫组化显示肿瘤细胞上皮性标记物keratin、EMA阳性,而肌上皮标记物S-100、actin、GFAP阴性,提示肿瘤来自导管细胞。
目前大部分学者认为,嗜酸性腺瘤来源于唾液腺导管细胞,且主要和纹管的关系较为密切。
管状腺瘤(canalicular adenoma)
同基底细胞腺瘤一样,管状腺瘤原来被称为单形性腺瘤。肿瘤由柱状或立方形上皮细胞构成,细胞双层排列,相互吻合成不规则小管状或小梁状。间质疏松,血管丰富而纤维较少。
由于肿瘤由内外两层细胞构成,故有学者认为其结构特征提示肿瘤来源于排泄管。但超微结构下见肿瘤细胞内内质网少,含中等量的线粒体,无分泌颗粒,与闰管细胞的结构相似。另有一些细胞内含多少不等的微丝,且局部密度增高,类似于不同分化程度的肌上皮细胞。免疫组化显示,肿瘤细胞keratin、vimentin、S-100阳性,提示肿瘤存在上皮和肌上皮的分化,故肿瘤来源于闰管储备细胞的可能性更大。
皮脂腺瘤(sebaceous adenoma)
肿瘤少见,皮脂样细胞排列成不规则巢状,肿瘤界限清楚,常呈囊性。
正常情况下,口腔黏膜和大唾液腺中常可见皮脂腺化生现象,前者如颊黏膜的Fordyce斑,后者如腮腺中闰管、纹管、小叶间导管的皮脂腺化生。由于正常唾液腺导管存在皮脂腺化生现象,故有学者推测皮脂腺瘤来源于唾液腺导管细胞。免疫组化标记显示皮脂腺瘤中肿瘤细胞keratin、EMA阳性,S-100、actin、NSE、vimentin阴性,电镜下见,肿瘤细胞内含粗面内质网、高尔基体及较多脂滴,部分腔面细胞见少量纤毛,细胞间可见桥粒,细胞未见肌上皮分化的特征。上述结果提示,肿瘤来源于唾液腺导管细胞。由于肿瘤中除皮脂腺样细胞外,同时可见导管和黏液细胞,表明肿瘤可能来源于可向皮脂腺细胞、导管细胞和黏液细胞分化的多潜能导管细胞。
当皮脂腺瘤间质中存在大量淋巴成分时,称皮脂淋巴腺瘤(sebaceous lymphadenoma)。由于肿瘤多位于腮腺区,常见于腮腺旁淋巴结内,故认为皮脂淋巴腺瘤的生成方式与腺淋巴瘤相似,可能来源于淋巴结内残留的异位皮脂腺。事实上也常见腺淋巴瘤、嗜酸性腺瘤、皮脂腺瘤的组织学图像相互重叠的现象。
导管乳头状瘤(ductal papilloma)
一般认为此类肿瘤均来自排泄管。
(1)内翻性导管乳头状瘤(inverted ductal papilloma):
肿瘤罕见但具有特征性,肿瘤的生长方式和细胞形态均与鼻腔和鼻窦的内翻性乳头状瘤相似。
肿瘤多见于小唾液腺,表现为黏膜下的肿块。电镜下见部分肿瘤细胞间有桥粒连接,细胞内见黏液样颗粒。免疫组化标记显示肿瘤细胞CK13、14强阳性,CK 7、8、18和5D3弱阳性。从部位上看常见肿瘤位于小唾液腺的排泄管中,这些都支持肿瘤来自排泄管。有学者认为肿瘤来自排泄管储备细胞。
(2)导管内乳头状瘤(intraductal papilloma):
肿瘤罕见,是小唾液腺排泄管的孤立性肿瘤。肿瘤由导管内的乳头状突起构成,突起中央有结缔组织轴心,轴心可扩张形成导管样或囊性间隙。
由于肿瘤存在于唾液腺导管内,常可造成导管阻塞。有报道腮腺导管内乳头状瘤伴腮腺囊肿,提示肿瘤导致腮腺导管阻塞,分泌物潴留,囊肿形成。组织学观察及免疫组化标记均显示肿瘤来自排泄管上皮细胞。此外,有学者发现部分肿瘤细胞有分泌潜能,提示肿瘤细胞有向腺泡细胞分化的特征。
(3)乳头状唾液腺瘤(sialadenoma papilliferum):
肿瘤主要见于腭部,外生性生长,有多个表面乳头,肿瘤的导管样结构可一直延续到表面口腔黏膜上皮。
肿瘤大部分由双层细胞构成导管样结构,免疫组化标记显示,腔面细胞CK19、S-100阳性,而基底部细胞因中间丝、微丝的表达不同分为两种亚型,一种亚型的基底细胞表现出肌上皮分化,呈CK14、S-100、GFAP、vimentin、smooth muscle actin阳性,另一种亚型的基底细胞仅CK13、CK14阳性,上述其他一些抗体均阴性。超微结构观察也证实,肿瘤细胞存在上皮、肌上皮的分化。虽然有学者提出乳头状唾液腺瘤来源于闰管细胞,但由于肿瘤常位于唾液腺小叶外且肿瘤性导管上皮常与表面黏膜上皮相连续,以及在邻近肿瘤的排泄管中有时也可见类似的肿瘤,这些都支持肿瘤来源于排泄管。也有学者研究发现,由于肿瘤细胞可同时表达多种中间丝,故认为肿瘤来源于唾液腺中可进行多向分化的导管细胞,例如小叶间导管等。我们的免疫组化分析表明,肿瘤中存在导管上皮、肌上皮的分化,结合HE染色下肿瘤细胞胞质的嗜酸性特征,提示肿瘤来源于类似于分泌管的导管细胞,这种细胞有向导管上皮和肌上皮分化的潜能。
囊腺瘤cystadenoma
(1)乳头状囊腺瘤(papillary cystadenoma):
肿瘤结构与腺淋巴瘤有些相似,肿瘤由多个囊腔构成,囊壁细胞1~2层,近腔面为高柱状细胞,形成不规则的乳头状突起突向囊腔,基底部细胞多角形,核较透亮。有时肿瘤中可见少量黏液细胞、嗜酸细胞或鳞状细胞。
乳头状囊腺瘤中的肿瘤上皮与腺淋巴瘤中的有所不同,前者的细胞形态较不规则,而后者为形态较一致的嗜酸性细胞。免疫组化标记显示,肿瘤腔面细胞keratin、EMA阳性,基底多角形细胞muscle specific actin阳性,腔面和基底细胞有不同程度的S-100蛋白表达,提示肿瘤上皮与排泄管上皮相似,故认为肿瘤来源于唾液腺大导管。虽然通常认为乳头状囊腺瘤与腺淋巴瘤的主要区别之一在于前者无大量的淋巴间质,但有学者报道部分乳头状囊腺瘤间质中也可有较为丰富的淋巴成分。
(2)黏液囊腺瘤(mucinous cystadenoma):
肿瘤界限清楚,由衬以产黏液细胞或杯状细胞的囊腔构成,细胞无异形,无浸润性生长。
由于对唾液腺黏液囊腺瘤的报道很少,其组织发生尚不明了。
恶性肿瘤
腺泡细胞癌(acinic cell carcinoma)
腺泡细胞癌的组织结构形式多样,可表现为实体型、微囊型、乳头-囊状型和滤泡型,其细胞形态可呈腺泡状、闰管样、空泡状和非特异性腺样细胞。
20世纪60年代末,有学者观察了腺泡细胞癌的组织学及超微结构后提出,肿瘤细胞含有与正常浆液性腺泡细胞相似的分泌颗粒,故认为肿瘤来自腺泡细胞。虽然目前仍有学者认为部分腺泡细胞癌可能由单一的腺泡细胞构成(见后述多细胞理论),但在20世纪60年代后期就已发现肿瘤中除腺泡细胞外,还可见导管样细胞,且导管样细胞的结构与多潜能的闰管细胞极为相似。至20世纪70年代,Regezi和Batsakis对腺泡细胞癌进行超微结构观察后发现,腺泡细胞癌的结构特点和腺泡细胞或闰管细胞相似,由于闰管储备细胞可分化为这两种细胞,并且从组织结构上看,腺泡细胞癌是位于唾液腺末端的肿瘤,故肿瘤来源于属唾液腺终末导管(terminal tubules)的闰管储备细胞或干细胞。
至20世纪80年代,人们发现在培养的腺泡细胞肿瘤及人腺泡细胞癌组织中均存在四种细胞。超微结构观察人的腺泡细胞癌,肿瘤由下述四种类型细胞组成:分泌细胞(数量最多)、闰管细胞、多潜能储备/干细胞以及肌上皮细胞,其中的肌上皮成分比多形性腺瘤和腺样囊性癌中要少得多。肿瘤中还存在着多潜能储备/干细胞和分泌细胞、闰管细胞间的转化,提示肿瘤来源于多潜能储备/干细胞,因此认为腺泡细胞癌的形成是由于多潜能储备/干细胞增生并主要向分泌细胞分化的结果。对肿瘤中分泌产物的分析也表明,肿瘤来自导管干细胞。由于闰管储备细胞具备多潜能储备/干细胞的特性,因而实际上表明腺泡细胞癌来源于闰管储备细胞。
黏液表皮样癌(mucoepidermoid carcinoma)
光镜下,黏液表皮样癌主要由三种细胞构成,即黏液细胞、表皮样细胞和中间细胞,三种细胞的不同比例导致了肿瘤的不同组织学形态。
由于唾液腺大导管尤其是排泄管常见鳞状化生和黏液化生,且在邻近黏液表皮样癌的唾液腺导管中也常见上述化生现象,故最初人们认为此肿瘤来源于排泄管基底储备细胞。光镜和电镜观察证实,肿瘤细胞与排泄管细胞在结构上有一定的相似性,其中的中间细胞是导管基底细胞与表皮样细胞之间的过渡形式。以后,对肿瘤中keratin、vimentin、muscle-specific actin的免疫组化研究证实,肿瘤细胞特点与正常唾液腺的排泄管相似,三类细胞可能都来源于排泄管基底细胞,但中间细胞的分化过程与表皮样细胞相似,而与黏液细胞不同。
后来也有学者进行超微结构观察发现,部分肿瘤细胞中见黏液分泌颗粒、糖原、核糖体、线粒体,认为肿瘤细胞与闰管细胞的结构较为相似,故提出肿瘤的组织来源和闰管储备细胞有关,甚至认为肿瘤来自于闰管储备细胞,而不是排泄管储备细胞。
荧光显微镜、免疫组化和超微结构观察进一步发现,部分肿瘤细胞的特点类似于肌上皮细胞,光镜下所见的中间细胞实际上是导管细胞和肌上皮细胞的混合细胞,提示肌上皮细胞也参与了肿瘤的形成。
Chaudhry等(1989)对肿瘤进行超微结构观察发现,肿瘤主要由6种类型细胞构成:未分化(立方形)干细胞、中间(柱状)细胞、浆液/黏液分泌细胞、产黏液杯状细胞、鳞状/表皮样细胞、肌上皮细胞。他们提出了黏液表皮样癌组织发生的双储备细胞理论,认为未分化干细胞作为多潜能储备细胞导致肿瘤内各种形态细胞的出现。其中腺泡-闰管储备细胞分化为肿瘤内浆液/黏液细胞和肌上皮细胞,而纹管-排泄管储备细胞分化为肌上皮细胞、中间(柱状)细胞、鳞状/表皮样细胞和产黏液杯状细胞,如图5-7所示:
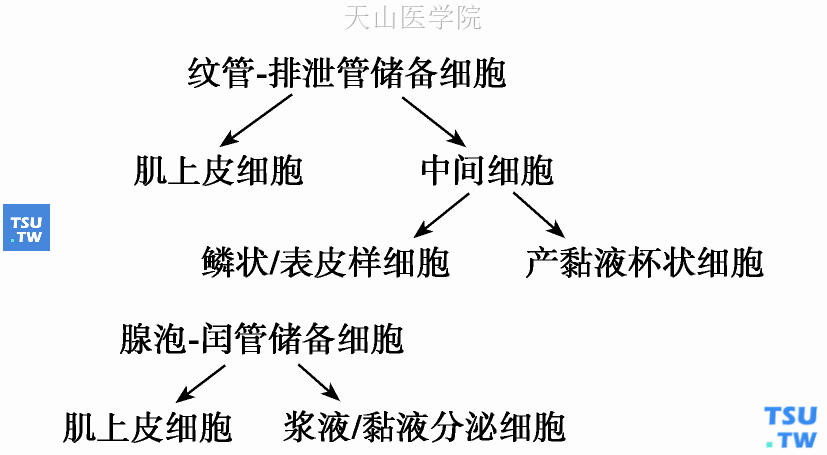
图5-7 黏液表皮样癌组织发生的双储备细胞理论
迄今为止,Chaudhry等的学说最为全面地对黏液表皮样癌的组织发生及其复杂的组织形态进行了阐述,但由于此学说认为两种储备细胞均参与了肿瘤的发生,这似乎和肿瘤发生的单克隆学说有所矛盾,故黏液表皮样癌发生的确切机制还有待于进一步的深入研究。
此外,少数发生于口腔黏膜的黏液表皮样癌可来源于黏膜上皮基底细胞,由于基底细胞的多向分化导致了肿瘤细胞形态的多样性。而颌骨中心性黏液表皮样癌来源于牙源性囊肿上皮的可能性最大,后者可发生黏液化生。
利用免疫组化方法,对黏液表皮样癌中表皮样细胞、中间细胞、黏液细胞、透明细胞、柱状细胞、嗜酸性细胞的cytokeratin 6、7、8、13、14、18、19表达情况进行分析,结果发现所有类型的细胞都有cytokeratin 7的较高表达和cytokeratin 13的较低表达,表达方式与排泄管的cytokeratin表达方式类似。
腺样囊性癌(adenoid cystic carcinoma)
腺样囊性癌的基本组织结构可分为腺样型(筛状型)、管状型和实体型。腺样型由间以许多腔隙的上皮巢构成,这些腔隙大多为假囊腔。管状型由腔面导管细胞及围绕其周围的一至多层肿瘤性肌上皮细胞构成。实体型则由较小的嗜碱性细胞构成实性上皮团。
早在20世纪70年代,就有学者发现腺样囊性癌中存在两种细胞,分别和正常唾液腺中的闰管细胞和肌上皮细胞相类似。以后用免疫组化方法对肿瘤细胞进行S-100、keratin、vimentin、muscle-specific actin检测后发现肿瘤中除闰管样和肿瘤性肌上皮细胞外,还存在一种未分化细胞,且闰管样细胞和肌上皮细胞是由未分化细胞分化而来。20世纪80年代中期,有学者对腺样囊性癌进行了光镜和电镜观察后提出,肿瘤由四种类型细胞构成,即闰管样细胞、肌上皮细胞、分泌细胞和多潜能储备/干细胞。由于位于腺泡-闰管结合部以及闰管内的多潜能储备/干细胞能分化为闰管细胞、肌上皮细胞和腺泡细胞(分泌细胞),故认为肿瘤来源于闰管多潜能储备/干细胞。
免疫组化研究证实,闰管样细胞排列成导管样结构,或是与肌上皮细胞一起形成与正常闰管相似的呈导管上皮、肌上皮分化的双层细胞结构。排列在筛孔样假囊腔周围的是肿瘤性肌上皮细胞,组织化学和超微结构观察表明,假囊腔中的物质由黏多糖、胶原纤维和其他一些无周期纤维组成,其构成与基底膜样物质相似,是肿瘤性肌上皮细胞的产物。而真性管腔内的分泌物是肿瘤性导管细胞的产物。
有时,腺样囊性癌与多形性低度恶性腺癌在组织学上鉴别困难。鉴于一些蛋白标记物在探讨肿瘤细胞来源上的作用,提示可以利用这些标记物区分这两种肿瘤类型。例如含有肌上皮成分较多的腺样囊性癌中SMA、Calponin、平滑肌肌凝蛋白重链(smooth muscle myosin heavy chain)、金属硫蛋白(metallothionein)弥漫阳性,而这些标记物在多形性低度恶性腺癌中阳性程度较低。
综上所述,目前认为,腺样囊性癌来源于闰管储备细胞。
多形性低度恶性腺癌(polymorphous low grade adenocarcinoma)
多形性低度恶性腺癌的首次报道见于1984年,也被称为终末导管癌(terminal duct carcinoma)、小叶癌(lobular carcinoma)、低度恶性乳头状腺癌(low-grade papillary adenocarcinoma),为低度恶性肿瘤。肿瘤以细胞形态的相对单一性和组织形态的多样性为特点。肿瘤细胞小至中等大小,染色淡,细胞排列呈小叶状、乳头或乳头-囊状、筛状、小梁状、小管状等。
大量关于多形性低度恶性腺癌的光镜、电镜及keratin、EMA、CEA、actin、vimentin、S-100的免疫组化检测表明,肿瘤主要由两种细胞构成,即导管细胞和肿瘤性肌上皮细胞,因而认为肿瘤来源于闰管储备细胞。两种细胞的不同比例和不同排列方式导致了肿瘤组织形态的多样性。
上皮-肌上皮癌(epithelial-myoepithelial carcinoma)
上皮-肌上皮癌中常见透明细胞,故曾称之为透明细胞癌(clear cell carcinoma),属低度恶性的肿瘤。肿瘤由上皮和肌上皮细胞依不同比例构成,二者可形成典型的导管样结构,内层为较小、染色较深的立方形导管细胞,外层为较大的、胞质透亮的透明细胞。有时后者可为肿瘤的主要成分,形成成片的透明细胞巢,而少见典型的导管样结构。
电镜及免疫组化均证实,肿瘤细胞存在两种分化,构成双层导管样结构的内层细胞为导管细胞分化,外层为肌上皮细胞分化。肌上皮细胞呈透明状是由于低分化的肌上皮细胞中有大量的糖原。研究表明,肿瘤来源于闰管储备细胞,肿瘤中存在两种特征的细胞是闰管储备细胞双向分化的结果。
非特异性透明细胞癌(clear cell carcinoma,not otherwise specified)
非特异性透明细胞癌是2005年WHO《头颈肿瘤病理学和遗传学》中有关唾液腺肿瘤分类中新增加的肿瘤类型,也称伴玻璃样变的透明细胞癌(hyalinizing clear cell carcinoma),它与伴有肌上皮分化的上皮-肌上皮癌不同,后者也曾被称之为透明细胞癌。
非特异性透明细胞癌是一种单形性细胞构成的恶性上皮性肿瘤,在常规染色时胞质透明。肿瘤的组织学特征有两大特点,一是肿瘤主要由富含糖原、排列成小梁状、带状、巢状、团块状的透明细胞和少量嗜酸性细胞组成;二是肿瘤细胞周围有时可见不等量的玻璃样变物。肿瘤细胞异形不明显,核分裂罕见。
目前,关于唾液腺透明细胞癌的组织来源研究报道不多。我们对10例该肿瘤的免疫组化研究显示,肿瘤中CK8、CK18(单层上皮较特异的标记)呈阳性或大部分阳性表达,CKHMW、CK10/13(复层鳞状上皮较特异的标记)呈阴性或绝大部分呈阴性表达,Calponin、SMA、S-100(肌上皮标记)均呈阴性表达,提示肿瘤为导管上皮来源,具有单层腺上皮分化的特征,我们推测可能来源于闰管储备细胞。
基底细胞腺癌(basal cell adenocarcinoma)
肿瘤具备基底细胞腺瘤细胞的特征,但其组织形态及生长方式为恶性。
组织发生见基底细胞腺瘤。
皮脂腺癌(sebaceous carcinoma)
肿瘤罕见,由不同分化程度的皮脂腺细胞构成。
组织发生见皮脂腺瘤。发生于口腔内尤其是颊部的皮脂腺癌也可能与颊部的皮脂腺(Fordyce斑)有关。
乳头状囊腺癌(papillary cystadenocarcinoma)
肿瘤主要由囊性结构组成,囊腔内含乳头状突起,且肿瘤组织和细胞形态表现为恶性。
组织发生见乳头状囊腺瘤。
低度恶性筛状囊腺癌(low-grade cribriform cystadenocarcinoma)
低度恶性筛状囊腺癌是2005年WHO《头颈肿瘤病理学和遗传学》中有关唾液腺肿瘤分类中新增加的肿瘤类型,也称低度恶性唾液腺导管癌(low-grade salivary duct carcinoma)。是一种罕见的、囊性增生性癌,类似于乳腺的非典型性导管增生和筛状低度恶性导管原位癌。
组织学特征表现为肿瘤无包膜,由单个、多个囊及邻近的导管内增生构成,囊腔衬覆的导管细胞增生,无明显异形性及核分裂象,排列成筛状、微乳头状和实性,有些腔面细胞含顶浆分泌泡。免疫组化标记显示,Calponin、SMA、P63阳性的肌上皮细胞围绕囊性腔隙,提示肿瘤来源于唾液腺导管细胞。
黏液腺癌(mucinous adenocarcinoma)
肿瘤罕见,主要由囊腔构成,内含丰富黏液。由于肿瘤罕见,关于其组织发生的报道非常缺乏。乳头状黏液腺癌,肿瘤罕见,组织发生不明。
嗜酸细胞腺癌(oncocytic carcinoma)
肿瘤少见,由恶性嗜酸性细胞构成。组织发生见嗜酸细胞腺瘤。
唾液腺导管癌(salivary duct carcinoma)
为高度恶性肿瘤,浸润性强。肿瘤细胞排列成筛状、环状或实体型,常伴中央坏死,结构与乳腺导管癌相像。最近有报道导管内生长的肿瘤恶性程度较低。
免疫组化标记表明,唾液腺导管癌中肿瘤细胞keratin、EMA阳性,S-100、muscle-specific actin阴性,提示肿瘤细胞无肌上皮分化。电镜观察也证实,肿瘤完全由导管细胞构成,无腺泡细胞和肌上皮细胞分化的特征,个别肿瘤中可见纹管分化的特征。因而认为唾液腺导管癌来源于唾液腺导管上皮,可为小叶间导管(纹管)或排泄管。
腺癌(adenocarcinoma)
此处指的是不能分类为其他癌的非特异性腺癌。肿瘤中可见腺样、导管样和分泌细胞分化。
免疫组化标记显示,肿瘤细胞可表达一些恶性肿瘤抗原,如KM-93(肺癌抗原)、KM-231(胃癌抗原)。有学者认为,光镜下肿瘤细胞与未分化的闰管储备细胞十分相像,且由于肿瘤细胞可表现出导管细胞、分泌细胞的分化,推测肿瘤来源于闰管储备细胞。
恶性肌上皮瘤(malignant myoepithelioma)
也称肌上皮癌(myoepithelial carcinoma)。肿瘤少见,由不典型的肌上皮细胞构成,可见有丝分裂和侵袭性生长。
组织发生见肌上皮瘤。
癌在多形性腺瘤中[carcinoma in pleomorphic adenoma(恶性混合瘤malignant mixed tumor)]
在此类肿瘤中,部分区域表现为多形性腺瘤,另有部分区域的细胞则出现恶性特征,如细胞有异形、出现异常核分裂、肿瘤呈浸润性生长等。当恶性成分为上皮组织时,称之为癌,包括非侵袭性癌和侵袭性癌,常见的有腺癌、未分化癌、黏液表皮样癌、肌上皮癌、腺样囊性癌、腺泡细胞癌等。当肿瘤中的上皮和间叶组织均有恶性成分时,称之为癌肉瘤或真性混合瘤,常见的有癌合并软骨肉瘤、横纹肌肉瘤等。除癌和癌肉瘤外,也有将转移性多形性腺瘤也包括在恶性多形性腺瘤中的分类方法。
过去曾认为,恶性成分为癌的是由多形性腺瘤恶变而来,而恶性成分为癌肉瘤的则是原发恶性。目前大多数学者认为,虽然有部分恶性多形性腺瘤表现为原发恶性,但大部分肿瘤,无论恶性成分是癌还是癌肉瘤,是由良性多形性腺瘤恶变而来,其组织形态的多样性是由于肿瘤中不同成分恶变以及肿瘤细胞的多向分化所致。
如有学者对癌在多形性腺瘤中较常见的未分化癌进行超微结构观察发现,肿瘤细胞存在两种分化,一种细胞内有细丝、密斑样结构,其他细胞器不丰富,另一种细胞内含张力丝样结构,两种细胞分别类似于肌上皮细胞和表皮样细胞,两种细胞可独立存在或之间有桥粒连接。免疫组化标记显示,肿瘤细胞表达keratin和S-100蛋白。有学者认为,上述结果提示,未分化癌可能来源于肌上皮细胞的恶性转化,肌上皮细胞还可分化为其他细胞。
鳞状细胞癌(squamous cell carcinoma)
由恶性上皮性细胞构成的肿瘤。肿瘤细胞有角化或细胞间桥,无黏液分泌物。
由于唾液腺起源于表面口腔黏膜上皮,从理论上讲它的各个部分都可能发生鳞化。正常唾液腺中,常见导管尤其是排泄管的鳞状化生。对唾液腺鳞状细胞癌的免疫组化标记显示,部分肿瘤细胞keratin、EMA、CEA阳性,提示肿瘤来源于导管上皮。组织学观察也发现,发生于腮腺的鳞状细胞癌与腮腺导管的关系密切。目前认为唾液腺鳞状细胞癌来源于唾液腺的大导管,且和排泄管的关系密切,是导管细胞发生鳞状化生所致。
小细胞癌(small cell carcinoma)
组织结构特点和生物学行为与肺的小细胞癌十分相像。
最初超微结构观察小细胞癌,发现肿瘤细胞内含膜被颗粒,提示其为神经内分泌来源,故认为肿瘤来源于从神经嵴迁徙到唾液腺的神经干细胞。但进一步观察发现,某些小细胞癌中并无神经内分泌颗粒,因而提出这种无神经内分泌颗粒的肿瘤来源于导管细胞。以后结合免疫组化的研究结果发现,某些小细胞癌即使超微结构观察无神经内分泌颗粒,免疫组化研究却显示出其神经内分泌标记阳性。光镜及电镜观察还发现,有神经内分泌分化的肿瘤还可出现腺样分化,电镜观察肿瘤还有鳞状分化的特征,如存在桥粒、张力丝结构等。因而,目前认为,小细胞癌可能来源于唾液腺中多潜能的导管干细胞,这种细胞可发生神经内分泌分化、鳞状分化、腺样分化等多向分化。
分化癌(undifferentiated carcinoma)
为上皮性的恶性肿瘤,肿瘤细胞分化很差,光镜下无表型特征,不能归类于其他癌。此类肿瘤包括未分化癌和淋巴上皮癌。
此处的未分化癌相对于唾液腺小细胞癌来说细胞较大,胞质较为丰富,胞核大,核仁清楚。有报道显示,未分化癌的肿瘤细胞keratin、vimentin阳性,但对其组织发生的研究相对于伴淋巴间质的未分化癌来说少得多,因而其组织来源尚未完全明了,推测可能来源于唾液腺导管细胞。
淋巴上皮癌(lymphoepithelial carcinoma)也称恶性淋巴上皮病(malignant lymphoepithelial lesion)、伴淋巴间质的未分化癌(undifferentiated carcinoma with lymphoid stroma),在WHO唾液腺肿瘤分类第2版定义为伴淋巴间质的未分化癌,在WHO头颈肿瘤分类第3版更名为淋巴上皮癌。笔者认为后者的命名更为准确,因肿瘤中的恶性上皮成分并非都为未分化癌,有时可为低分化鳞癌。
组织学表现为肿瘤细胞较大,含泡状核,核仁清楚,间质含有大量小淋巴细胞和浆细胞,其组织形态与鼻咽部的未分化癌十分相像。
肿瘤多见于北美、格陵兰的爱斯基摩人和中国南部。肿瘤的发生与EB病毒的关系密切。如有实验表明,在格陵兰和中国南方,在伴淋巴间质的未分化癌患者中肿瘤细胞EB病毒阳性,而在无淋巴间质的未分化癌患者中,EB病毒阴性。同样,在这些人群中鼻咽癌的发病率也是较高的,而鼻咽癌也是与EB病毒相关性较高的肿瘤之一。研究表明,在爱斯基摩人和中国南部,伴淋巴间质的未分化癌的发生可能与患者早期的EB病毒的感染有关。
在除了爱斯基摩人和中国人的其他人群中,EB病毒与伴淋巴间质的未分化癌的关系尚不明确,虽然有学者在部分(3/7)白人患者中检测出EB病毒,但较多的实验表明,在白人、西班牙人患者中,EB病毒阴性。推测爱斯基摩人和中国人与其他人群发生伴淋巴间质的未分化癌的病因可能是不同的。
对于良性淋巴上皮病与淋巴上皮癌关系的认识经历了一个发展的过程。早期人们普遍认为淋巴上皮癌是由良性淋巴上皮病的上皮成分恶变而来,因为部分淋巴上皮癌中可见良性淋巴上皮病图像,尤其当看到上皮岛细胞出现不典型增生至癌变过程,恶变也就自然成立。以后,随着病例不断增加,学者们发现很多患者病程较短,形态学上并无良性淋巴上皮病基础,组织学观察也未见肌上皮岛的存在。病变一开始就表现为大细胞癌,间质含丰富的淋巴细胞、浆细胞,故认为所谓“恶性淋巴上皮病”并不都是由良性淋巴上皮病变恶变而来,而是从一开始即为恶性。目前普遍认为,良性淋巴上皮病与淋巴上皮癌是病因不同的两种疾病,大部分淋巴上皮癌的发生与良性淋巴上皮病无关。良性淋巴上皮病为自身免疫性疾病,多无EB病毒感染证据,而淋巴上皮癌为非自身免疫性疾病,大量研究证实大部分肿瘤有EB病毒感染。但确有少数淋巴上皮癌可在良性淋巴上皮病基础上发生恶变而形成。用原位杂交方法检测EB病毒编码的小分子RNA(EBER-1)和PCR方法检测EBV BamHI-W片段,结果发现发生恶变的淋巴上皮病以及原发即为恶性的淋巴上皮癌中上述2项指标均为阳性,而无恶变的淋巴上皮病中上述指标阴性,EBV感染可发生在BLEL癌变之前,支持前述观点。
对伴淋巴间质的未分化癌进行免疫组化标记显示肿瘤上皮keratin阳性,S-100、LCA、HMB-45阴性,提示其来源于唾液腺导管上皮。
成涎细胞瘤(sialoblastoma)
成涎细胞瘤是2005年WHO《头颈肿瘤病理学和遗传学》中有关唾液腺肿瘤分类中新增加的肿瘤类型,也称胚组织瘤(embryoma)、基底样腺癌(basaloid adenocarcinoma)、先天性基底细胞腺瘤(congenital basal cell adenoma)等。
肿瘤的组织学形态重现了原始唾液腺始基及其分化的不同阶段,肿瘤由原始的基底样细胞构成大小不一的实性上皮岛,上皮岛之间由纤维或纤维黏液间质分隔,部分肿瘤上皮巢周边细胞栅栏状排列。肿瘤细胞核大,圆、卵圆,泡状,胞质丰富,界限不清。有时可见腺腔分化、筛状结构、钙化。肿瘤大部分界限清楚,但局部常侵犯周围组织。可见坏死、侵犯面神经,个别有淋巴结转移。有些病例核浆比增大,核分裂多少不等。有学者认为,根据肿瘤细胞异形性、是否侵犯神经、血管,可将肿瘤分为良、恶性。
免疫组化标记显示,导管上皮表达广谱CK,基底样细胞不同程度表达Vimentin、S-100。推测肿瘤来自于残留的胚细胞而不是基底储备细胞。
其他癌(other carcinoma)
癌在腺淋巴瘤中(carcinoma in Warthin tumour),非常少见,恶性成分常为鳞状细胞癌、黏液表皮样癌、腺泡细胞癌等。
肿瘤可有三种情形,最常见的是肿瘤中同时存在腺淋巴瘤和其他恶性肿瘤两种相互独立的成分;其次为肿瘤转移至腺淋巴瘤的淋巴基质成分中;最少见的是腺淋巴瘤的导管上皮成分恶变为癌。
胚胎性癌(embryonal carcinoma),非常少见,肿瘤来自同一器官原基,但有不同分化。肿瘤存在导管分化、腺泡分化和多形性腺瘤样分化。
由于肿瘤罕见,因而对其组织发生的报道非常有限。但从肿瘤形态推测,肿瘤应来源于胚胎发生过程中的唾液腺原基。
腺鳞癌(adenosquamous carcinoma),肿瘤少见,组织学表现为在同一肿瘤中同时存在着腺癌和鳞状细胞癌的分化。
免疫组化标记显示,肿瘤细胞keratin阳性,vimentin、myosin阴性。大多数学者认为腺鳞癌起源于鳞状细胞癌,是肿瘤双向分化的表现,因而肿瘤也应来自排泄管等大导管。有学者提出腺鳞癌是鳞状细胞癌中恶性程度较高的一种类型。
