放疗技术和步骤
作为唾液腺肿瘤综合序列治疗的一部分,唾液腺肿瘤术后放疗须结合手术情况、银夹标记、手术病理、术前CT/MRI/PET影像,由放疗科、头颈-口腔颌面外科、病理科等多学科参与决定。
放疗技术和步骤
(1)体位固定和CT模拟定位:患者取仰卧位,鼻尖对中不偏,采用碳纤头颈肩板制作个体化的热塑型头颈膜或头颈肩膜,充分冷却后取下(复杂患者需先常规模拟机模拟后制作头颈肩面膜),经常规模拟机核对,符合要求后通过激光灯在面罩上标出初始靶中心。然后行CT扫描,扫描范围在治疗区域上下各放5cm,层厚2. 5mm(必要时病变区扫描层厚1. 25mm),先做平扫,再做增强扫描,图像传入放疗计划系统工作站。
(2)靶区范围:术后放疗照射野须包括术前肿瘤及亚临床灶的范围,靶区勾画要依据术前CT及MRI片上肿瘤的侵犯部位和瘤体、手术记录、银夹标记和病理报告对照射野的设计极具参考价值,必要时做术后PET/CT扫描供设野参考。靶区范围应包括腮腺床、同侧咽腭间隙、乳突、同侧咽旁间隙和颞下间隙;如病理类型为腺样囊性癌,当有神经受侵时,靶区须包括神经周围直达颅底上1cm;腮腺癌颈部转移由高至低为Ⅱ、Ⅲ、Ⅰb、Ⅳ和Ⅴ区;当颈部存在淋巴结转移时,放疗范围要包括同侧颈部Ⅰ~Ⅴ区(请参照本章“颈部淋巴结放射治疗适应证”)。
(3)靶区放射剂量设定:术后放疗无肉眼肿瘤残留时照射60Gy,有肿瘤残留时,按肿瘤大小照射65~75Gy/6. 5~8周;姑息放疗局部照射60~65Gy/6~7周。我们的经验表明,术后放疗剂量低于54Gy局部控制率会明显下降;有颈淋巴结包膜外侵犯时颈部放疗63Gy以上疗效更好,但并发症发生率也上升。对肿瘤表浅、位近皮肤的患者,手术切口瘢痕区皮肤要用电子线加照10Gy。N0患者颈部预防性放疗剂量为50 ~54Gy。单纯放射治疗照射剂量提高至65~75Gy,加照颈部者,切线40Gy加侧照20~30Gy。
(4)危险器官的剂量限值:脑干54Gy、视交叉54Gy、脊髓45Gy、颞叶60Gy、眼晶体<6Gy。调强放疗的正常器官保护(无肿瘤累及)增加腮腺/下颌下腺、颞下颌关节、下颌骨、内耳/中耳等:内耳/中耳<47Gy;颞下颌关节<60Gy;腮腺/下颌下腺平均剂量<26Gy;下颌骨:在保证靶区剂量条件下,尽量减少照射体积和剂量。
(5)完成放疗计划:物理师根据主管医师定出各类靶区的处方剂量及危及器官的限制剂量后完成放疗计划,普通放疗用正向计划,调强放疗用逆向调强计划。治疗计划完成后的靶中心为最终治疗中心。
(6)计划评估和位置验证:由医师和物理师共同对计划做出评估,移动激光灯在面罩上标记出最终放疗中心,然后用常规模拟机图像与放疗计划的DRR(重建图像)进行比较,误差在2mm以内为通过。
(7)摆位及治疗:普通常规放疗即开始放疗;调强放疗在放疗前还须通过剂量验证和授权后方可开始放疗。
靶区定义和勾画
(1)术后调强放疗的靶区定义:①CTV1(有肿瘤残留者靶区):大体肿瘤(gross tumor volume,GTV),包括手术未切除的肿瘤瘤体和受侵的淋巴结(根据CT/MRI/PET影像资料、病理报告、临床检查等确定);②CTV2(高危亚临床靶区,无肿瘤残留者):包括原发肿瘤周围易被浸润的正常组织(参照术前原发灶GTV边缘加1. 0~1. 5cm)和高危的淋巴结区域(已有转移淋巴区加下一站淋巴区,如有颌下淋巴转移扩至颈深上区;已有颈深上淋巴转移扩至颈深中区等)。高危定义为切缘阳性/有淋巴结包膜外受侵犯/颈部二个或以上淋巴结转移/转移淋巴结>3cm/软组织、神经、血管及周围侵犯或骨侵;③CTV3(低危预防性放疗靶区):原发部位按术前GTV边缘加2. 0~2. 5cm,同侧颈部按再下一站淋巴结区域预防。
(2)术后常规放疗靶区定义:有肿瘤残留者靶区:包括手术未切除的肿瘤瘤体和受侵的淋巴结(根据CT/MRI/PET影像资料、病理报告、临床检查等确定),一般参照术前原发灶边缘加2. 0~2. 5cm易被浸润的正常组织;无肿瘤残留者靶区:包括肿瘤瘤体床扩大2. 0cm和受侵的淋巴结区,已有转移淋巴区加下一站淋巴区(如有颌下淋巴转移扩至颈深上区;已有颈深上淋巴转移扩至颈深中区等)。常规放疗在完成3/5放疗总剂量后,可采用缩野(boost)技术,对术前肿瘤区(原发灶边缘加1. 0cm)或肿瘤残留灶加量照射。
腮腺肿瘤的术后放疗技术
腮腺癌术后调强放疗
腮腺调强放疗的射野数5~7个,如病理类型为腺样囊性癌,还应包括有关脑神经通道上达颅底。图19-1-A、B为某右侧腮腺腺样囊性癌术后患者的6MV X线的5野调强放疗(含脑神经通道)剂量分布图。
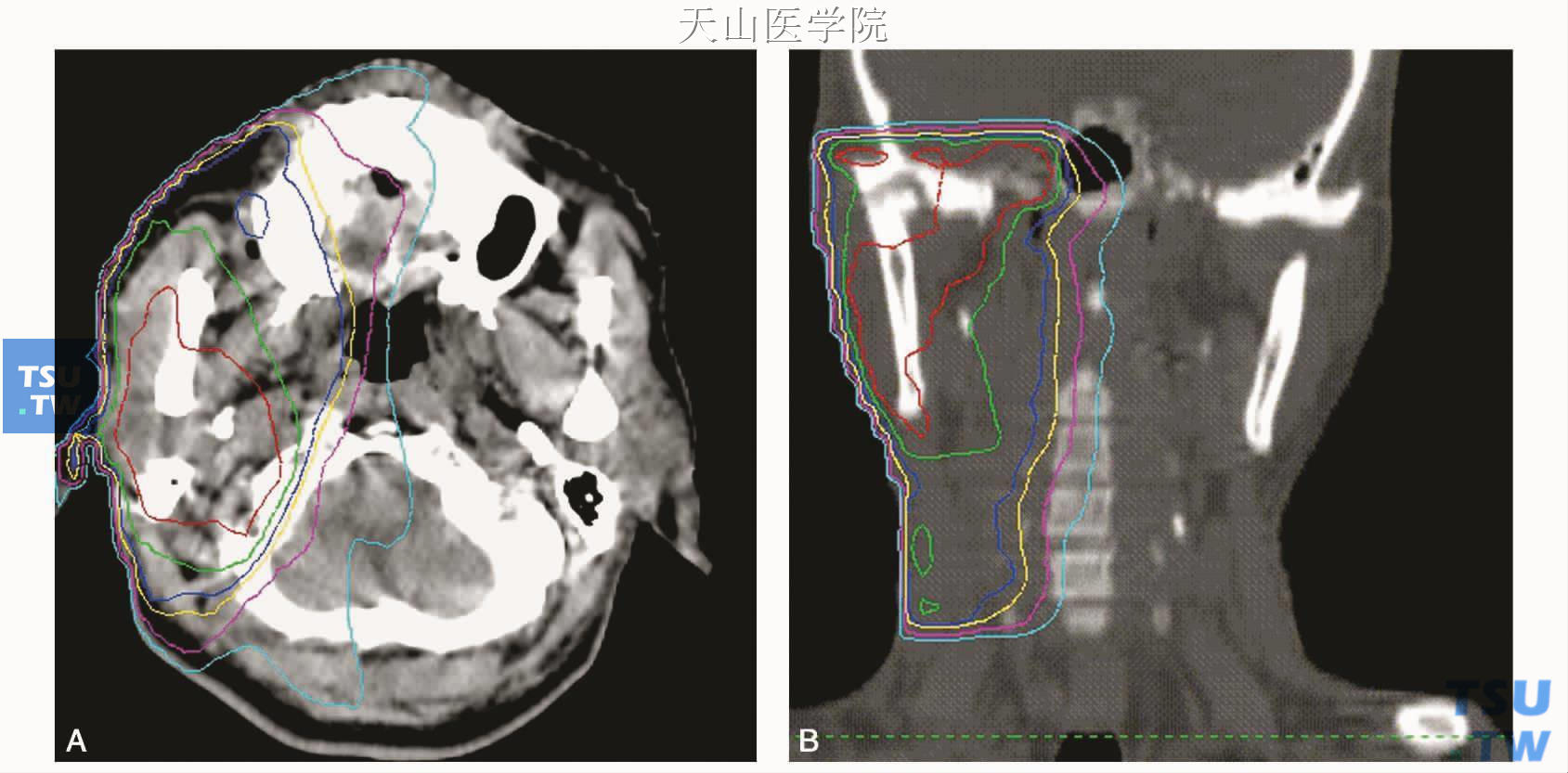
图19-1 右侧腮腺腺样囊性癌术后调强放疗剂量分布图
A.腮腺层面剂量分布图(剂量线由中心红线向外依次为62Gy、58Gy、54Gy、50Gy、40Gy、30Gy,图1/2A/B同);B.颞下颌关节-颅底冠状切面剂量分布图
腮腺癌术后常规放疗
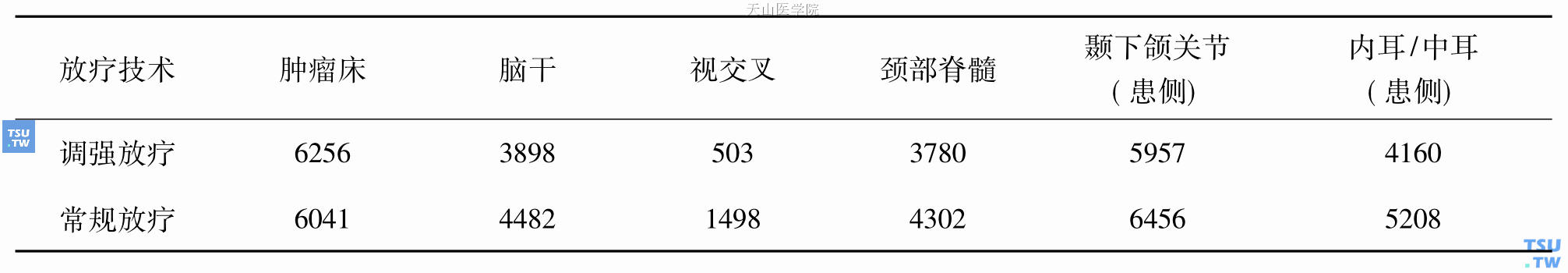
腮腺常规放疗采取6MV X线双楔形板斜野交角(等中心)加9~12MeV电子线照射,深度剂量按5cm计算,X线与电子线剂量配比为2∶1。此技术减少了脑干和脊髓的受量,提高了皮肤表面受量,可得到一个比较好的剂量分布曲线。设野的前界达咬肌前缘,后界至乳突尖,上界为颧弓上缘或更高,下界达甲状切迹水平(不含颈部放疗时)。对肿瘤表浅、位近皮肤的患者,手术切口瘢痕区皮肤要用电子线加照10Gy。为防止对侧眼睛受到照射,放疗头位固定在适度后仰。图19-2-A、B为图1同一右侧腮腺腺样囊性癌术后患者的6MV X线两野交角加楔形板照射加9MeV电子线3野常规放疗剂量分布图(供不同放疗技术对比而另作的放疗计划)。表19-1为该患者两种放疗技术的肿瘤和组织受量比较,肿瘤床的平均剂量2种放疗技术基本一致,但调强放疗靶区的剂量分布更优;正常组织受量上,调强放疗明显低于常规放疗。这正是调强放疗的优势所在:常规放疗患者常见的放疗并发症如持续性口干、张口受限、中耳炎、耳鸣、下颌骨放射性骨髓炎等,在调强放疗患者已极为少见。
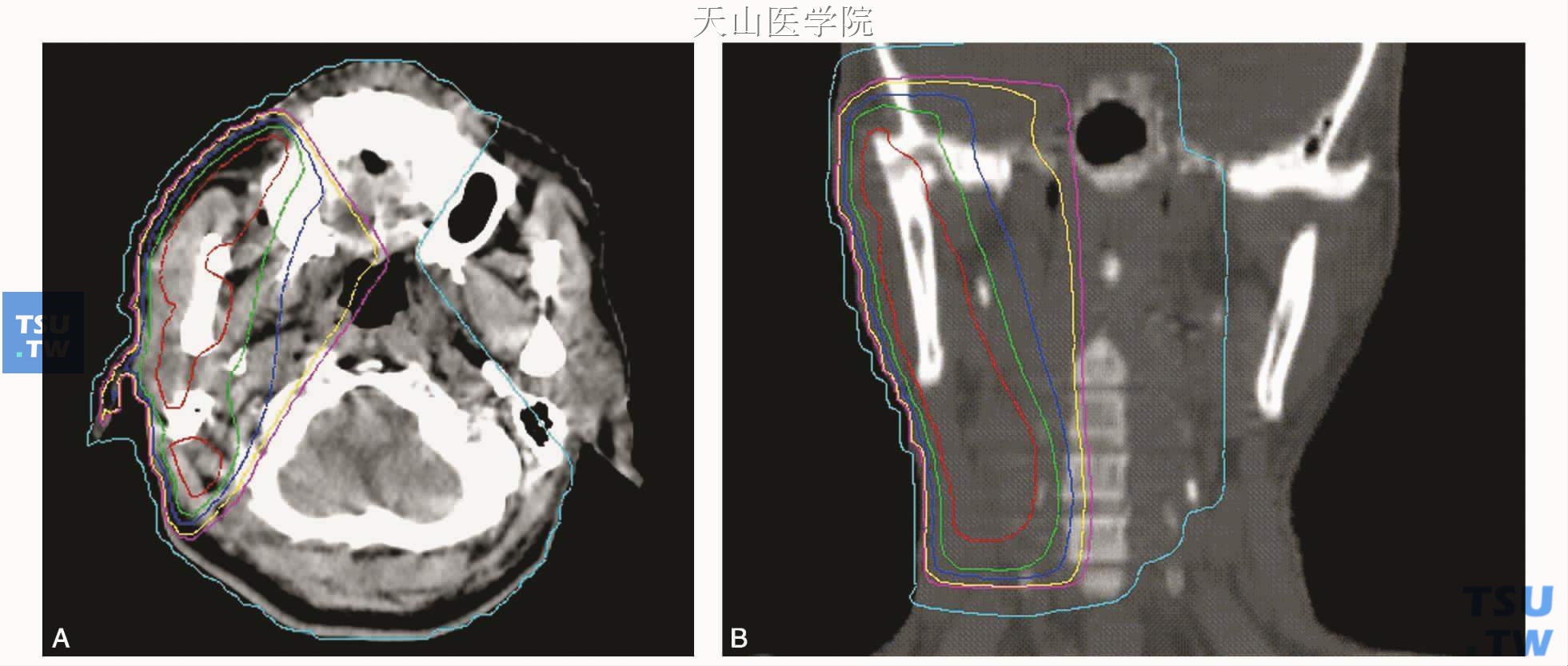
图19-2 同图19-1 患者的术后常规放疗剂量分布图
A.腮腺层面剂量分布图(剂量线由中心红线向外依次为60Gy、56Gy、54Gy、50Gy、40Gy、30Gy,图2A/B同);B.颞下颌关节-颅底冠状切面剂量分布图
表19-1 腮腺腺样囊性癌患者两种放疗技术的肿瘤床和正常组织受量比较(平均剂量cGy)
下颌下腺肿瘤术后放疗技术
下颌下腺肿瘤术后放疗靶区范围应包括患侧颌下和口底,术前肿瘤侵越中线时须双侧放疗;如病理类型为腺样囊性癌,还应包括有关脑神经通道上达颅底,常见为三叉神经下颌支。下颌下腺癌颈部转移由高至低为Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ区;当颈部存在淋巴结转移时,放疗范围要包括同侧颈部Ⅰ~Ⅴ区(请参照本章“颈部淋巴结放射治疗适应证”)。术前CT及MRI片上肿瘤的侵犯部位、手术记录、银夹标记和病理报告对照射野的设计极具参考价值,必要时做术后PET/CT扫描供设野参考。
1.下颌下腺癌术后调强放疗
下颌下腺调强放疗的射野数5~7个。图19-3-A、B为某左侧下颌下腺腺样囊性癌(过中线)术后患者的6MV X线的7野调强放疗(含脑神经通道上达颅底)剂量分布图。
2.下颌下腺癌术后常规放疗
下颌下腺癌(未过中线)的常规放疗采取6MV X线双楔形板斜野等中心照射;下颌下腺癌(过中线)的常规放疗6MV X线双侧对穿野照射,患侧与对侧剂量配比为2∶1。设野的前界开放,后界在下颌骨升支后缘,上界需包含整个口底,下至甲状软骨切迹水平(不含颈部放疗时),对于易侵及神经的组织学类型及已有神经受侵的患者应包括颅底(进颅孔)上1cm及脑神经通道;对肿瘤表浅、位近皮肤的患者,手术切口瘢痕区皮肤要用电子线加照10Gy。图19-4-A、B为图19-3同一下颌下腺腺样囊性癌(过中线)术后患者的6MV X线双侧对穿野常规放疗剂量分布图(供不同放疗技术对比而另做的放疗计划)。表19-2为该患者两种放疗技术的肿瘤和组织受量比较,肿瘤床的平均剂量二种放疗技术基本一致,但正常组织受量上,调强放疗明显低于常规放疗。
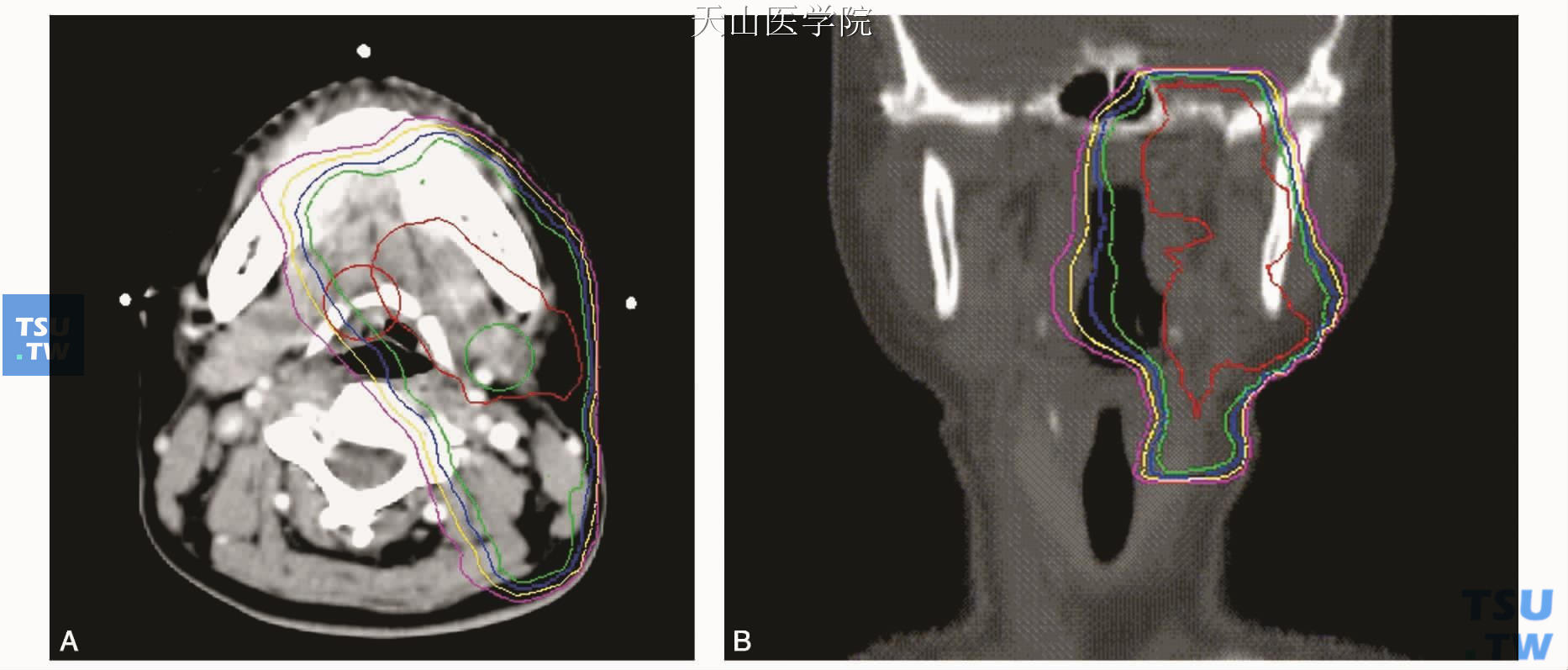
图19-3 左侧下颌下腺腺样囊性癌(过中线)术后调强放疗剂量分布图
A.下颌下腺-口底层面剂量分布图(剂量线由中心红线向外依次为61Gy、56Gy、50Gy、45Gy、40Gy、30Gy,图3/4A/B同);B.颞下颌关节-颅底冠状切面剂量分布图
图19-4 同图19-3 患者的术后常规放疗剂量分布图
A.下颌下腺-口底层面剂量分布图(剂量线由中心红线向外依次为60Gy、55Gy、50Gy、45Gy、40Gy、30Gy,图4A/B同);B.颞下颌关节-颅底冠状切面剂量分布图
表19-2 下颌下腺腺样囊性癌患者两种放疗技术的肿瘤床和正常组织受量比较(平均剂量cGy)

舌下腺肿瘤术后放疗技术
舌下腺肿瘤术后放疗靶区范围应包括口底和同侧颌下区,术前肿瘤侵越中线时须双侧放疗;如病理类型为腺样囊性癌,还应包括有关脑神经通道上达颅底,常见为三叉神经下颌支;当颈部存在淋巴结转移时,放疗范围要包括同侧颈部Ⅰ~Ⅴ区(请参照本章“颈部淋巴结放射治疗适应证”)。术前CT及MRI片上肿瘤的侵犯部位、手术记录、银夹标记和病理报告对照射野的设计极具参考价值,必要时做术后PET/CT扫描供设野参考。舌下腺癌调强放疗的射野数5~7个。舌下腺癌术后常规放疗同下颌下腺常规放疗基本相同,即肿瘤未过中线采取6MV X线两楔形板照射野等中心照射技术,过中线患采用双侧对穿野照射(患侧与对侧剂量配比为2∶1或3∶2)。
小唾液腺肿瘤放射治疗技术
小唾液腺恶性肿瘤中以腺样囊性癌最常见,其次为黏液表皮样癌和腺癌,以腭部最为好发,其次是颊、唇。照射范围依具体肿瘤部位、侵及范围和病理类型而定。上颌窦底骨质受侵时,放射野应包括整个上颌窦。特别应该指出是,腭腺的腺样囊性癌具有极强的侵袭性,易侵犯相邻的骨壁,并沿骨髓腔、上颌窦黏膜、咽旁间隙、腭大神经及上颌神经等向周围蔓延生长。因此,放射野包括相应受侵部位外,神经通路、上界达颅底上1cm。颈部放疗请参照本章“颈部淋巴结放射治疗适应证”。小唾液腺肿瘤术后调强放疗的射野数5~9个。术后常规放疗对位于腭腺,舌腺、唇腺部位的肿瘤多采用双侧对穿野;颊腺、部分局限的磨牙后腺肿瘤采用双楔形板斜野等中心照射技术;上颌窦小唾液腺肿瘤上颌骨受侵时,放射野应包括整侧上颌骨,用双楔形板斜野交垂直角等中心照射技术。
唾液腺肿瘤的快中子、质子及重粒子射线治疗
唾液腺肿瘤的快中子治疗
近10年来,快中子射线治疗唾液腺肿瘤已取得比常规放射线(γ射线和电子直线加速器X线)更好的疗效。快中子射线是高线性能量转换(high linear energy transfer,LET)射线,对细胞的氧增比(OER)小约等于1. 5~1. 7,相对生物效应(relative biological effect,RBE)高,约等于3. 0 ~8. 0,杀伤力大;此外,在低LET射线治疗中,不同细胞周期的放射敏感性是不同的,M期最敏感,S期最抗拒,快中子对细胞的杀伤无周期特异,对恶性肿瘤中的乏氧细胞有较强的杀伤能力,使肿瘤细胞失去增殖能力及亚致死损伤修复能力。治疗使用14~60兆电子伏(MeV)中子射线,如用20nGy的快中子剂量治疗,其生物效应大约相当于160Gy光子量,治疗增益因子达到250%,局部控制率提高约1倍。对无法手术切除的晚期唾液腺癌,如用常规放射线治疗,疗效极差,局控率不足25%;而用快中子治疗,肿瘤局部或区域长期控制率可达67%。据NCCN头颈部肿瘤临床实践指南(中国版),根治性放疗原发灶及受侵淋巴结照射19. 2nGy(1. 21nGy/d,下同);未受侵淋巴结区域13. 2nGy;术后放疗原发灶18nGy;颈部13. 2nGy。快中子治疗最大的缺点是后期放疗并发症较高,治疗后皮肤和皮下组织的晚期反应非常强烈,副作用极其明显。
唾液腺肿瘤的质子射线治疗
质子射线能量为70~450MeV,属高LET射线,其优点是在组织中射程末端剂量有一个释放峰(Bragg峰),可将之调到肿瘤所在的深度上,以达杀伤剂量最大,位于肿瘤前方的正常组织只受到很低的照射,而肿瘤后方的正常组织所受剂量根几乎为零,此对靠近重要器官的肿瘤治疗有特别意义。其氧增强比(OER)与60Co的γ射线和高能X射线相同,为2. 5~3. 0;其相对生物效应(RBE)为1. 05~1. 20,有较好疗效和较少并发症。质子射线治疗晚期口腔癌、腮腺癌、下咽癌、内耳道癌、鼻腔嗅神经母细胞瘤和神经内分泌癌等,疗效有显著改善、并发症少于常规放疗。目前投入治疗运行的有美国Loma Lindar大学医学中心、美国国家癌症研究所(NCI)、美国加州大学、美国麻省总医院(MGH)、比利时IBA和日本国立癌症中心(千叶县)等28个质子治疗中心。2004年,我国山东省淄博万杰医院已引进该设备。
唾液腺肿瘤的重粒子射线治疗
重离子射线能量为100~500MeV,属高LET射线,其优点是可调节治疗深度(4~30cm),具有Bragg峰,能量的主要释放区在粒子射程的峰区,对肿瘤杀伤剂量最大,而正常组织只受到很低或零照射。重离子射线氧增强比(OER)小,接近于1,几乎没有氧效应,对乏氧细胞杀伤力强;其RBE很大,重粒子射线产生的强烈电离效应可使肿瘤细胞DNA的双键同时受损(低LET射线治疗在多数情况下只对DNA双键中的一条产生损害)。双键断裂的DNA是无法自行修复的,因此,重离子治疗对X(γ)射线抗拒、修复能力强的肿瘤,可明显提高疗效。重离子射线照射肿瘤细胞时,利用PET可探测到碳离子的准确位置,用于校正和复核碳离子放疗计划,若利用重离子的带电属性,用磁偏转扫描并配合治疗床的相对运动,即可得到更精确、三维适合度更好的适形剂量分布。此外,重离子射线对细胞的杀伤无周期特异,还能将对低LET射线抗拒的肿瘤细胞诱导为敏感细胞,从而明显提高生物效应。
目前世界上仅少数肿瘤治疗中心有重离子射线用于临床治疗,晚期及复发的头颈部癌如鼻咽癌、唾液腺癌、脑胶质瘤、软组织肉瘤等的治疗效果令人鼓舞。由于重离子射线对细胞造成的损伤不易被修复,因此正常组织的晚期并发症须加倍关注。
