甲状腺(thyroid gland)分泌的甲状腺激素(TH)对人体有哪些作用呢?
提高组织耗氧量
据测量,1mg的T4可增加产热4187kJ(1000kcal),其效果显著。在人体白色脂肪细胞中,已发现β3-肾上腺素能受体和解耦联蛋白(uncoupling protein,UCP)。UCP被激活后,线粒体膜内外的质子电化学梯度减小(或消失),化学能不生成ATP,而以热能释放。T3促进UCP激活(或生成),故甲亢患者有不耐热、乏力和消瘦等表现。另一方面,人类UCP基因多态性的某些类型造成UCP活力下降,导致肥胖。T3加速线粒体呼吸过程,促进Na+/K+-ATP酶活性,并直接促进UCP基因的编码和翻译过程。TH的产热作用也发生于骨骼肌、心肌、肝、肾等组织,而其他一些重要组织,如脑、肺、性腺、皮肤等的耗氧量并不受TH的影响。脑组织很特殊,在胎儿期对TH很敏感,但当出生后,大脑对TH的反应能力明显减弱。TH可减轻体重,增加能量消耗,但能否用于肥胖和2型糖尿病的治疗仍不明了。
促进糖/脂肪/蛋白质/矿物质/水电解质/维生素代谢
糖代谢
TH使糖的吸收、利用、糖原合成与分解均加速。TH可通过非核受体作用,改变Ca2+、Na+、葡萄糖的转运和代谢,大剂量TH促进糖的吸收,促进肝糖原分解,产生“甲亢性糖尿病”。另一方面,TH亦加速外周组织对糖的利用,因此,多数轻型甲亢患者的血糖可维持在正常范围,而重症患者出现高血糖症或糖耐量减低。
脂代谢
TH加速胆固醇的合成及分解,但分解大于合成。故甲亢的血总胆固醇降低;反之,甲减时则升高。PET-CT可测定体内棕色脂肪组织(brown adipose tissue,BAT)含量。导致BAT增加的因素可用于糖尿病和肥胖的治疗。Skarulis等发现,TH可使胰岛素受体基因突变的糖尿病患者BAT增多,提示L-T4有增加白色脂肪组织消耗和增加BAT含量的作用。TH既促进脂肪合成又加速脂肪消耗。血总胆固醇与血TH浓度有反向消长关系,甲亢时血胆固醇降低,而甲减时升高。TH既促进脂肪生成,也刺激其分解。T3可诱导多种脂肪代谢酶(苹果酸脱氢酶、葡萄糖6-磷酸脱氢酶、脂肪合酶等)的合成。甲亢患者可有肝功能异常,甚至有肝实质损害,甲亢治愈后恢复。TH缺乏时,中密度及低密度脂蛋白胆固醇增加的原因之一是低密度脂蛋白受体减少与胆固醇清除率降低。同时,肝脂肪酶活性减低,中密度脂蛋白转化为低密度脂蛋白减慢,三酰甘油清除率降低。T3除能促进羟甲基戊二酸单酰辅酶A(HMG CoA)还原酶合成外,还促进胆固醇转变为胆汁酸,且后一作用更强,故其综合效果是使血总胆固醇下降。
TH促进白色脂肪(white adipose tissue,WAT)前脂肪细胞系的分化,促进细胞内脂肪堆积和脂肪细胞的特异性苹果酸酶与甘油磷酸脱氢酶表达,刺激脂肪细胞增殖及脂肪团形成。TH对WAT的这些作用可能与T3R有关。另一方面,甲亢患者体重减轻的原因之一是体脂消耗加速,这是因为T3促进解耦联蛋白基因(UCP)编码、翻译和作用于脂肪细胞上的肾上腺β3受体,通过氧化磷酸化解耦联作用增加产热效应,以热能散发较多的能量。棕色脂肪是机体特殊热量的主要来源,BAT中含有Ⅱ型脱碘酶(促进T4向T3转化),突然暴露于低温时,BAT可自主调节局部T3浓度,T3增加,促进T3R饱和及UCP表达,以满足生理需要。
蛋白质代谢
生理量的TH促进基因转录(无明显特异性),增加蛋白质(包括酶类、受体等)合成,机体呈正氮平衡。病理情况下,TH过多对蛋白质代谢的影响与其生理作用有质的差异,过多TH使蛋白质分解加强,肌肉消瘦无力,并可导致甲亢性肌病和甲亢性蛋白质营养不良综合征等。TH缺乏时,蛋白质合成亦减少,细胞间黏蛋白增多。
其他代谢
甲亢患者的尿肌酸排泄量增多,伴尿肌酐排泄量减少。机体内的肌酸主要存在于肌肉组织中,并主要以磷酸肌酸形式贮存能量,肌肉收缩供能后,肌酸游离,可能由于TH的“解耦联”作用,游离肌酸增多并经肾脏排出体外。甲减时,水钠潴留,组织间隙含大量黏蛋白,积聚于皮下,吸附水分和盐类,出现特征性的黏液性水肿。甲亢引起钙磷代谢紊乱,呈负钙、负氮、负磷及负镁平衡。尿钙、磷、镁排泄量增多,但血浓度一般正常。烟酸吸收和利用障碍出现烟酸缺乏症。胡萝卜素转化为维生素A和视黄醇受阻,血清胡萝卜素增高,皮肤呈蜡黄色。甲亢时,机体对维生素A、B1、B2、B6、B12、C及烟酰胺的需要量增加,如补充不足,可导致维生素缺乏症。
TH促进神经细胞分化/增殖/移行/发育/生长
脑组织的T3主要在局部经T4转换而来,星形细胞(astrocytic cells)的碘化酪氨酸脱碘酶活性很高,保证了脑组织的T3水平。与成年人比较,胎儿脑组织的T3较低,但rT3和各种碘化酪氨酸(iodinated tyrosine)的硫化合物(硫化T4、硫化T3、硫化rT3、硫化3,3’-T2等)明显升高。从胎儿至出生后半年内(特别是出生后数周内),TH对生长发育的影响十分明显,严重缺乏者出现呆小病(克汀病,cretinism)。先天性甲状腺不发育胎儿因有母体供给TH,常于出生后3~4个月后出现智力迟钝、骨骼生长停滞。而且每一种神经结构的发育均有其特定的时间段,因而一旦缺乏T3,其损害多是不可逆性的。最近发现,星形细胞作为神经组织的一种干细胞,在神经发育中起了重要作用。星形细胞表达T3受体和T3转运体,还是T3/T4代谢的主要场所;另一方面,T3/T4又是星形细胞分化和成熟的重要调节因子和生长因子。
TH对成熟神经系统有兴奋作用。患甲亢或使用过量TH时,表现为注意力分散、情绪激动、失眠好动,甚至出现幻觉、狂躁或惊厥。TH对神经细胞前体细胞的分化、增殖、凋亡和重建(remodeling)均有调节作用。Sinha等证明,脑细胞核中的T3R、血管紧张素原mRNA和5’D-Ⅱ活性均受T3调节,细胞内的一些信号传递蛋白如G蛋白α亚基、蛋白激酶A和C也受T3调控,以适应机体需要,并使脑细胞对葡萄糖、氨基酸和脂肪酸的代谢维持在正常范围内。T3还通过非核受体作用途径增加除极突触体Ca2+浓度,增强一氧化氮合酶活性。这些作用与甲亢时的神经兴奋及过多T3激发的氧化应激有关。
影响骨骼生长发育
骨的生长发育也依赖于TH,长骨的二次骨化中心出现时间、骨化速度均受TH的调控。TH增加成骨细胞标志物如碱性磷酸酶、骨钙素的表达,增加骨吸收的标志如尿羟脯氨酸、尿吡啶酚、尿脱氧吡啶酚交联物的生成。甲亢患者骨形成、骨矿化和骨吸收均相应增加,其净效应是骨吸收增加,骨松质及皮质骨变薄,引起骨质疏松及骨折。TH对骨的作用通过GH、IGF-1或直接作用于骨组织的靶基因而完成。T3增加碱性磷酸酶、骨钙素、胶原蛋白、GH、IGF-1和IGFBP4表达。因而,儿童期甲减引起身材过矮及骨骺闭合延迟。
影响其他组织功能
胃肠蠕动和消化吸收功能受TH的影响。甲亢时,胃肠蠕动加速,胃排空增快,肠吸收减少,甚至出现顽固性吸收不良性腹泻。相反,甲减时出现腹胀和便秘。TH过多或过少均可导致贫血,但两者的发病机制有所不同。甲减时,由于胃肠的消化吸收功能下降、食欲不振、胃酸缺乏、骨髓造血活力降低或伴月经过多等而发生贫血。甲亢可伴有轻度贫血,白细胞总数常降低,嗜酸性粒细胞和单核细胞相对增高,但血小板的量和功能正常。TH调节多种垂体激素的合成和分泌。甲状腺功能低下儿童GH正常,但对GH兴奋试验的反应性降低。TH还通过直接和间接作用下调TSH。T3可下调泌乳素mRNA。TH过多女性常有月经稀少,周期延长甚至闭经,男性多阳痿,偶见乳腺发育。早期促进肾上腺皮质功能,血ACTH、皮质醇及24小时尿17-OHCS升高。
过多会引起多器官功能障碍
TH的这些作用是由于T3调节心脏特异基因表达和影响血流动力学的结果,也与TH的β-肾上腺素能样作用有关,增加a-肌浆蛋白重链基因(a-MHC)、苹果酸基因、Ca2+-ATP酶基因、Na+/K+-ATP酶基因和心钠素基因表达,同时降低β-肌浆蛋白重链基因(β-MHC)表达。TH具有β-肾上腺素能样作用,使肾上腺素能受体表达增加,这种作用在TH过多时表现的较突出。例如,甲亢时的心动过速、心悸、出汗、不耐热、脉压增大、第一心音亢进、手抖及部分眼征均与TH的这一作用有关。一些抗心律失常药物(如胺碘酮等)可拮抗T3对基因的表达诱导作用。在低温体外循环手术及心肺移植术中和术后,T3缺乏可严重影响手术成功率,约80%的心脏供体有T3缺乏,这是移植后心功能不全的重要原因之一。用0.6μg/kg体重的T3静注可明显改善心肌的无氧代谢,提高心脏移植成功率。T3、T4直接作用于心脏血管平滑肌,扩张冠状动脉。
过量TH可引起一系列临床表现,除病因本身和自身免疫因素外,甲亢的其他临床表现主要是由过量TH和伴发的β-肾上腺素能样作用引起的,可总结如下表。
甲亢对机体的影响
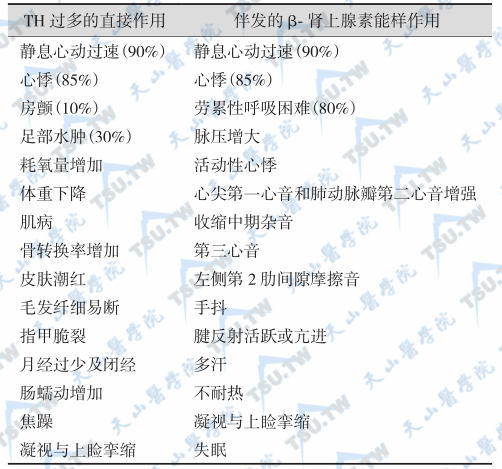
注:括号内百分数为发生率;心悸和心动过速是TH和β-肾上腺素能样作用的综合结果
