继发性甲状旁腺功能亢进症(secondary hyperparathyroidism,SHPT,简称继发性甲旁亢)是指在慢性肾病、肠吸收不良综合征、Fanconi综合征、肾小管性酸中毒、维生素D(VD)缺乏或抵抗以及妊娠、哺乳等情况下,甲状旁腺长期受刺激而分泌过量PTH的一种慢性临床综合征;除原发病外,甲状旁腺增生并出现甲旁亢骨病(骨质软化、骨质硬化、骨质疏松、纤维囊性骨炎、肾石病等)甚至动脉钙化与钙化性小动脉病(calcific arteriolopathy,CAP,calciphylaxis)。本节重点介绍慢性肾衰引起的继发性甲旁亢。其病理与发病机制如下:
继发性甲状旁腺增生存在三种病理类型
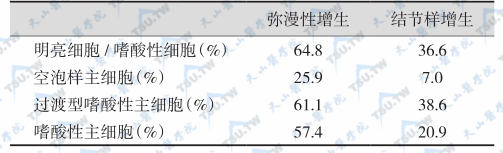
总结300例SHPT的病理资料,其典型改变是甲状旁腺非对称性肿大、结节形成和嗜酸性细胞数目增加。甲状旁腺增生可能存在形态各异而本质相同的3种类型,即结节样增生、弥漫性增生与中间过渡型增生。结节样增生较弥漫性增生更常见,腺体中至少有一个边界清晰而主要含间质细胞且基本没有脂肪细胞的结节;大者超过5g,小者可在60mg以下,平均重约1.6mg。在弥漫性增生组织中,脂肪细胞的比例约为65.3%(结节性增生的比例约35.2%)。偶尔,还可见到介于弥漫性与结节性增生之间的中间过渡型增生灶,结节样增生与弥漫性增生的比较见下表。
继发性甲旁亢和甲状旁腺结节样增生与弥漫性增生的比较
慢性肾病所致的甲状旁腺增生与病情及血透时间相关。通常不容易将结节与增生组织明确区分,可能是由于大多数结节都是在增生的基础上发展而来的。三发性甲旁亢则是在结节样增生的基础上形成单克隆自主功能性结节所致。
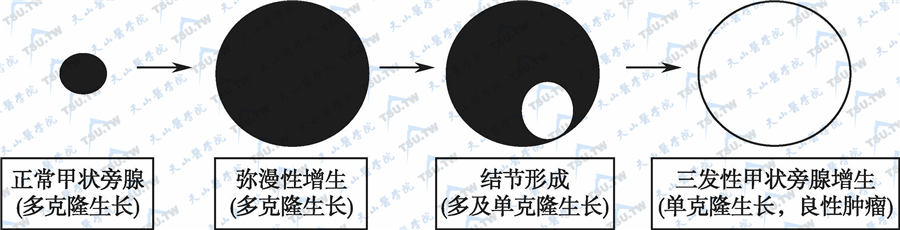
三发性甲旁亢的病理变化过程
引起甲状旁腺主细胞增生及PTH分泌增加的主要因素是低钙血症,SHPT的发病因素及其对机体的作用一般是可逆的(如肾移植后)。慢性肾衰初期的生化改变主要包括低血钙、高血磷、肠钙吸收减少。然而,慢性肾衰最早测得的异常是血清PTH增高及肾小球滤过率(GFR)降低,这些变化发生在血清钙磷改变之前。随着病情的演进,继而发生VD缺乏、ALP增加及纤维囊性骨炎,血清PTH水平则进一步增高。
多种因素刺激甲状旁腺分泌过多PTH
慢性肾病所致的SHPT主要有5种病理生理改变:①高磷血症;②低钙血症(主要表现为血清钙离子偏低);③活性VD缺乏;④高PTH血症;⑤PTH抵抗(不敏感)。慢性肾病所致SHPT的发病机制见图2-4-12。
VD和钙缺乏
因VD和钙摄入不足或利用障碍等而导致低钙血症,后者引起甲状旁腺增生和PTH分泌增多。常见于下列情况:
- 摄入不足和需要量增多:多见于妊娠、哺乳期;
- 钙吸收障碍:胃切除术后、脂肪泻、肠吸收不良综合征、短肠综合征以及影响消化液分泌的肝、胆、胰疾患;
- VD合成不足:肾小球肾炎、肾盂肾炎、肾小管酸中毒或先天性缺陷的VD依赖性佝偻病等,因1α-羟化酶活性不足引起VD活化障碍;
- 药物:许多药物可引起钙、磷代谢紊乱和SHPT,其中主要有缓泻剂、考来烯胺(阴离子交换剂)、苯巴比妥、二膦酸盐、锂盐等;
- VD受体(VDR)基因型异常:甲状旁腺细胞表面VDR数目减少,导致甲状旁腺细胞对VD有抵抗继而发生SHPT;
- 慢性肾衰与长期透析:在透析过程中补钙不足或摄入磷过多;
- 肾移植后:肾移植后发生持续性SHPT的严重程度一般与患者肾移植前SHPT病情及VD基因类型有关。慢性肾病VD缺乏的发生机制见下图。
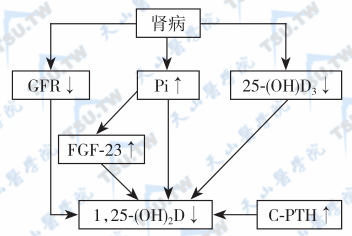
慢性肾病VD缺乏的发生机制
高磷血症
慢性高磷血症(hyperphosphatemia)是慢性肾病所致SHPT的最重要因素,可导致血钙降低,刺激甲状旁腺增生。慢性肾脏病变时,肾单位进行性丧失,发生磷潴留,血清磷增高,伴随血清离子钙相应降低,引起PTH代偿性分泌增加,从而使肾小管重吸收磷(tubular reabsorption of phosphate,TRP)降低。磷可被认为是尿毒症中的一种毒素,可损害多种组织(肾脏、心脏、血管、神经、骨骼、甲状旁腺等),导致软组织钙化、动脉硬化和心血管病变。慢性肾病患者由于血磷升高和1α-羟化酶活性减弱而使血1,25-(OH)2D降低,并因血钙下降引起继发性甲旁亢。后者是心血管钙化的重要危险因素。随着肾衰加重,VD不足、小肠钙吸收异常也更加明显。低镁血症在使用低镁透析液的肾衰患者中常见,也是诱发继发性甲旁亢的重要原因。肌酐清除率低于40ml/ min者均有不同程度的继发性甲旁亢,而末期肾衰者用常规透析很难维持血磷正常,也不能纠正继发性甲旁亢、维生素D抵抗和低钙血症。慢性肾衰致继发性甲旁亢的发病机制见下图。
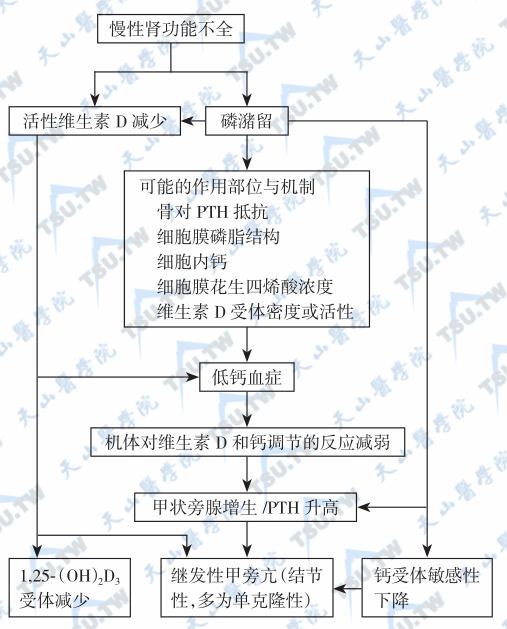
慢性肾衰致继发性甲旁亢的发病机制
高磷血症损害肾脏功能的另一个例子是急性磷酸盐肾病(acute phosphate nephropathy),急性高磷血症引起的肾损害多发生于使用磷酸盐治疗其他疾病的数小时至数周后。血磷明显升高,磷酸盐沉积于肾小管和肾实质组织中,导致弥漫性肾间质病变。有的患者发病较缓,虽然症状较轻,血钙磷亦可正常,但肾损害却相当明显。
PTH抵抗或钙受体异常
PTH抵抗引起假性甲旁减;PTH效应器官的靶细胞对PTH缺乏反应或反应减弱,导致血钙过低、血磷增高,进而加重甲状旁腺增生。
其他原因
能引起继发性甲旁亢的其他原因很多,主要有:①肾小管性酸中毒与低血磷性骨软化症;②长期使用糖皮质激素;③甲状旁腺功能低下母亲引起产后新生儿SHPT;④长期大量应用降钙素及甲状腺髓样癌分泌大量降钙素;⑤PTH降解受损;⑥低镁血症;⑦氟中毒;⑧绝经后(病因未明)。
动脉钙化与钙化性小动脉病见于慢性肾病和其他疾病
动脉钙化分类
一般来说,动脉硬化(arteriosclerosis,AS)是指动脉壁(肌层)硬化,主要包括动脉粥样硬化(atherosclerosis,AS)和动脉钙化(arteriosteogenesis,arteriocalcification)两种。动脉钙化属于动脉硬化中的特殊类型,一般包括动脉中层钙化(medial arterial calcification,MAC)和动脉全层钙化(full arterial calcification,FAC)。
动脉钙化亦见于动脉粥样硬化病变中或与后者合并存在。与动脉钙化不同,动脉粥样硬化中的钙化病灶可分为动脉粥样硬化斑块钙化(atherosclerosis with plaque calcification,最常见)、动脉粥样硬化伴血管内膜钙化(atherosclerosis with endomembrane calcification,常见)、动脉粥样硬化合并动脉钙化(常见)、动脉粥样硬化合并动脉中层钙化(atherosclerosis with medial arterial calcification,少见)等类型。
钙化性小动脉病CAP
又称为钙化性尿毒症性小动脉病(calcific uremic arteriolopathy,CUA),是动脉钙化的严重并发症。本症最先由Hans Selye 于1962年提出,用于描述试验动物模型因全身性“过敏反应”而导致的软组织和血管钙化。文献报道的大多数CUA是终末期肾病和肾移植的并发症。但是除尿毒症外,CUA还可见于许多非尿毒症疾病,因此,将CUA称为CAP似乎更恰当。动脉钙化与CAP的发病机制未明。老年人和糖尿病患者的血管钙化很常见,但进展为CAP者罕见,说明在动脉钙化进展为CAP的过程中,机体对前纤维化/前炎症/前血栓状态有很强的抑制能力,但这些因素的性质未明。引起动脉钙化和CAP的危险因素主要包括:①致敏因素:高PTH血症(原发性甲旁亢、继发性甲旁亢、三发性甲旁亢)、大剂量维生素D、食物中钙与磷过多;②诱发因素:创伤、铁剂、糖皮质激素、高血糖症、高同型半胱氨酸血症、β2-微球蛋白升高、氧化型LDL-C、HDL-C降低等。此外,CAP可见于任何原因所致的血钙磷乘积升高、尿毒症、非特异性慢性肾病、糖尿病肾病或恶性肿瘤等。
由于脂毒性是CAP的重要发病因素,因而脂肪因子与血管钙化和CAP的关系值得研究。研究发现,脂联素(网膜素-1,omentin)是防止脂毒性的自身保护因子,也是动脉钙化与CAP干预的可能靶点,外源性脂联素和网膜素-1有防治动脉钙化作用。
