多囊卵巢综合征的发病机制未明,公认的事实是:①高LH伴正常或低水平FSH;②雄激素增多;③恒定的低雌激素水平(E1比E2高);④胰岛素抵抗(高胰岛素血症);⑤卵巢存在多个囊性卵泡和间质增生。一般认为,精神刺激、家族性多毛、学龄期肥胖、下丘脑功能紊乱和月经早现是多囊卵巢综合征的高风险因素。
遗传因素导致多囊卵巢综合征
多囊卵巢综合征的病因与遗传因素和下丘脑-垂体-卵巢轴功能失常及肾上腺皮质功能紊乱有关。少数患者有性染色体或常染色体异常,有些有家族史。近来发现,CYP11A基因和胰岛素基因变数串联重复序列(variable number tandem repeat,VNTR)与多囊卵巢综合征发生有关,进一步肯定了遗传因素在多囊卵巢综合征发病中的作用。据报道,有的多囊卵巢综合征呈X-性连锁显性或常染色体显性遗传,血LH升高,FSH正常或降低,LH/ FSH≥2~3,静脉注射GnRH后LH出现过度反应。
暴露于宫内高雄激素环境的雌性动物容易发生不排卵、不育和多囊卵巢。GnRH对E2的负反馈作用失敏而导致LH升高;在羊的胚胎实验中,羊胚有卵泡抑素(fallistatin)-激活素(activatin)-抑制素(inhibin)系统失调。表现为fallistatin表达增多,activatin B活性减低,卵泡生长发育有缺陷;LH释放增多,导致雄激素释放增多。动物胚胎在妊娠中即已为生后发生多囊卵巢综合征做好了准备。但人胚在妊娠过程中是否也是如此,则难以证实。
下丘脑-垂体-卵巢轴功能失常导致多囊卵巢综合征
其特点是:①原发性下丘脑-垂体功能失调,在下丘脑中多巴胺能和阿片肽能神经对GnRH神经元的抑制作用失控导致LH分泌增加。②雌激素的反馈抑制异常。非周期性腺外转化而来的雌激素(雌酮E1)导致对LH分泌的正反馈和对FSH分泌的负反馈抑制。③LH刺激卵泡细胞增生,产生大量雄激素,雄激素不能全部转化成雌激素,进一步增加腺外芳香化E1的生成。过多雄激素使卵泡闭锁、卵巢包膜纤维化和包膜增厚。④由于缺乏月经周期中期LH峰值,出现排卵障碍。⑤多囊卵巢综合征患者的卵巢分泌“抑制素(inhibin)”,抑制FSH分泌,影响卵泡的发育成熟,出现较多囊状卵泡。⑥高胰岛素血症和增高的IGF使LH分泌增多。⑦肥胖多囊卵巢综合征患者的血LH不增高,这是因为LH的分泌频率为无排卵型,而LH分泌脉冲相对正常,使LH的分泌总量正常甚或降低。因而,多数多囊卵巢综合征患者血LH升高,但亦可正常或降低。故LH/FSH比值升高支持多囊卵巢综合征的诊断,但比值正常不能排除其诊断。
LH明显升高
多囊卵巢综合征患者血LH升高,而FSH正常或降低,静脉注射GnRH后LH可呈现过度反应。在下丘脑中,多巴胺能和阿片肽能神经对GnRH神经元的抑制作用失控可导致LH分泌增加,也可能是雌激素的反馈抑制异常所致。下丘脑GnRH的刺激频率部分取决于促性腺物质内合成LH与FSH的相对比例。下丘脑GnRH脉冲频率的增加有利于LHβ亚单位的转录,而不利于FSHβ亚单位的转录。由于多囊卵巢综合征似乎有LH脉冲频率的增加,因此,推断多囊卵巢综合征中的GnRH脉冲频率可能加速,但尚不清楚这种脉冲频率是否由GnRH脉冲频率发生器的内在异常所致,还是由排卵事件减少引起的孕酮水平相对较低所致。由于各种孕酮可延缓GnRH脉冲发生器,因此多囊卵巢综合征患者的低血液循环孕酮可能导致GnRH脉冲加速,继而LH升高和卵巢雄激素生成过量。
FSH持续低分泌
FSH持续低分泌使卵泡难以成熟。多数卵泡的直径为2~10mm,少数可达15mm。卵泡膜细胞增生伴黄素化,在高水平LH的刺激下,产生过量的睾酮和雄激素的前体物质。双侧卵巢增大/卵泡增多伴卵泡膜细胞增生和包膜增厚。卵巢体积可达正常的2~4倍,表面皱褶消失,平滑,呈灰白色,富含血管,包膜肥厚,包膜下有多量大小不等的卵泡,最大直径可达1.5cm,囊壁薄,囊泡周围的卵泡膜细胞增生伴黄素化,包膜增厚则是长期不排卵的结果,包膜厚度与血LH水平及男性化程度呈正相关。卵泡膜细胞增殖症(hyperthecosis)是多囊卵巢综合征的一种重症类型,其病理特征是间质组织(stromal tissue)显著增生,在间质的成纤维细胞层中散布有大量的黄体化膜样细胞(luteinized theca-like cells)。
E1/E2比值增高
多囊卵巢综合征患者非周期性雌酮(E1)明显增多,E1/E2比值增高(正常E1/E2≤1),特别是肥胖者的脂肪多,芳香化酶活性高,外周组织转换增多,E1可更高,而且来源于外周组织的E1不受垂体促性腺激素的调节,无周期性变化。非周期性腺外转化而来的雌激素(E1)将导致对LH分泌的正反馈和对FSH分泌的负反馈抑制。LH刺激卵泡膜细胞增生,产生大量雄激素,雄激素不能全部转化成雌激素,进一步增加腺外芳香化E1的生成。过多雄激素使卵泡闭锁、卵巢包膜纤维化和包膜增厚。由于缺乏月经周期中期的LH峰值,出现排卵障碍。此外,有人发现多囊卵巢综合征患者的卵巢也可能分泌抑制素,抑制FSH的分泌,影响卵泡的发育成熟,出现较多囊状卵泡。研究发现高胰岛素血症和增高的胰岛素样生长因子(IGF)也可使LH分泌增多。
瘦素分泌增多
肥胖妇女的瘦素分泌增多,瘦素也可直接影响卵巢激素的分泌,从而对生殖功能起重要作用。瘦素还可反馈抑制下丘脑NPY表达和NPY的分泌,解除NPY 对LH的抑制,促使LH大量释放。有研究发现,在多囊卵巢综合征妇女中,可溶性瘦素受体水平下降使瘦素作用下降,推测多囊卵巢综合征本身可引起瘦素抵抗。
高雄激素血症抑制卵泡发育
绝经前,卵巢分泌的睾酮占总量的25%;肾上腺皮质分泌者占25%,由外周雄烯二酮转化而来的睾酮占50%。循环中97%~99%的雄激素与SHBG结合,少量(<2%)呈游离状态,其代谢清除率受SHBG结合力的影响。与SHBG结合的雄激素不参加外周组织代谢转化。高雄激素血症(hyperandrogenemia)使卵巢颗粒细胞早期黄素化而不能排卵,故长期注射丙酸睾酮等雄激素药物可致闭经、毛发增多及痤疮。高雄激素血症常见于多囊卵巢综合征和先天性肾上腺皮质增生。在多囊卵巢综合征中,睾酮和雄激素的前体(DHEAS、DHEA、雄烯二酮、17-OHP和雌酮)生成增多,而性激素结合球蛋白(SHBG)减少,游离雄激素增多,活性增强。过多的雄激素主要来源于卵巢。LH脉冲频率及振幅升高,刺激卵泡膜细胞(theca cells)及间质细胞增生(interstitial cell hyperplasia)和雄激素生成。FSH调节卵巢颗粒细胞的芳香化酶活性,从而决定雄激素前体合成多少雌激素。当LH较FSH相对升高时,卵巢优先合成雄激素。多囊卵巢综合征患者的卵巢膜细胞能更有效地将雄激素前体转换为睾酮。但是,少数患者的临床高雄激素血症很明显,而血清睾酮可稍升高或正常;其原因是:①睾酮不是多囊卵巢综合征中的主要雄激素;②睾酮总量因SHBG降低而正常或仅轻度升高;③肝脏和外周组织转化成大量去氢表雄酮及其硫酸盐。
高胰岛素血症和肥胖促进多囊卵巢综合征发展
胰岛素抵抗与高胰岛素血症
多囊卵巢综合征患者不论有无肥胖,都有不同程度的胰岛素抵抗与高胰岛素血症。研究表明,高胰岛素血症及胰岛素抵抗可能在多囊卵巢综合征起病中起关键和早期作用。增高的胰岛素可通过其垂体附近的受体促进LH释放,并可直接增强卵巢卵泡内膜细胞17α-羟化酶作用,雄激素合成增多;胰岛素与IGF-1通过IGF-1受体作用于卵泡膜细胞,可协同LH刺激卵巢卵泡膜细胞雄激素合成,同时还抑制肝脏合成SHBG,使游离睾酮升高。应用胰岛素增敏剂能明显降低LH及雄激素水平,改善症状。
大约有半数多囊卵巢综合征患者的发病与胰岛素受体丝氨酸磷酸化缺陷有关。胰岛素受体丝氨酸磷酸化可抑制胰岛素受体活性,促进P450C17A的17,20-链裂酶活性。据报道,多囊卵巢综合征患者卵泡内膜细胞存在胰岛素受体底物-2(IRS-2)过度表达,从而影响胰岛素的信号转导。此外,胰岛素基因的VNTR 是多囊卵巢综合征的一个主要易感位点(特别是排卵性多囊卵巢综合征)。
肥胖与脂毒性
脂肪组织膨胀(adipose tissue expandability)假说(下图)认为,皮下脂肪组织的膨胀是有限的,并受遗传和环境因素的调节。只要脂肪沉积适应能量的正常供应,那么就不会产生异常代谢,但只要超过某个“代谢选点(metabolic setpoint)”——代谢临界线,更多的脂肪将沉积于非脂肪组织中,并导致胰岛素抵抗。皮下脂肪过度充盈扩张产生脂毒性(lipotoxicity),表现为游离脂肪酸升高,高甘油三酸血症和脂肪因子谱紊乱(高分子量脂联素降低,而IL-6和TNF-α升高),使脂质沉积于非脂肪组织(肝、肌肉、胰腺等)。脂毒性对多种代谢有不利影响,特别容易抑制胰岛素的作用,引起高胰岛素血症。
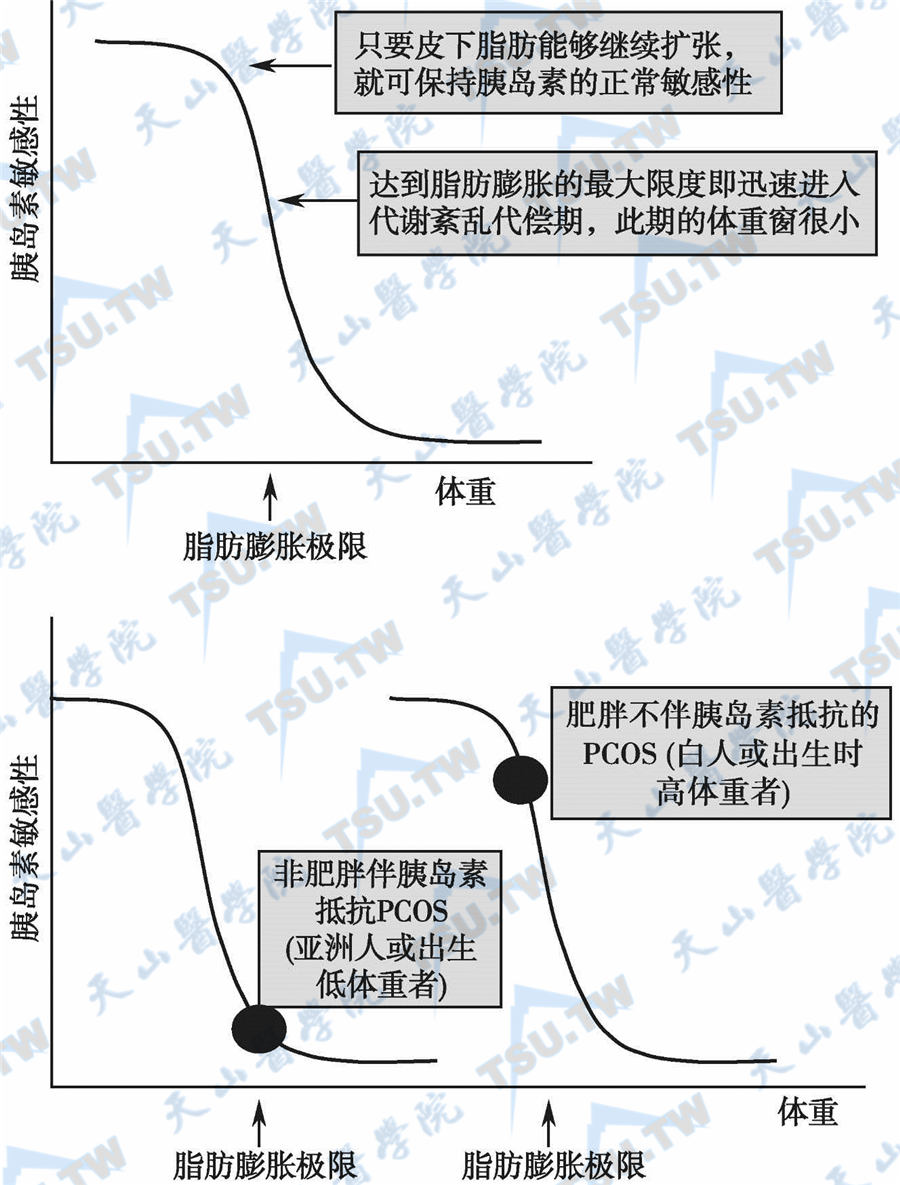
脂肪组织膨胀假说
在多囊卵巢综合征患者中,慢性能量代谢正平衡导致肥胖,并不断消耗脂肪贮存能力,引起代谢并发症,其大致的发生过程是:肥胖(原发因素)→高胰岛素血症(继发后果)→高雄激素血症(三发后果)。达到脂肪膨胀极限是发生多囊卵巢综合征的关键点,在有限的皮下脂肪贮存量前提下,膨胀极限和多囊卵巢综合征的发生主要由出生体重和肥胖程度两个因素决定:①如果肥胖发展速度快,而出生时为低体重儿,那么可能在进入青春期发育前或青春期的早期即出现高胰岛素血症和高雄激素血症,进而引起多囊卵巢综合征;②如果出生时为高体重(代表脂肪细胞数目较多),虽然已经发生了超重或肥胖,但因为这些个体的脂肪膨胀余地较大,不至于发生严重的胰岛素抵抗和高雄激素血症。
综上所述,肥胖对多囊卵巢综合征的影响是:①通过炎症引起卵巢功能紊乱;②肥胖引起不排卵、妊娠并发症和受孕失败;③肥胖使多囊卵巢综合征的药物疗效降低;④减肥治疗后能诱发排卵,但减肥治疗应先于排卵诱导治疗。
脂肪组织性激素转换
17β-羟类固醇脱氢酶(17β-HSD)与芳香化酶的比例参与调节脂肪局部性激素水平,是影响肥胖和体脂分布的重要因素。绝经前妇女多出现以皮下脂肪增多为主的下身肥胖,而男性和绝经后女性主要为内脏脂肪增多的上身肥胖。内脏脂肪增多是胰岛素抵抗、代谢综合征的重要危险因素。脂肪组织特异性糖皮质激素代谢主要由11β-HSD1完成。11β-HSD1催化无活性的皮质酮转化为活性形式的皮质醇。11β-HSD1在脂肪组织,特别是内脏脂肪表达量高。组织特异性11β-HSD1所引起的糖皮质激素代谢失调常见于肥胖、糖尿病、高血压及高血脂,心血管疾病和多囊卵巢综合征等。多囊卵巢综合征的发病机制可总结如下图所示:
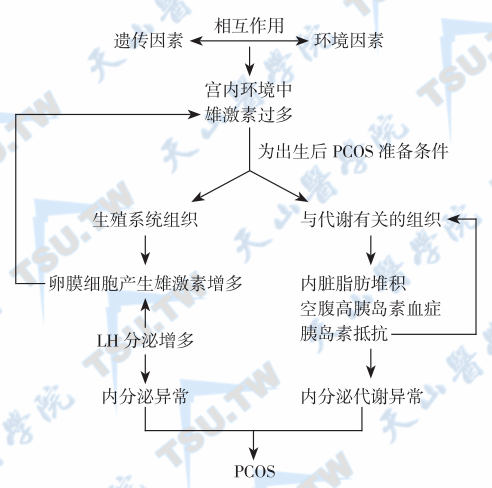
多囊卵巢综合征发病机制
