机体的降糖机制远弱于升糖机制。诱发糖调节激素分泌的血糖浓度称为糖调节激素分泌阈值。调节血糖的激素可分为两类:一类是降血糖激素(主要是胰岛素);另一类是升血糖激素(胰岛素拮抗激素),主要包括胰高血糖素、肾上腺素、生长激素(GH)和皮质醇等。血糖在正常范围内下降时,胰岛素的分泌即明显减少,当血糖进一步降至正常范围以下而未产生低血糖症和脑功能障碍时,血胰高血糖素和肾上腺素开始升高,其他糖调节激素分泌的血糖阈值和抑制胰岛素分泌和增加抗胰岛素激素分泌的血糖阈值见下图。

抑制胰岛素分泌和增加抗胰岛素激素分泌的血糖阈值
注: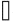 、
、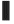 和
和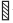 分别代表不同的研究结果
分别代表不同的研究结果
胰岛素降低血糖
胰岛素由胰岛β细胞分泌进入门静脉。胰岛素刺激肝脏和外周组织摄取、贮存和利用葡萄糖,增加糖原合成,抑制糖原分解,抑制或减少葡萄糖异生,减少内生性葡萄糖来源,防止血糖升高。空腹状态时,胰岛素抑制肝糖生成。进食后,外源性葡萄糖进入血液循环,血糖升高,刺激β细胞分泌胰岛素,后者促进组织对葡萄糖的利用。胰岛素分泌受许多因素的影响,其中最重要的因素是血糖浓度。外源性胰岛素降低血糖的作用很强,而且其降糖效应与基础血糖水平无关。胰岛素的作用机制和对血糖的调节可搜索相关篇幅。
GH/IGF-1/IAPP类似物有急性降血糖作用而GLP-1降低高血糖
GH
GH的胰岛素样降血糖作用仅在急性使用外源性GH时出现,可能主要与GH促进IGF-1生成和糖利用有关。相反,长期应用GH制剂引起糖耐量低减,而分泌GH的垂体瘤可引起继发性糖尿病。
IGF-1
某些肿瘤(胰岛素瘤除外)可伴有低血糖症,主要与IGF-1分泌过多或肿瘤细胞表达过量IGF-1受体有关。临床应用IGF-1治疗各种疾病时易发生低血糖症,低血糖程度与使用剂量有关。IGF-1增加糖利用的机制主要是IGF-1作用于IGF-1受体和胰岛素受体所致。另外,IGF-1可负反馈抑制GH的释放,降低血液中GH水平,改善胰岛素的敏感性。
胰淀粉样多肽
又称胰淀素(amylin),它是胰岛β细胞分泌的含37个氨基酸残基的多肽,其氨基酸序列与降钙素基因相关肽(CGRP)有44%同源,而与降钙素和肾上腺髓质素(adrenomedullin,AM)20%同源,餐后释放入血的量与食物量呈比例,每日血浆浓度变化对应于胰岛素变化,空腹时约为4pmol/L,餐后约为25pmol/L,其受体在中枢神经系统高度表达,具有抑制胰高血糖素分泌、延缓胃排空、产生饱感及增加糖利用的作用。糖尿病患者缺乏amylin,用amylin类似物普兰林肽(pramlintide)辅助胰岛素治疗2型糖尿病(T2DM)或1型糖尿病(T1DM),可降低餐后高血糖,减轻体重,减少低血糖事件发生。
肠促胰素
肠促胰素主要包括葡萄糖依赖性胰岛素释放肽(抑胃肽)(glucose-dependent insulinotropic polypeptide,GIP)和胰高血糖素样肽-1(glucagon-like peptide- 1,GLP-1)。GIP主要由十二指肠和空肠上段的K细胞分泌,GLP-1是由肠道L细胞分泌。肠促胰素可刺激胰岛β细胞增殖、分化和减少β细胞凋亡,增加β细胞数量,具有葡萄糖依赖性促胰岛素分泌作用。其中,GLP-1具有延缓胃排空、抑制胰高血糖素分泌和降低食欲的作用。肠促胰素的这些生物学活性特征有利于T2DM治疗。但是,血循环中的GIP和GLP-1很快被二肽基肽酶-4(dipeptidyl peptidase-4,DPP-4)降解,其半衰期在人体内仅数分钟,这就极大地限制了其临床应用。人们从两个角度解决了其半衰期短的问题:一是研制了不易被DPP-4降解的GLP-1类似物,如艾塞那肽和利拉鲁肽(liraglutide);二是DPP-4抑制剂,如西格列汀和维格列汀。目前临床使用的GLP-1类似物都是多肽物质,口服无效。近期有学者筛选出非肽类GLP-1受体激动剂,为今后口服给药提供了可能,但尚未进入临床试验阶段。
胰高血糖素/肾上腺素/GH/皮质醇/肾上腺髓质素升高血糖
胰高血糖素
胰高血糖素与胰岛素在许多方面有相反的代谢作用。胰岛素/胰高血糖素分子比升高能促进糖原、脂类及蛋白质合成;分子比降低则促进分解代谢,如糖原分解、糖异生、脂肪分解及生酮作用等。正常情况下以胰岛素的作用占优势,而在胰岛素绝对或相对不足时,胰高血糖素的作用相对增强。胰高血糖素具有强大的升血糖作用,具体机制有:
- 抑制6-磷酸果糖激酶-2,激活果糖二磷酸酶-2,减少2,6-二磷酸果糖合成,糖酵解途径被抑制,糖异生加速;
- 促进磷酸烯醇式丙酮酸羧激酶合成,抑制肝细胞丙酮酸激酶活性,加速肝细胞摄取氨基酸,促进糖异生;
- 激活肝细胞膜受体依赖cAMP蛋白激酶,抑制糖原合酶,激活磷酸化酶,使肝糖原分解,血糖升高;
- 激活脂肪酶,加速脂肪酸动员,间接升高血糖。
血糖降低时,胰岛α细胞分泌胰高血糖素增多,在几分钟内即可促进肝糖原和脂肪分解,糖异生增加,葡萄糖生成增多,血糖上升;其作用迅速,但作用时间短暂(约90分钟),因为升高了的血糖可刺激胰岛素分泌,胰岛素和高血糖反过来又抑制胰高血糖素分泌,血糖倾向于下降。
肾上腺素
肾上腺素通过β2肾上腺素能受体促进糖原分解和肝糖异生,直接升高血糖;肾上腺素亦通过α肾上腺能受体促进肝糖生成,但作用较弱。肾上腺素间接升高血糖的作用主要是通过α肾上腺能受体抑制胰岛素分泌,其次是β肾上腺素能受体刺激胰高血糖素释放。肾上腺素对糖代谢的作用机制见下图。
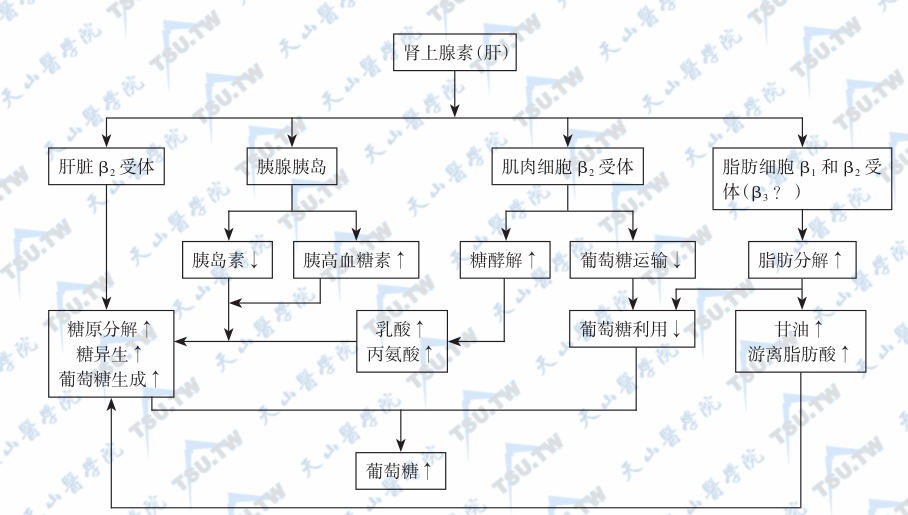
肾上腺素升高血糖的机制;注:↑:升高;↓:下降
GH和皮质醇
GH具有升高和降低血糖的双向作用。最初,GH具有类胰岛素作用,降低血糖;几小时后才表现出升高血糖作用。皮质醇升高2~3小时后,血糖开始升高,是保证基础状态不发生低血糖症的重要因素。急性低血糖是一种化学性应激,可兴奋下丘脑-垂体-肾上腺皮质轴,促进皮质醇分泌。
肾上腺髓质素
肾上腺髓质嗜铬细胞能分泌一种由52个氨基酸残基组成的单链多肽,称为肾上腺髓质素(adrenomedullin,AM)。在胰腺中,AM主要由胰岛周边的F细胞表达,F细胞同时也表达胰多肽。离体实验表明AM呈剂量依赖性抑制大鼠胰岛β细胞分泌胰岛素,故可升高大鼠的血糖。Katsuki等对18名2型糖尿病患者和19名正常人行高胰岛素正糖钳夹实验,结果显示:急性高胰岛素血症可引起2型糖尿病患者血浆AM迅速分泌,胰岛素增加率与AM增加率呈显著正相关关系,正常人无此现象发生。短期输注大量外源性胰岛素可引起低血糖,此时体内交感神经系统激活可能促进肾上腺髓质和胰岛F细胞分泌AM。AM一方面抑制内源性胰岛素分泌从而升高血糖,另一方面对抗胰岛素收缩血管效应,减轻高胰岛素血症对血管内皮细胞损害。故AM参与了人体内的应急反应,在一定程度上对抗了胰岛素引起的低血糖和高血压。
肾上腺髓质素前体N端20肽(proadrenomedullin N-terminal 20 peptide,PAMP)与AM来自同一个前体,具有升高血糖的作用,其机制有:①以自分泌和旁分泌方式抑制胰岛β细胞分泌胰岛素;②激活β肾上腺能活性,增加胰高血糖素分泌;③与中枢神经细胞抑胃肽受体结合,竞争性抑制抑胃肽降血糖作用。
其他因素调节血糖水平
交感/副交感神经调节
低血糖可刺激交感和副交感神经节后神经元释放去甲肾上腺素和乙酰胆碱。交感神经递质去甲肾上腺素有升血糖作用,其作用机制未明。电刺激人和动物肝脏交感神经,肝糖原分解,肝糖释放增多,血糖升高。副交感神经的作用与此相反。
葡萄糖生成自身调节
高血糖抑制而低血糖刺激葡萄糖生成,其调节包括激素依赖性和非激素依赖性两种途径。当糖异生被急性刺激或抑制时,葡萄糖生成并无变化,这说明糖的生成有自身调节机制参与。葡萄糖激酶基因突变的实验表明,自身调节的关键因素是葡萄糖激酶活性的自动调节,T2DM及急性重症疾病时的高血糖状态是葡萄糖自身调节障碍的反映。肾上腺髓质在无神经支配条件下,当局部血糖浓度下降时,可通过旁分泌和自分泌调节,释放较多的儿茶酚胺。骨骼肌细胞含一氧化氮合酶,其中内皮细胞源性的一氧化氮合酶(eNOS)在骨骼肌细胞局部血液供应、离子交换、信号传导以及葡萄糖氧化还原过程中,发挥了关键的调节作用。
细胞调节
细胞对血糖的利用是调节血糖浓度的重要环节。细胞对葡萄糖的摄取(利用)可分为胰岛素介导性葡萄糖摄取(insulin-mediated glucose uptake,IMGU)及非胰岛素介导性葡萄糖摄取(non-insulin-mediated glucose uptake,NIMGU)两种。IMGU和NIMGU在空腹状态和进食状态下的相对比例不同,因而空腹状态的高血糖和低血糖原因与吸收后状态的高血糖及低血糖发生机制亦不相同。空腹状态下,不管血糖浓度如何,血糖廓清均以NIMGU途径为主。如葡萄糖的生成少于清除,尽管IMGU不增加(胰岛素水平和作用正常),仍可发生低血糖症(如肝、肾衰竭和糖异生障碍等)。餐后的葡萄糖利用主要发生于骨骼肌和肝脏,如胰岛素分泌过多或组织对糖的利用增加(如剧烈运动)亦可引起低血糖症。(周卫东 郭丽娟)
