血钾>3. 3mmol/L的患者一般并不担心应用胰岛素诱发低血钾。当前仍然推荐首先静脉推注0. 1U/kg的短效胰岛素(RI),然后继以静滴0. 1U/(kg·h)的短效胰岛素。有报道应用人胰岛素类似物aspart和lispro皮下注射治疗糖尿病酮症酸中毒,但是应用不广泛,严重患者不宜应用皮下注射治疗。血糖降低太快可能诱发脑水肿,理想的降低血糖速度为50~70mg/h,治疗1小时疗效欠佳者,考虑剂量加倍[静滴0. 2U/(kg·h),宜注意适应证和禁忌证];血糖到达200mg/dl(糖尿病酮症酸中毒),300mg/dl (HHS)时,胰岛素降低到0. 05U/(kg·h),同时应用5%葡萄糖。力争应用微型输液泵提高胰岛素剂量调节的精确度,以便维持血糖150~200mg/dl (糖尿病酮症酸中毒),或者血糖250~300mg/dl(HHS),直到酸中毒、高血渗、神志障碍等恢复正常。高血糖恢复快,而酮血症和酮尿症恢复缓慢;高血渗恢复快,而神志障碍恢复慢。糖尿病酮症酸中毒纠正,一旦患者能够进食,则给予皮下1日多次胰岛素注射(三餐前短或速效胰岛素、睡前胰岛素NPH或glargine)或连续皮下胰岛素泵输注,剂量依据个体化原则选择。但是皮下注射胰岛素的头1~2小时应继续静滴胰岛素,以防复发高血糖和酮症。不能进食者,应该继续静脉胰岛素输液。
基本理论和临床应用
正常人和酮中毒患者的血胰岛素浓度和其效应的关系,见下表:
表1:内源和外源胰岛素浓度和半衰期t1/2

结合表1和表2来理解临床消除酮症:
一、糖尿病酮症酸中毒时宜在NS中输注胰岛素5U/h,到达血糖200~250mg/dl时,仍然可以为重症酮症。要想消酮,必须外源滴入糖5~12. 5g/ h,选择某滴速固定不变;另一静脉通道或经肌注给予RI 3~7U/h。为达到维持血糖200mg/dl左右的目标,宜调节RI滴速。但希望RI在2~3U/h左右,调节滴糖速度来保证它,以便维持有效的血胰岛素浓度来消酮。
二、全天主食大于150g有助于预防饥饿性酮症。糖尿病酮症酸中毒患者尚未能进食者,每小时输糖6~8g左右有类似150g主食的作用。短时间每小时输8g糖可提高RI的消酮必要浓度来维持血糖在200mg/dl左右。这种较高的RI浓度有助于抑酮。这时常需输10%糖。有证据显示:滴注RI的同时滴注10%糖,比5%糖能更快地消酮,乃因控制血糖250mg/dl时所需RI血浓度有所提高。
表2:外周静脉胰岛素浓度、效应、治疗方法

三、糖与RI输注由不同通道输入或注入,才有利于固定一个速度、调整另一个速度。若同一瓶中糖与RI共输则非常不便于糖与胰岛素的分别调节以维持RI滴注2~3U/h左右同时血糖200mg/dl左右。
RI临床应用
国内外各家对糖尿病酮症酸中毒患者RI的应用,至今仍然选用小剂量RI法。但细节存在差别,各有优点,介绍如下。
Kitabchi(1994年Joslin)
①一旦糖尿病酮症酸中毒确诊,RI负荷量为每千克体重0. 3~0. 4U,一半静注一半肌注。每小时静滴RI为5~7U,直到血糖达200mg/dl。同样剂量可以肌注(疗效不好者改肌注为静滴)。若血糖降低值(未说第几小时测定:编者)小于开始血糖值的10%,则每小时重复负荷剂量,直到见效。②血糖达200mg/dl时,静滴5%糖于0. 45%盐水中,每小时100~250ml滴量(即5~12. 5g糖/h),伴每小时3~7U RI静滴或肌注或皮下注射,以维持血糖150~200mg/dl,直到血气HCO3->15mEq,pH> 7. 3。
Sherwin(1996年 )
①典型安排:负荷量RI 0. 1U/kg,继静滴0. 1U/(kg·h),低血压时静滴法最可靠。希望每小时血糖下降约100mg/dl,所以每小时测血糖。血糖下降太快,尤其对于儿童,可引起脑水肿。血糖早期下降原因是尿排出糖,次要的是胰岛素引起的糖利用。②一旦血糖降达250~300mg/dl,应输糖。
Olefsky(1992年)
①在人体,胰岛素达200μU/ml时其效应几乎最大,浓度再增高,几乎没有进一步疗效。胰岛素t1/2为7分钟,必须每30~60分钟静注才能维持最大浓度。而静滴最好,10U/h,输至30分钟时可达到200μU/ml浓度。选静滴法者,应静注10~20U作为负荷量。②极少数患者效差,原因是败血症或胰岛素抗体。头数小时RI静滴,如无明显糖代谢改善(未指出血糖下降值:编者),则静注20~30U,继以静滴更多的胰岛素。③血糖降到约250mg/dl即13. 9mmol/L时,加5%糖静滴。④治疗开始后4~6小时,儿童或青年糖尿病酮症酸中毒患者神志变坏甚至昏迷,通常是由于高血糖与渗透压下降太快。为数不多的尸检证明,这是由于脑水肿。
Marshall(1992年)
①用输液泵保证6U/h胰岛素输注,胰岛素血浓度达约100μU/ml可抑酮。②血糖降达约250mg/dl即13. 9mmol/L时用10%糖代替盐水输注,同时胰岛素滴注4U/h。每小时测血糖以便调节并维持合适血糖。③滴胰岛素2个小时而血糖下降不满意的原因有:液体治疗不充分,未保证滴入6U/h胰岛素。应该改滴12U/h胰岛素。④肌注法也很好。负荷注射20U,随后每小时肌注6~10U。若2小时后血糖下降不满意,而并非由于血压低,则肌注量加倍或改为静滴法。⑤酸中毒和酮症的纠正比高血糖的纠正更慢。所以血糖达约250mg/dl即13. 9mmol/L时,应该滴入葡萄糖以便继续给充分的胰岛素。选10%糖而不是5%糖静滴,能相应提高RI滴速,故能更快地消除酮体。⑥滴注糖的同时,经静脉或肌注给胰岛素应该持续进行,直到患者能进食,同时以皮下注射胰岛素代替静滴或肌注。
Alberti
①肌注20U即刻,以后5U/h,上臂较好。如2小时后血糖不降,改为静滴。②静滴RI 5U/h,2小时无效可加大剂量。血糖降至250mg/dl即13. 9mmol/L后,RI降至3U/h静滴或6U/2h肌注,同时开始静滴5%糖(每升加1. 5g氯化钾)。继续转为常规治疗。
综合各家
见于上述基本理论和临床应用中所说:①把高血糖控制到250mg/dl的方法,似宜遵照Kitabchi和Joslin的方案。②血糖降达250mg/dl时,Joslin倡导输糖5~12. 5g/h伴RI 3~7U/h。糖与RI宜两个静脉通道,以便在保证消酮所需RI滴速2~3U/h左右的条件下,调节血糖达200~300mg/dl左右,直到血气正常。Marshall倡导输10%糖,必须以Joslin方法为基础。所以Joslin的观点最值得借鉴。把Joslin和Marshall的经验糅合为一,于消酮有益。
酮症消除且能进食后的胰岛素治疗
短效和速效(超短效)
胰岛素的不同(表41-3)和选择 短效胰岛素为重组人胰岛素(人regular insulin:人RI),缺此药则应用动物胰岛素(动物regular insulin:动物RI,其商品名有称为“中性胰岛素”者,极易与“中效胰岛素NPH”混淆)代替。速效胰岛素是人胰岛素类似物,包括lispro,aspart,glargine。
对于“非糖尿病酮症酸中毒/非HHS”(非酮症酸中毒或非高血糖高血渗状态)和非妊娠患者,选择皮下注射速效胰岛素(胰岛素类似物),其药物动力学类似胰岛素生理,低血糖可能性减少,优于短效胰岛素。文献证明,对于糖尿病酮症酸中毒/HHA患者,速效胰岛素类似物皮下注射有时可以应用,但是一般仍然选择短效胰岛素静脉滴入。妊娠期糖尿病仍然提倡应用已经积累经验的短效胰岛素。2001~2003年,观察60次糖尿病酮症酸中毒发作患者,符合糖尿病酮症酸中毒诊断:①血糖≥16. 6mmol/L;②静脉血pH<7. 3和(或)HCO3-<15mmol/L,或者尿酮>++者(原文如此:尿酮++竟然代替代谢性酸中毒指标)。30例皮下Lispro 0. 15U/kg每2小时注射;30例常规胰岛素静脉滴入0. 1U/(kg·h)。血糖恢复到248mg/dl时,静脉滴入组需要6小时,皮下组需要12小时;两组均达到糖尿病酮症酸中毒恢复标准,均未发生并发症。其中1例40岁腹型肥胖患者,静滴胰岛素,糖尿病酮症酸中毒病情稳定后,转为皮下胰岛素治疗。出院时的胰岛素方案:睡前85U(剂量如此大:编者)甘精胰岛素(glargine),3餐前30U aspart速效胰岛素类似物皮下注射。
速效胰岛素类似物和短效重组人胰岛素作用时间不同,见下表。
表3 短效和速效胰岛素的制剂及其效应时间的不同
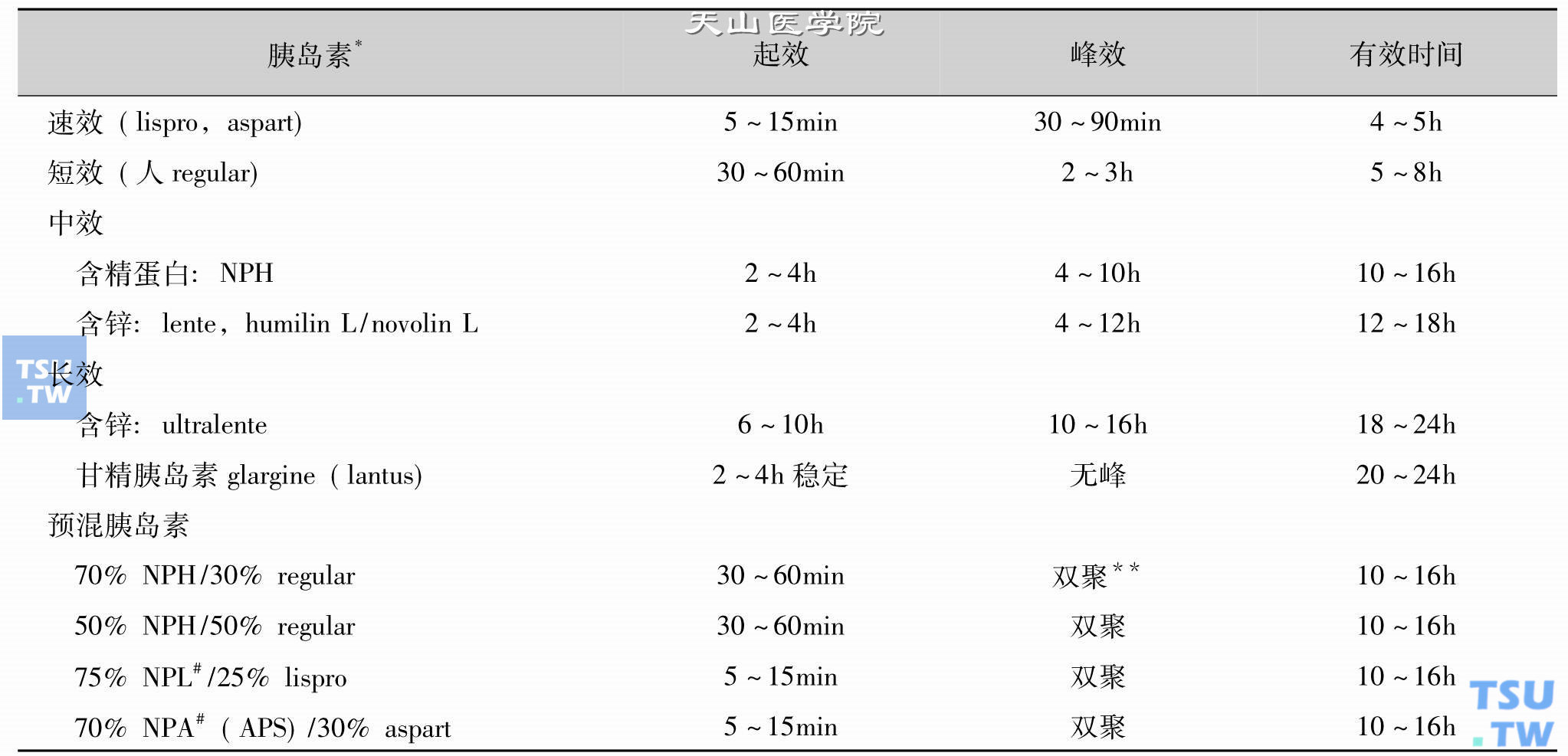
*起效和有效时间变异大,因人而异,同一人因时而异,尤其因注射部位而异。表内时间为每次注射量0. 1~0. 2U/kg。人胰岛素剂量大时,可以形成皮下贮存,疗效持续时间变长而且难于预计。但是胰岛素类似物很少发生这类问题。lispro可能上调胰岛素受体。
#lispro和aspart结合鱼精蛋白的结晶物,形成中性鱼精蛋白lispro和中性鱼精蛋白aspart,简称NPL和NPA(APS),它们不能如同NPH那样的单独应用,仅仅分别用于lispro和aspart的预混液中,在功能上相同于胰岛素NPH的吸收缓慢和作用缓慢,而且效应力度也“有峰”。锌结晶和精蛋白结晶后均减慢胰岛素吸收。
**中效胰岛素的峰效作用和RI的峰效作用互相重叠,使NPH和RI预混的胰岛素的峰效时间后延1小时,峰效幅度增加。动物短效胰岛素(regular insulin:RI),其商品名有称为“中性胰岛素”者,极易与“中效胰岛素NPH”混淆,宜注意。
胰岛素一日注射次数
高血糖治疗主要包括2种:3餐后(肠源)高血糖的治疗、空腹(肝源)高血糖的治疗。提倡模仿胰岛素24小时小量基础分泌和餐后冲击量分泌的生理机制治疗高血糖。
餐后高血糖的治疗
生理机制在于餐时胰岛素冲击量分泌,临床模仿治疗则进行3餐前短效、速效胰岛素注射。被称为“3短”注射。3餐后高血糖的改善、“糖毒”的消除,能够带动夜间肝糖输出异常的逐渐好转。“3短”对于各类严重患者餐后高血糖疗效均好,而且剂量调整方便。它的衍生治疗方法是省略午餐前注射,便于外出不带胰岛素注射设备,仅仅早、晚餐前注射,称为“2短+午餐代理药”:①口服降糖药二甲双胍或阿卡波糖或胰岛素促泌剂短效型。②把NPH等中效胰岛素混入早餐前短效胰岛素中进行1次注射。
空腹高血糖(黎明激素引起夜间肝糖过多入血)的治疗,生理机制在于24小时基础胰岛素分泌。基础分泌量总和大于3餐冲击分泌量的总和。临床模仿治疗则有2种。其一,进行10pm睡前中效胰岛素NPH注射,控制4am~8am(或3am~9am)的高血糖。联合早餐前7am NPH注射则控制11am~5pm的高血糖。夜间高血糖和糖毒的改善能够带动3餐后高血糖的逐渐好转。不提倡把本该睡前10pm注射的中效胰岛素NPH混入晚餐前短效胰岛素,提前到晚餐前6pm注射。其理由:虽然简便了,但是对于多数患者不仅难于控制黎明激素高血糖,而且易于发生夜间低血糖。其二,提倡选择时效线平坦无峰、甚少发生低血糖的甘精胰岛素(glargine),一日1次睡前或早晨注射均可,总量分为2次注射也可。但是甘精胰岛素不可与其他胰岛素混合、需要单独注射,且目前还存在费用负担问题。
小结:胰岛素治疗可以单独“餐前3短”(1日3次)治疗餐后高血糖;单独1次“睡前NPH”(1 日1次;白天应用口服降糖药)治疗夜间高血糖。还可以一日4次(3短+睡前)、2次(“3短”减掉午餐前的短效胰岛素,便于不携带胰岛素注射器具)。
1)1日4次注射(3短+睡前NPH/ glargine):严重病例,存在黎明现象高血糖者,睡前加注胰岛素NPH或Glargine。
2)1日3次注射:3餐前速效或短效胰岛素的注射剂量,开始小量试探3餐前剂量(6-4-5, 8-6-7,或10-6-8U等,依病情而定);然后测定餐前血糖并结合患者本餐食欲,调整本餐餐前短效胰岛素剂量,并于本餐后2小时测定血糖来检验所调整的剂量合适程度。胰岛素类似物lispro、aspart于餐前甚至餐时注射均可比RI更好地模仿进餐后内源性胰岛素作用的时相曲线,及时控制餐后高血糖,且减少迟发的下一餐餐前低血糖风险。
3)一日2次注射:最常用的方案是应用RI 与NPH混合剂,两种药作一次注射,可早餐和(或)晚餐前每天1~2次注射。NPH是中效,所含胰岛素和鱼精蛋白的量相等(也是中性),所以同一厂商的NPH和RI可以混合,减少一次注射。已经上市预混制剂有:novolin、humulin 30R(70/ 30)胰岛素,均为30%RI和70%NPH。把国产RI 和PZI混合,因为PZI中过量的鱼精蛋白能结合接近等量的RI,从而清除该RI的快速作用,PZI本身变成类似进口药NPH。例如制备NPH类似物和RI的混合剂的方法如下:PZI 4~8U+RI 4~8U(另外增加RI剂量,比如6~8U RI用以治疗本餐后高血糖)在注射器内带着气泡反复颠倒混匀8~16U NPH类似物和6~8U RI的混合剂。尽管各胰岛素制剂有不同的公认作用开始时间与持续时间,但面对所治疗的具体病例,个体差异明显,甚至同一病例在不同日期也差异甚大。
4)1日1次注射治疗黎明现象高血糖:夜间3时血糖不低(>6mmol/L)、空腹血糖升高>7~8mmol/L者,诊断为黎明现象高血糖。针对黎明现象高血糖,予睡前小吃、注射NPH或甘精胰岛素。NPH胰岛素的时效线不平坦、有峰,低血糖发病率高于时效线平坦无峰的甘精胰岛素。二者的剂量可以从小剂量4~6U开始,依据夜间3时血糖不低(>6mmol/L)、空腹血糖>7~8mmol/L,增加2U,直到空腹血糖达到6~7mmol/L,总量随病情而异,范围是6~16U,个别病例可达26U。餐后高血糖可用口服降糖药控制。
剂量调节
依据自我血糖监测来调整胰岛素剂量。每2~3天或4~5天可增加全天剂量2~8U,直到达到并非最好、但可以接受的血糖控制目标:①空腹血糖降到7. 8mmol/L(140mg/dl)左右;②餐前和睡前血糖降到7. 8~10mmol/L (140~180mg/dl)左右;③餐后2小时血糖降到180~200mg/dl左右。24小时尿糖宜定期测定,<5g/d为优良。随着葡萄糖毒性的解除,血糖将进一步改善。剂量调节举例如下:
1)餐前血糖升高:若出现餐前高血糖,而且患者本餐并不畏食或食量不降低,则需要调整本餐短效胰岛素剂量。比如午餐前血糖>10~11mmol/L(180~200mg/dl),午餐食欲相同于昨天午餐食欲,则本餐短效胰岛素剂量宜在昨天午餐前短效胰岛素剂量的基础上适当增加。餐前剂量增加后是否合适,宜测定本餐后2小时血糖。
2)餐后血糖升高:比如昨天午餐后2小时高血糖不能接受,而且今日午餐食欲食量与昨天午餐食欲食量相同,则增加今日午餐前的短效胰岛素剂量。又比如昨天晚餐后血糖过高,今日晚餐前应增加RI剂量(今日晚餐食量应该相同于昨日晚餐)。
3)关于早餐前注射中效胰岛素NPH来控制午餐后高血糖的问题尤需注意:①若午餐后2小时血糖仍超高,应增加早餐前中效胰岛素NPH,但是疗效不肯定。②若空腹血糖仍高,但晚餐前血糖<7. 8mmol/L(140mg/dl),则不可增加早餐前的中效胰岛素(反而可减少10%~15%剂量),否则可引起晚餐前低血糖。③矛盾的是:早餐前中效胰岛素剂量足以控制午餐后2小时高血糖时,这个剂量常常引起晚餐前低血糖,所以必须用午餐分餐法在午餐和晚餐之间加餐来解决这个矛盾。
4)如黎明现象空腹高血糖已确诊欲控制它,宜在睡前少吃些粮食制品后注射中效胰岛素NPH(有的病例,尤其1型糖尿病患者,可能须晚餐前注射中效胰岛素NPH),从小剂量4~6U开始,每2~3天监测夜间3时和空腹血糖鉴别黎明现象和Somogyi现象来调节剂量:黎明现象需要增加剂量,但是Somogyi现象应该减少剂量。每次调节幅度一般约2U为宜。有效剂量常常为6~16U,有的病例高达26U。
5)若应用预先混合型胰岛素(70%NPH/ 30%RI)早、晚各一次,则早餐前占2/3剂量。但有的患者在混合剂注射时需要较多的RI,则改为分别抽取NPH和RI的灵活方法。所以治疗要个体化。
6)总体来说胰岛素需要量为每天每千克体重0. 5~1. 0U,有明显胰岛素抵抗者的需要量>1. 0U/(kg·d)。肥胖患者常需要大剂量,偶尔可>150U/d。联合应用胰岛素和口服降糖药,可减少胰岛素剂量,并减轻高胰岛素血症所致动脉硬化。
7)正常人(无胰岛素抵抗)24小时胰岛素输出量约为35~40U,正常体重的1型糖尿病患者(几乎无胰岛素抵抗)开始用胰岛素时,全日总量从20U开始,隔几天上调一次。中等肥胖的1型糖尿病患者开始剂量比20U要增加5~10U。2型肥胖糖尿病患者因有胰岛素抵抗,全天总量可为60~90U,或高得多。
血糖昼夜波动5个周期及其临床应用
早餐后的上午,午餐后的下午,晚餐后直到睡前(10~11pm前),可简称为三餐后的高血糖时间段。夜间4时到次晨8时(另一说为3~9am)的黎明期内,胰岛素拮抗激素的昼夜周期高峰所致高血糖,来源于肝糖输出。10~11pm睡眠至夜间3时可称为前半夜,缺少足够的肝糖输出,又无肠道糖摄入,易发生低血糖。这样,上午,下午,睡前,前半夜,后半夜黎明期共5个血糖波动期,各有特点。
宜遵照糖尿病患者可能出现前半夜低血糖、后半夜高血糖、三餐后高血糖的特点,设计胰岛素和口服降糖药的应用,分析低血糖的原因。血糖昼夜波动5个周期的临床应用,举例如下。
1)前半夜(10pm~3am)若无睡前略吃些粮食制品的有力保护,可因口服降糖药或晚餐前NPH的作用,发生低血糖,以及低血糖后反弹性高血糖,称为Somogyi现象。所以,糖尿病患者宜养成用晚餐分餐法的习惯,在睡前加餐。
2)后半夜黎明现象的空腹高血糖,常不能被糖尿病患者的内源性胰岛素降糖作用抗衡,表现为黎明期高血糖(空腹高血糖为代表)。测定并比较夜间(2~3am)和空腹(7~8am)血糖,有助于鉴别Somogyi现象和黎明期空腹高血糖。晚餐前注射NPH,尽管睡前小吃(饼干等多糖,而不是水果等二糖)有防止前半夜低血糖作用,但它对黎明期高血糖的控制力度不足。最常应用的方法是,睡前(而不是晚餐前)小吃前皮下注射中效胰岛素NPH,它的作用时效,对大多数糖尿病患者来说,正好控制黎明期高血糖。
3)三餐后高血糖的处理广为人知,三餐前RI针对本餐后高血糖治疗效果好。RI改为lyspro针对餐后血糖高峰的疗效更好,餐前低血糖更少。
4)α糖苷酶抑制剂对餐中糖量较大的餐后高血糖的针对性强,比分餐法(三餐变五、六餐,少食多餐)疗效更好。二甲双胍于三餐前口服对三餐后高血糖的针对性还比较好,睡前用药有抑制黎明现象高血糖的作用,疗效不如睡前NPH。
5)磺脲类餐前用药对本餐后高血糖的针对性尚待探究。甲苯磺丁脲和格列喹酮(糖适平)可三餐前30~40分钟口服,餐前用药尚可针对本餐后高血糖。格列吡嗪(美吡达)的作用时效,有人说类似格列喹酮,可三餐前30~40分钟口服来控制本餐后高血糖。格列本脲(优降糖)、格列齐特(达美康)的降糖作用时间长(优降糖服药后作用高峰从4小时开始),许多人主张早上一次给药,剂量较大时分早、晚两次给药。因此,这两种药餐前服用对本餐后高血糖针对性不理想,据三餐后血糖值调整磺脲时应注意这点。
胰岛素中效NPH或短效RI的选择
下述几种偏误非常值得重视,因为实际上有的资深糖尿病专科医生还存在这方面的疏漏。
1)有些医生至今仍习惯于长期应用午餐前皮下注射短效胰岛素,而不选择有适应证的病例力争在早餐前注射中效胰岛素NPH代替它。那样,则会使患者中午外出、上班或探亲访友也必须带着胰岛素及注射用具,故应避免。1型糖尿病患者常常需中午注射短效胰岛素,2型糖尿病患者则不必一概如此,宜在早餐前注射中效胰岛素NPH代替午餐前皮下注射短效胰岛素。
2)有些医生还在中午餐前注射中效胰岛素NPH,使患者中午外出也必须带着胰岛素及注射用具。中午餐前注射中效胰岛素NPH的治疗目的令人费解:午餐前NPH目的是控制晚餐后高血糖的,而晚餐后高血糖完全可以在患者下班回家于晚餐前注射短效胰岛素RI来得到更好地控制。中效胰岛素不应该也不必要在午餐前注射。
3)对于黎明现象的空腹高血糖,还有医生在午夜12时或夜间3时叫醒患者注射短效胰岛素来治疗。这是多年前在中效胰岛素NPH问世前的作法,不宜再用。下图显示,睡前注射中效胰岛素NPN恰好控制黎明现象(4am~8am)高血糖;而晚餐前注射中效胰岛素NPH,则其最强作用落在前半夜,易引起低血糖。有的医生对于黎明现象的空腹高血糖,习惯于让患者在晚餐前注射中效胰岛素NPH,仍担心在睡前注射中效胰岛素NPN引起夜间低血糖,反倒不担心睡前不加餐的患者于晚餐前注射中效胰岛素NPH,可能发生夜间低血糖。现在对1型糖尿病,尤其2型糖尿病的黎明现象的空腹高血糖,应该首先选择中效胰岛素在睡前皮下注射(少数病例需晚餐前注射NPH),同时一定嘱患者睡前吃些粮食制品(比如几片饼干等)。
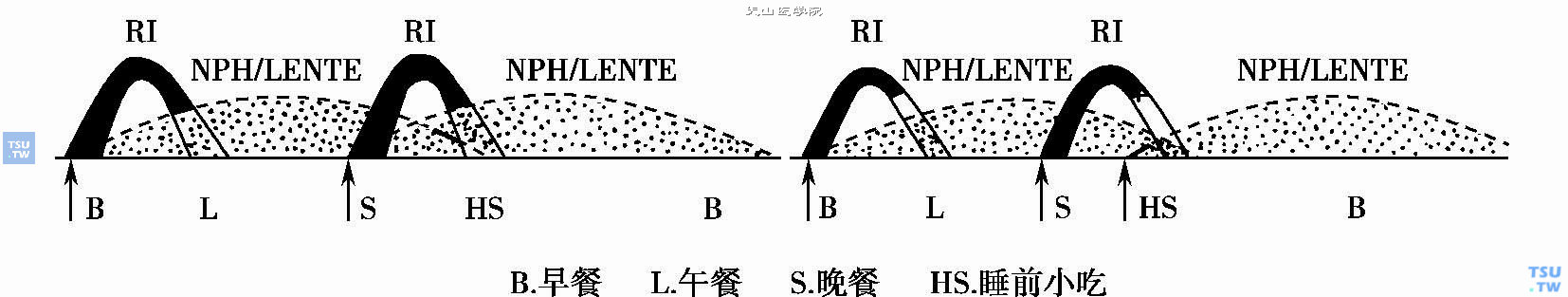
中效胰岛素NPH晚餐前和睡前注射的不同时效(仿Joslin,1994)
4)对于黎明现象的空腹高血糖,应用睡前胰岛素注射时,有医生还选择预混制剂R30/N70做睡前注射。该病例睡前血糖约7mmol/L,睡前仅吃几片饼干,并非正餐,睡前选用短效胰岛素RI的目的性受到置疑。结果夜间3~4时发作低血糖,主要是短效胰岛素RI引起,以及低血糖后反弹性空腹高血糖(睡前NPH不能控制这种低血糖后反弹性空腹高血糖)。对糖尿病的黎明现象的空腹高血糖本身,若在睡前皮下注射胰岛素,则只能选择中效胰岛素NPH,不能同时应用短效胰岛素RI。
5)对糖尿病酮症病例(尿酮≥80mg/dl):有医生在首诊时不查血气,不劝患者去急诊科或开胰岛素处方让患者去注射室或邻近医疗单位注射短效胰岛素,不开住院证,只给口服降糖药。复诊时病情加重,虽开住院证但无病床,仍不查血气,仍不送患者去急诊科或注射室或邻近医疗单位注射短效胰岛素,仍只给口服降糖药。致使第三次来诊时已出现神志异常(急诊住院后急救成功)。这种患者首诊时就应该送急诊科或注射室注射短效胰岛素。如果患者和家属在得到医生的耐心忠告后仍拒绝注射胰岛素,则医生一定请其在病历的有关文字下方签字,责任由患者自负。否则责任不清。
中效胰岛素NPH临床应用的8种常见方法
中效胰岛素NPH用法8种类型
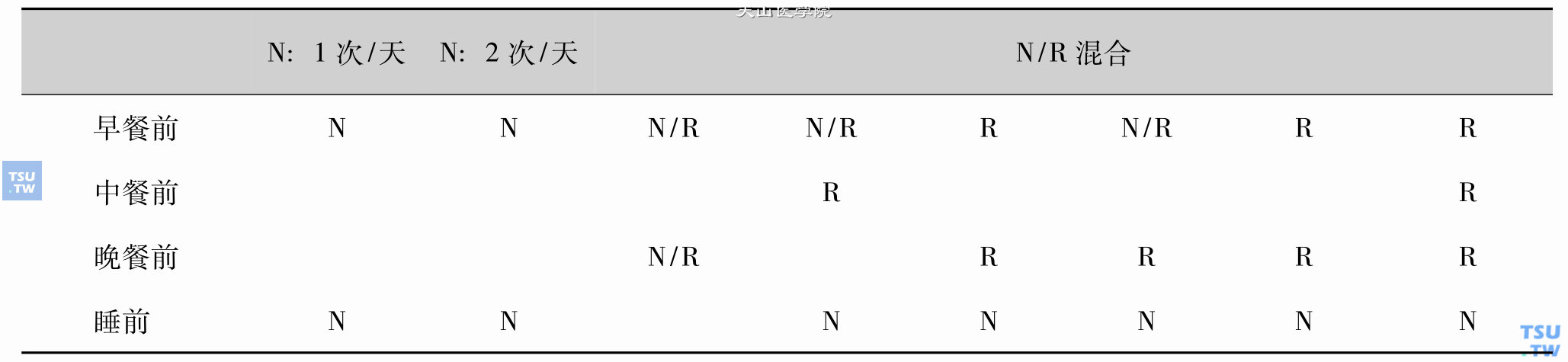
注1:胰岛素:N(NPH)中效胰岛素:①早餐前皮下注射NPH控制午餐后高血糖;②睡前小吃前(少数人晚餐前)注射NPH控制黎明现象高血糖
胰岛素:R(RI)短效胰岛素:餐前注射控制本餐后高血糖。尽量取消午餐前RI注射,以便中午外出工作不带胰岛素
注2:联合口服降糖药:①三餐后高血糖空白处/薄弱处可填补以:D860/格列喹酮(餐前30分钟服)、二甲双胍、阿卡波糖/伏格列波糖。②黎明现象高血糖空白处:可于睡前小吃时,填补0. 25~0. 5g二甲双胍
1)睡前(偶可晚餐前)皮下注射中效胰岛素NPH:以便控制黎明现象高血糖。白天三餐后高血糖用口服降糖药控制。2型糖尿病患者如果联合口服降糖药在种类和剂量上已调整得没有余地,非降糖药的饮食控制、体力活动、避免各种“应激”等三项均已做到,而明显空腹高血糖已排除Somogyi现象确诊黎明现象高血糖,那么睡前小吃前应该加用少量(4U开始,逐渐增量)NPH或glargine。一旦控制夜间高血糖毒性,则可逐渐发现白天口服降糖药(OHA)剂量需适当减少。睡前宜小吃。
2)早餐前皮下注射NPH:目的是控制午餐后高血糖。开始剂量比晚餐前或睡前NPH剂量大,理由是针对中午进餐,而且白天患者并非因睡眠而难于发现低血糖。监测剂量是否过大方法之一是看“尾段”作用的晚餐前有无低血糖。对于白天尚不能控制的高血糖,可用合适的口服降糖药;或后半夜高血糖可应用睡前注射NPH。
3)NPH睡前和早餐前各注射一次。
4)NPH和RI联合应用,参见图41-2。RI控制本餐餐后高血糖,同一针注射的早餐前NPH控制午餐后高血糖。睡前或晚餐前NPH控制黎明现象高血糖。novolin N(NPH)和novolin R是同一厂家制造,混合后溶液的各参数不会相互矛盾而影响RI与NPH各自发挥疗效。国产单峰RI和进口的诺和灵N在同一针管注射时,仅个别病例发现不能维持原来RI和NPH的疗效。
5)NPH和RI联合应用的疗效,在许多病例已能满足病情需要。对于部分病例白天餐后血糖仍高者,可选用基本只作用于本餐的口服降糖药,如:双胍类,磺脲的D860,或餐前30分钟服用的格列喹酮,葡萄糖苷酶抑制剂。
6)对于晚餐前需注射RI,而且睡前需注射中效胰岛素者,二次注射痛苦增加,希望注一次。lente的峰时为第6~7小时至第15小时,比NPH峰时(第4~12小时)略为向后移动,有人用lente和RI在同一针管于晚餐前注射获得疗效,不必把NPH放在睡前注射,可试用。
7)睡前小吃(bedtime snack)为晚餐的分餐,可防止夜间低血糖。适合各型糖尿病患者,适合用各种降血糖药者,国内外广泛提倡。
预防低血糖
低血糖能够引起血管痉挛、心脑血管缺血,对于老年人和心血管病患者应该严格预防低血糖。
1)血糖控制目标合理和个体化:血糖正常或接近正常容易发生低血糖。对于应用胰岛素治疗的T2DM患者,如果设定的血糖目标为空腹血糖7mmol/L左右、餐后血糖10mmol/L左右、平均HbA1c7%左右时,严重低血糖发生率相当低。尽管无对照的临床试验所报告的严重低血糖发生率相对高(属于经验性资料),如果目标不是血糖接近正常、而是平均HbA1c7%左右,此时的严重低血糖可以低到“0~5次发作/(10万病人·年)”;所用治疗药物和方案包括中效和长效胰岛素,或中效和速效胰岛素联合,胰岛素联合口服降糖药。对于HbA1c>8. 5%的患者,提倡及早选择降低血糖更有效的药物(例如胰岛素)。2007年资料仍然认为,餐后高血糖对于糖尿病并发症的意义仍未确立。老年糖尿病难治患者的血糖目标,空腹可为6、7、8mmol/L,餐后可为9、10、11mmol/L;24小时尿量1500~2500ml。
2)随身携带食物。
3)分餐:3餐分为6餐,大约于上午10时、下午3时、下午10~11时(睡前)分别进食早、午、晚餐所分餐出的少许食品。尤其睡前进食少许粮食制品有利于预防夜间低血糖。
4)及时复诊:可以预防血糖过高、过低。
