急性白血病(AL)的诊断和分型主要依赖白血病的细胞形态、免疫表型和遗传学特征。依细胞形态和免疫表型可确定白血病细胞的系列归属和分化阶段,某些特殊类型的AL诊断可根据细胞遗传学异常确定。
AL的细胞形态
形态诊断应依赖于治疗前的骨髓和外周血涂片。按May-Grünwald-Giemsa或Wright-Giemsa常规染色。外周血和骨髓涂片分别计数分类200个和500个有核细胞。白血病细胞形态有时在外周血涂片中更为典型。一般骨髓增生活跃以上,分类可见大量白血病细胞,而残余的正常造血成分较少。大量白血病细胞积聚、伴骨髓纤维化或骨髓坏死等,有时可致常规骨穿取材不满意,这时需进行骨髓活检和骨髓免疫病理检查明确诊断。AL原始细胞是分化较早的髓系或淋系原始、幼稚细胞,包括原始粒细胞、异常早幼粒细胞、原始和幼稚单核细胞、原始巨核细胞和原始、幼稚淋巴细胞。除罕见的纯红系白血病外,原始细胞不包括原始红细胞,也不包括发育异常的成熟小巨核细胞。原始细胞常胞体大小不一,核大浆少,核类圆形或不规则,染色质细致、疏松,或可见到核仁,胞质内无或仅有少许嗜天青颗粒(AML-M3除外)。骨髓涂片的大体观察有助于区分ALL和AML。ALL一般无油无粒,低倍镜下可见白血病细胞成小簇状聚集分布;AML的骨髓小粒或油粒较多,白血病细胞内可见到Auer小体。
细胞化学染色
形态诊断AL常带有一定的主观性,可重复性较差。细胞化学染色可增加诊断分型的客观性和正确率。细胞化学染色一般包括过氧化物酶(POX)、苏丹黑(SBB)、特异性酯酶(CE)、非特异性酯酶(AE)、碱性磷酸酶(ALP)和酸性磷酸酶(ACP)等。AE又包括中性酯酶(NAE)、酸性酯酶(ANAE)和丁酸酯酶(NBE),通常以α-醋酸萘酯为底物。AML原始细胞的POX、SBB、CE或AE染色阳性,单核细胞白血病的AE染色可被氟化钠抑制。POX和髓过氧化物酶(MPO)是鉴别AML和ALL的重要指标。原始细胞如POX或MPO阳性率≥3%可确定为AML。AML中POX或MPO阳性率依次为M3>M2>M4>M5>M1。少数分化很差的髓系原始细胞POX或MPO染色可为阴性。SBB的意义与POX和MPO类似。CE是中性粒细胞标志酶,在M1、M2a和淋巴细胞一般阴性,但M3强阳性。通常将CE与POX/ MPO和SBB联用鉴别AML和ALL。NAE主要分布在单核、淋巴和巨核细胞,粒细胞和有核红细胞为弱阳性或阴性。单核细胞NAE染色为弥散性阳性,且可被NaF抑制;淋巴细胞NAE为单个点状阳性颗粒,常位于细胞核旁;粒系AML细胞NAE也强阳性,在M3反应强度和积分高于M4和M5,但粒细胞NAE阳性反应不被NaF抑制。ANAE正常主要见于T细胞、单核细胞和巨核细胞,而在B细胞、粒细胞和有核红细胞含量较少,主要用于ALL与AML鉴别和从ALL中区分出T-ALL。NBE是单核细胞标志酶,在单核细胞反应最强,淋巴细胞和巨核细胞仅为弱阳性或阴性,粒细胞为阴性;主要用于将M4、M5与M3区分开来。ALP在晚幼粒和成熟粒细胞含量最高,而原始粒细胞和其他血细胞为阴性。类白血病反应时ALP显著增高,而急性粒细胞白血病和CML减低。ACP在AML中反应强度要高于ALL,以M4较强。在AML中ACP阳性物质为弥散状分布,而ALL为局灶分布。过碘酸-希夫(PAS)染色可显示细胞内糖原,原始淋巴细胞多为粗颗粒或珠状阳性,原始粒细胞和单核细胞多为细颗粒弥散状阳性;红白血病时有核红细胞多呈阳性反应,有助于红白血病的诊断。
细胞免疫表型
少数AL经细胞形态和细胞化学染色,仍不能确定白血病细胞系列归属和分化阶段,需进行免疫表型分析。不同发育和分化阶段的造血和淋巴组织细胞会在细胞膜、细胞质或核上表达出相应的蛋白(图1~图4),这些蛋白可作为它们的身份“标识”。虽然迄今仍未发现白血病和淋巴瘤的特异性抗原,但根据急性白血病形成的分化阻滞学说(因遗传学异常,造血和淋巴组织细胞不能发育为成熟的正常血细胞,而是分化阻滞于发育的某一早期阶段),可利用正常血细胞的单抗来进行免疫分型,确定白血病细胞的系列归属和分化阶段。需要注意的是,白血病细胞毕竟是异常的细胞,其抗原表达与处于同一分化阶段的正常造血和淋巴细胞还是有一定的差异,即存在不同分化阶段抗原的非同步表达、跨系列表达和抗原表达强度变异等,借此可将白血病细胞与正常造血和淋巴组织细胞区分开来,并作为缓解后监测患者微小残留病(MRD)的依据。抗原检测的方法有免疫化学染色和流式细胞术等,比细胞化学染色更敏感、特异。流式细胞术能快速、多参数、客观地对细胞膜、质和核上的抗原表达进行定性和定量分析,通常采用流式细胞术检测原始细胞的抗原表达。
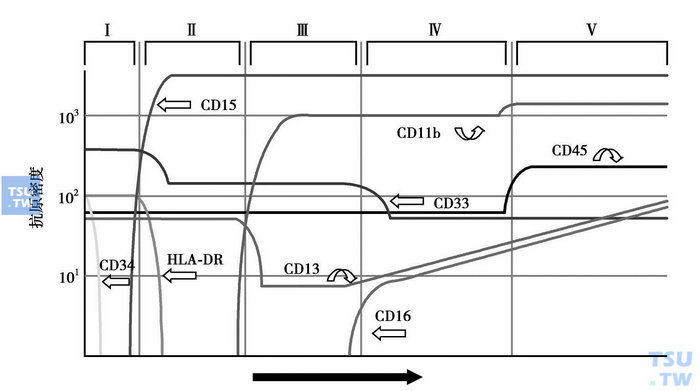
图1 粒细胞成熟过程中抗原的表达
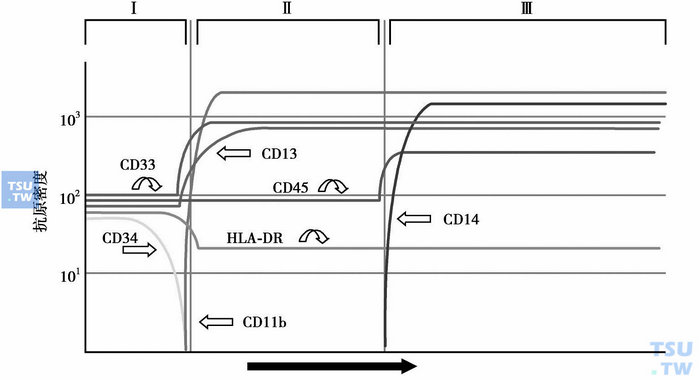
图2 单核细胞成熟过程中抗原的表达
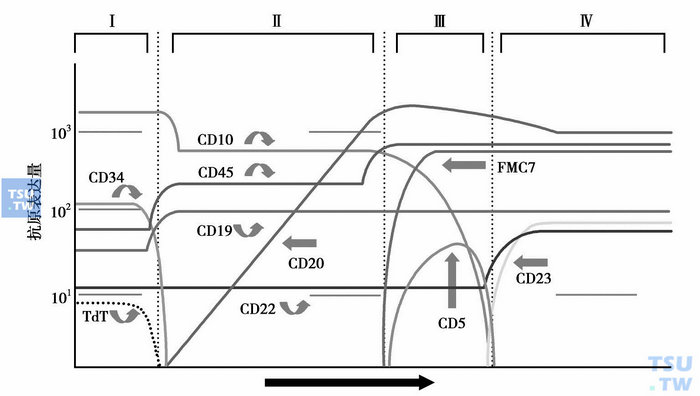
图3 B细胞成熟过程中抗原的表达
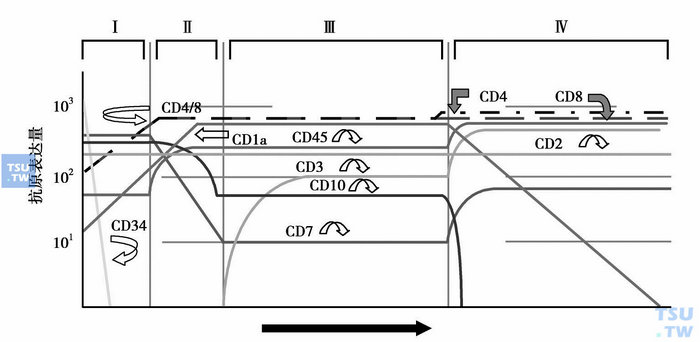
图4 T细胞成熟过程中抗原的表达
与急性白血病诊断分型有关的常用抗原标记有:①髓系抗原,如MPO、CD117、CD33、CD13、CD11b、CD14、CD15、CD16、CD64、CD65、血型糖蛋白A和CD41、CD42b和CD61等;②B系抗原,如CyCD79a、CD10、CD19、CD20、CD21、(Cy)CD22、CD23、CD24、Cyμ、SmIg和FMC7等;③T系抗原,如CD1a、CD2、(Cy)CD3、CD4、CD5、CD7、CD8、TCRα/β和TCRγ/δ等。CD34、HLA-DR和TdT为早期阶段表达抗原,CD45为白细胞抗原。MPO(髓系)、血型糖蛋白A(红系)、CD41/CD42b/CD61(巨核系)、CyCD22(B系)和(Cy)CD3(T系)等为系列特异性抗原。
AML表达髓系抗原和早期阶段抗原,也可跨系列表达淋系相关抗原。不同FAB分型的AML抗原表达各有特点(表1)。某些特殊类型的AML诊断须依赖免疫表型;如M0在形态上不能辨认,POX 和SBB染色阴性,只能通过免疫表型确认:需至少表达一种髓系特异抗原(cMPO、CD13/CyCD13和CD33/CyCD33等);M7的诊断则需有CD41、CD42b 和CD61抗原的表达或经免疫电镜证实PPO阳性才能确定。
表1 AML各亚型的抗原表达

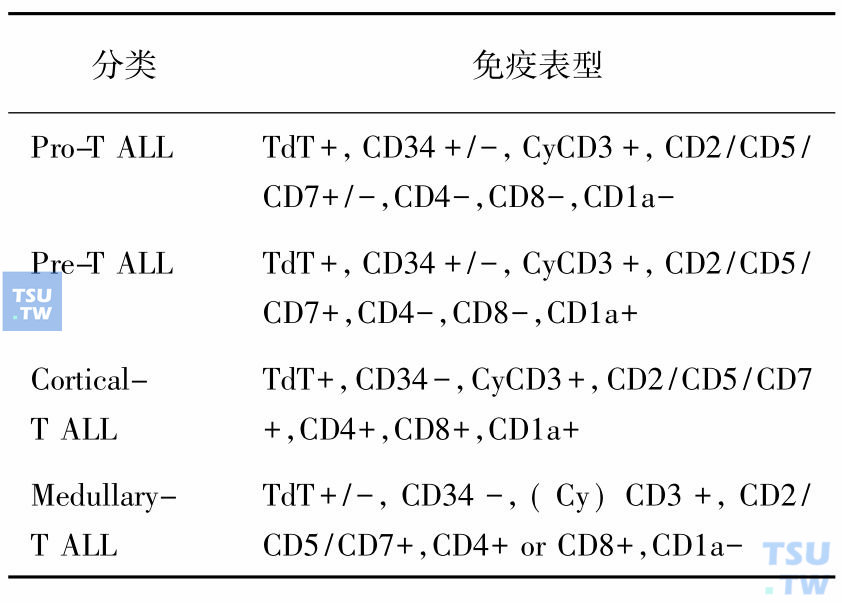
ALL按细胞系列归属可分为B-ALL和T-ALL,根据不同的分化阶段可再分为若干亚型(表2和表3)。
表2 B-ALL的免疫表型分类
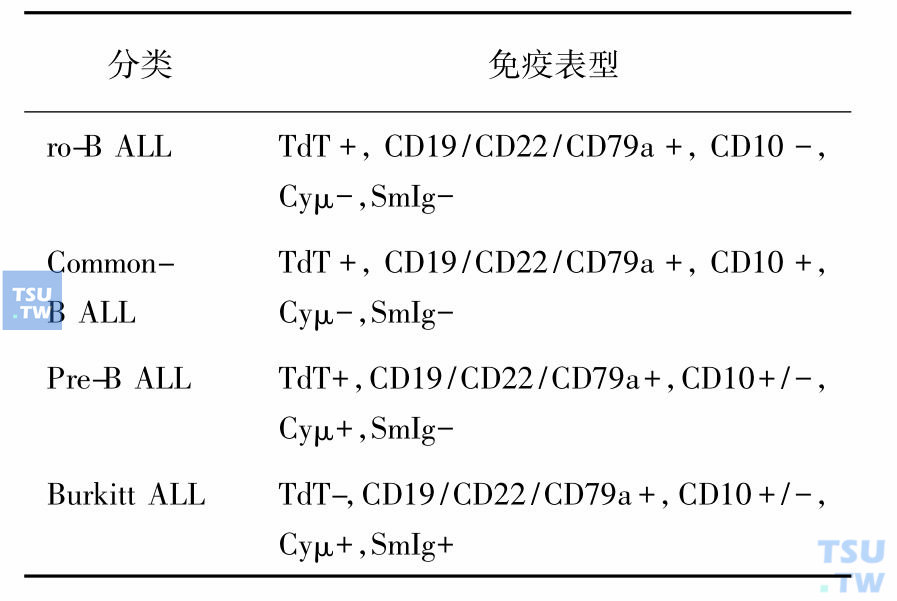
表3 T-ALL的免疫表型分类(EGIL,1995)
少数AL经细胞形态、细胞化学染色和免疫表型检查仍难以明确细胞系列归属,称为“系列模糊的 AL”(acute leukemias of ambiguous lineage),包括急性未分化型白血病(acute undifferentiated leukemia,AUL)、急性双系列型(acute bilineage leukemia)和急性双表型白血病(acute biphenotypic leukemia)。AUL原始细胞的POX和NBE染色阴性,不表达髓系和淋系抗原,形态、细胞化学染色和免疫表型无法确定细胞系列归属,治疗与AML相同。急性双系列型和急性双表型白血病原始细胞兼有髓、淋两系的形态和(或)免疫表型特点,或同时具有B系和T系免疫标记,以前在诊断上按EGIL(1998)的积分系统(表4),只有当其他系列抗原表达累积分值≥2. 5分时才能确诊。
细胞遗传学特征
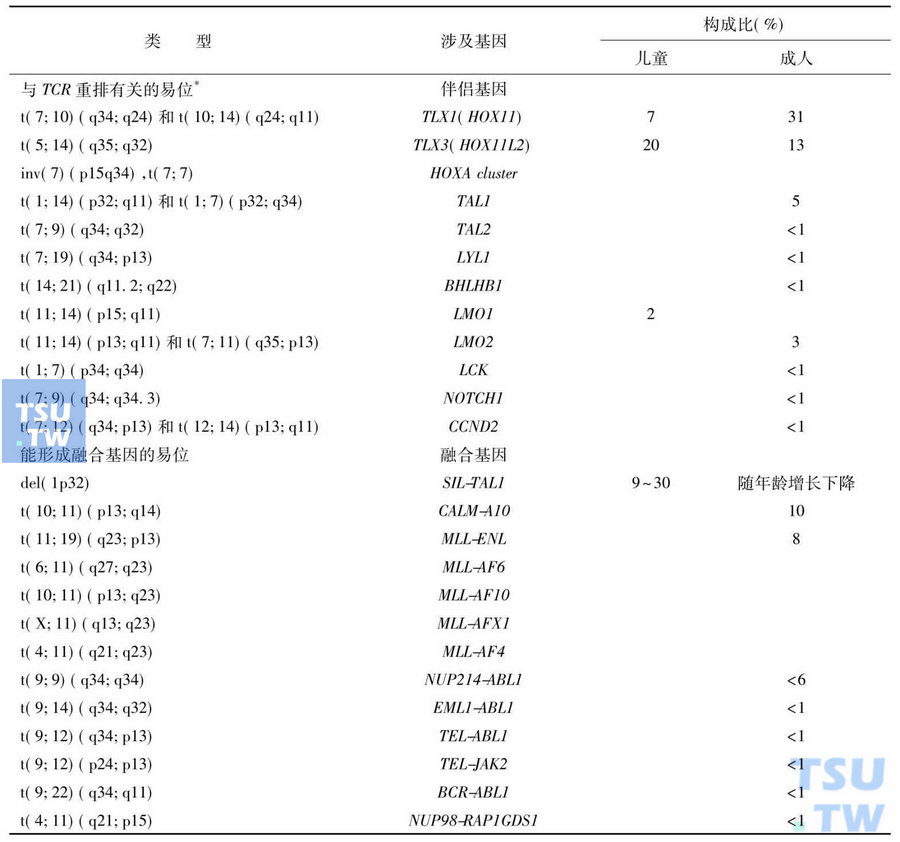
急性白血病60%以上存在染色体数量和(或)结构异常,更多的患者具有临床可检测的分子遗传学异常。遗传学异常主要表现为癌基因突变激活、抑癌基因缺失或突变失活等。与实体瘤不同,白血病常有染色体易位,形成融合基因。易位基因包括转录因子基因、造血发育必需基因、造血分化基因、同源功能基因及凋亡相关基因等,以转录因子基因易位最多见。细胞遗传学异常是白血病的致病基础,与预后密切相关。具有相同遗传学异常的白血病致病机制、细胞形态、免疫表型和预后等基本相似,往往可构成一类独立疾病实体,在诊断和分型上具有特别的意义(表5~表7)。AL有许多特征性的遗传学异常,例如t(8;21)、t(15;17)、inv (16)/t(16;16)和11q23易位/MLL基因重排等是AML最常见的重现性遗传学异常,可据此进行诊断和分型。B系ALL中成人以t(9;22)多见,儿童患者则以t(12;21)为主,分属不同的疾病实体;8q24/ Myc基因易位见于几乎所有的Burkitt ALL,是确诊该病的重要指标;而T系ALL最常涉及的易位基因则是14q11. 2上的TCRα/δ、7q35上的TCRβ和7p14-15上的TCRγ。
表4 急性白血病诊断的EGIL积分系统(1998)
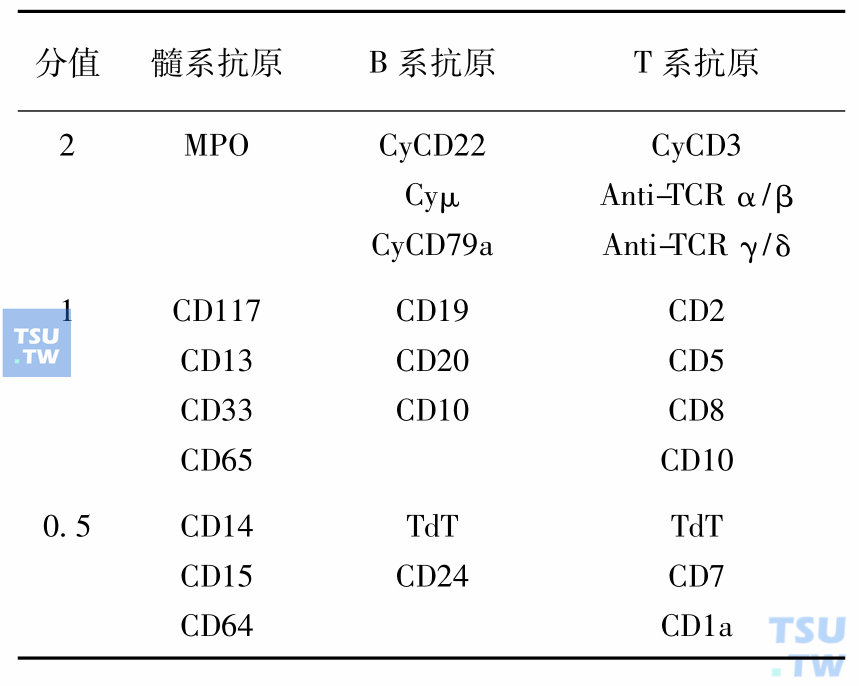
表5 AML细胞遗传学异常与FAB分型
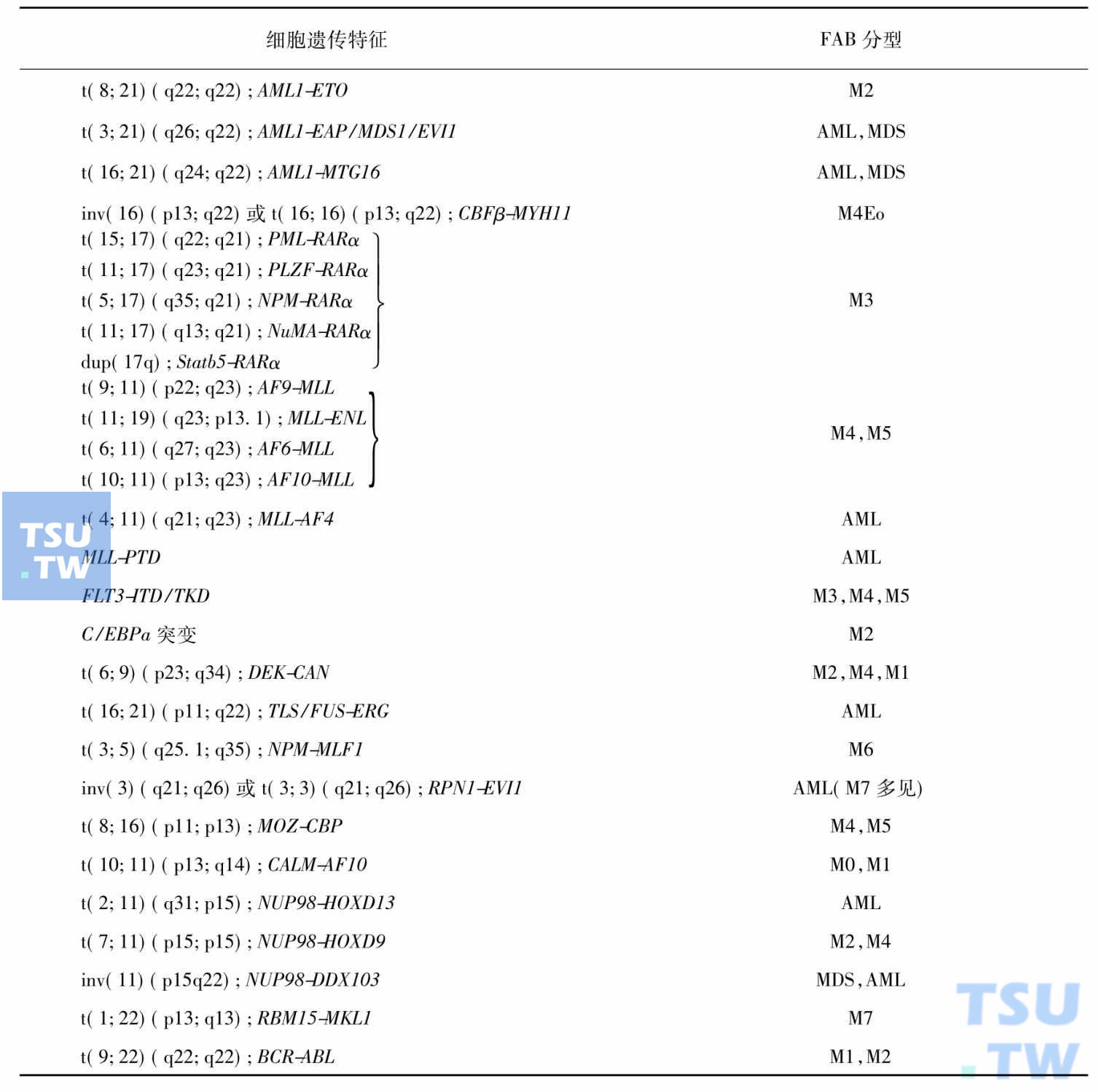
表6 B系ALL的遗传学异常

表7 T系ALL的遗传学异常
*重排后的伴侣基因转录受TCR启动子/增强子调控,使伴侣基因表达异常,但不编码融合蛋白。
