CML治疗应依据患者的自身状况、预后分析、经济条件制定相应的治疗方案。CML患者就诊或复发时常有高尿酸血症,因此治疗前应予别嘌醇300mg/d,分次口服,并充分补液以维持尿量,如果患者有大量细胞溶解的危险因素,应维持尿量在150ml/h。由于别嘌醇可出现过敏性皮炎,因此在白细胞数下降至正常、脾肿大明显缩小、无明显高尿酸血症后应停用。目前CML慢性期患者主要采用下列治疗:化疗、干扰素治疗、分子靶向药物治疗、骨髓移植与外周血干细胞移植、中药治疗等,现分述如下。
化疗
白消安
白消安(马利兰)是一种烷化剂,是第一个广泛应用于CML治疗的化疗药物,由Haddow和Timmis于1953年首创并应用于CML的治疗,白消安作用于早期祖细胞,对CML慢性期有较好的疗效,由于白消安代谢产物排泄较慢,治疗开始白细胞下降缓慢,一旦有骨髓抑制,则持续时间较长。常规剂量为4~6mg/d,应连续服用。用药后先有自觉症状如乏力、腹胀、多汗等会好转,2~3周后出现白细胞下降,外周血幼稚细胞减少,最后脾脏回缩。白细胞降至(20~30)×109/L时可暂时停药,此时白细胞有可能继续下降达正常水平。少数患者可不服药而长期维持缓解,大部分患者常在白细胞下降至最低后1~2个月又逐渐上升,需小剂量白消安维持治疗。一般每日或隔日2mg,由于患者对白消安敏感性的不同,常可导致同一剂量出现不同疗效,因此用药初期应及时检测血象。每周查两次,如白细胞下降幅度过快,应及时减量或停药。如不及时停药有可能发生骨髓抑制而危及生命。白消安主要副作用为骨髓抑制,有时治疗后血小板明显下降而白细胞下降不显著,造成治疗困难。白消安易发生皮肤色素沉着,尤以面部、躯干、四肢为明显。发生色素沉着可能与去巯基作用有关,白消安与谷胱甘肽的巯基起反应,使角质减少,而形成黑色素。白消安还可能引起不可逆的闭经或睾丸萎缩,间质性肺纤维化等。
羟基脲
这是一种周期特异性抑制DNA合成的药物,它作用迅速,能使白细胞较快下降,但药物后作用小,没有白消安的严重骨髓抑制作用。羟基脲维持时间短,停药后复发快,故应小剂量长期维持。治疗量为2~3g/d,白细胞下降后逐渐减量,直至缓解。一般初始剂量为2g/d,白细胞降至10× 109/L时,可用维持量0. 5~1. 0g/d。羟基脲副作用轻,可有轻度的消化道反应(纳差、恶心),脱发,皮肤丘疹,月经量多,骨髓细胞巨幼变等,对胎儿有致畸作用,骨髓抑制少,无肺纤维化。
靛玉红及其衍生物甲异靛
靛玉红是一种新型结构类型(吲哚类化合物)的抗肿瘤药物,是中国医学科学院血液学研究所经过20余年的研究,从泻肝经实火的当归龙荟丸中发现单药青黛治疗CML的作用,进一步对青黛分离提纯,最后从青黛中找出了治疗CML的有效成分——靛玉红。靛玉红治疗后,缩脾早于白细胞下降,甚至缩脾后外周血白细胞数可升高,取得缓解后应长期维持治疗,剂量75~100mg/d。缓解后不用靛玉红维持治疗者,停药一年内全部复发。靛玉红的主要副作用为腹痛、腹泻、腹胀、恶心、呕吐及便血等消化道症状,这是由于该药为针状结晶,对胃肠道黏膜的直接刺激所致。约有1/3病例会出现消化道副作用,大部分病例随服药时间延长副作用逐渐减轻,约有5%~7%的患者因有严重的副作用(不仅大便次数显著增多,而且还伴有黏液样血便)而中止治疗,停药后血便即会停止。副作用轻重程度与药物剂量大小无关,可能与患者的个体敏感性有关。
1982年中国医学科学院药物研究所为克服靛玉红对胃肠道的明显副作用及溶解性差的缺点,定向合成一系列双吲哚类化合物,从30余种化合物中发现了甲异靛,经过大量动物实验表明它有明显抑制DNA合成的作用,与靛玉红相比吸收迅速而完全。服用剂量为75~150mg/d,分次饭后服药,维持量50~100mg/d,极少在治疗期间出现骨髓抑制,且与白消安等无交叉耐药,与白消安和羟基脲相比,其缩脾效果明显好于前者。甲异靛的主要副作用是不同程度的骨、关节、肌肉疼痛。多在服药后1个月出现,一般持续2周左右。个别患者服止痛剂或减量后可好转,疼痛发生与剂量及个体差异有关。消化道反应轻微,无黏液血便,少数患者服药后面部水肿,无心、肝、肾功能损害。甲异靛或靛玉红可以与羟基脲、白消安交替或联合使用。
其他
国内外有单用环磷酰胺、巯嘌呤、美法仑、苯丁酸氮芥、二溴甘露醇、嘧啶苯芥(合520)、秋水酰胺、二溴卫矛醇、卡波醌、三尖杉酯碱等治疗CML慢性期患者,这些药物虽均对CML有效,但没有一种药物的疗效超过羟基脲或白消安。也有学者采用阿糖胞苷、蒽环类药物、巯嘌呤、环磷酰胺、门冬酰胺酶、依托泊苷和白消安等药物组成不同的强烈联合化疗方案治疗CML,但绝大部分研究表明强烈联合化疗不能明显延长生存期。
干扰素
干扰素的作用机制
干扰素(IFN)是一种天然的细胞因子,最先由Issacs和Lindenman提出,它具有抗病毒、抑制细胞增殖、免疫调节和诱导分化的作用,按其生物化学结构及抗原活性可分为α、β、γ三大类。干扰素通过与其特异的受体结合,促使一系列的蛋白表达,其中2'-5'寡聚腺苷酸合成酶是已知的最重要的酶之一,它能激活RNA酶,从而降解了促癌基因来源的RNA以及编码生长因子如TNF-α、IL-1α、IL-1β、IL-6等基因来源的mRNA。体外实验证明,它能抑制正常或是CML患者的造血干细胞的增殖。CML来源的造血祖细胞对骨髓基质细胞的黏附作用存在缺陷,导致了外周循环中祖细胞大量增多。IFN-α能恢复这种黏附作用,从而使循环池中的CML造血干细胞重新分布到骨髓中去。IFN-α还抑制骨髓基质细胞细胞因子的过量表达,它能抑制GM-CSF、G-CSF、转换生长因子、MIP-1α、IL-1表达。已知IL-1、G-CSF、TNF-α的过量表达可能有助于恶性造血克隆的增殖,并且证实IL-1是CML进展的一个重要的细胞因子,它的过量表达既可诱导GM-CSF的产生,又可协同刺激早期祖细胞导致髓系造血的扩增。IFN-α对此类因子具有分化调节作用。另外,IFN还升高MHCⅡ类抗原的表达,提高对T细胞细胞毒的调节作用,还可能对基因组的稳定性具有保护作用,从而延缓了CML的进展。IFN还可通过上调Fas受体/Fas配基系统,诱导Fas阳性CML祖细胞的凋亡。
单用干扰素的疗效
MDACC于1981年应用干扰素体外研究发现,它能够无选择地抑制正常细胞及CML的髓系CFU细胞。同年,Talpaz等人用天然干扰素治疗CML获得成功,从而为CML的生物治疗开辟新纪元。Talpaz等单用天然干扰素治疗CML慢性期患者51例,其中36例(71%)获血液学缓解,且7例(14%)Ph染色体消失,3例Ph染色体阳性率小于35%,11例Ph染色体阳性率为35%~90%,15例Ph染色体无改变。随后几个研究组应用重组人IFN也获得了类似的结果。统计结果表明,IFN治疗CML的血液学缓解率为61%~80%(中位64%),29%~65%的患者有不同程度的细胞遗传学缓解,主要细胞遗传学缓解15%~30%,只有极少部分患者能消除Ph+的克隆,并且低危组患者的疗效明显优于中高危组,早期治疗的疗效明显优于晚期治疗。另外还发现对IFN治疗敏感的患者可获得更长的生存期。
干扰素治疗CML获得细胞遗传学疗效的时间一般比较长,MDACC在对274例慢性期早期CML患者应用IFN-α治疗发现,获得完全细胞遗传学缓解的中位时间为22个月,获得部分遗传学缓解的中位时间为18个月,获得微小细胞遗传学缓解的中位时间为12个月,并且获得细胞遗传学反应的程度与患者持续缓解的时间呈正相关。获得完全细胞遗传学缓解的患者持续缓解的时间最长。细胞遗传学反应与疾病的分期、预后分组及干扰素的剂量相关。在12个月内获得任何细胞遗传学反应都会有明显的生存优势,5年生存率约为70%,且与Ph染色体阳性细胞减少程度密切相关。
干扰素与其他药物联合应用
干扰素联合羟基脲可使病情迅速得以控制,取得更好的血液学缓解,减低干扰素的副作用,缩短控制疾病的时间,但其遗传学反应与单用干扰素相比无改善。联合应用干扰素和小剂量阿糖胞苷可获得良好的血液学与细胞遗传学疗效。法国CML研究组随机将721例CML患者分为三组:干扰素、干扰素+羟基脲、干扰素+阿糖胞苷[20mg/(m2•d),皮下注射,每月10天]进行治疗。结果表明干扰素+阿糖胞苷组的血液学缓解率为66%,高于其他组,治疗12个月,干扰素+阿糖胞苷组有41%患者获得主要细胞遗传学反应,而单用干扰素组仅有24%。观察24个月,干扰素+阿糖胞苷组有54%患者获得主要细胞遗传学反应,15%患者获得完全细胞遗传学反应,而单用干扰素组患者获得主要和完全细胞遗传学反应分别为41%和9%。表明干扰素联合小剂量阿糖胞苷疗效优于单用干扰素。
干扰素的用法与副作用
目前应用的干扰素类型为IFN-α,IFN-β和IFN-γ的疗效均不及IFN-α。干扰素使用剂量通常按体表面积计算为[(2~6)×106U/(m2•d),国外用量通常为5×106 U/(m2•d)]。皮下注射或肌肉注射优于静脉注射,静脉注射可使5%的患者产生抗体。白细胞计数明显增高的患者在IFN治疗前应先用羟基脲减少白细胞负荷。治疗原则是早期、大剂量及长期持续应用。初用时每日注射,获缓解后可改用隔日1次。
干扰素早期常见的副作用有发热、畏寒、头痛、疲乏、纳差、肌肉及骨骼疼痛,似流感样的症状,持续几天至2个月;晚期可有持续乏力、食欲下降、体重下降,少数患者可有贫血、血小板减少、肝肾功能损害、脱发,有时有甲状腺功能低下、忧郁等,严重者可有心绞痛、注意力不集中、记忆力减退及昏睡等神经系统毒性表现。剂量减少时以上症状可减轻或消失,给予小剂量解热镇痛药如对乙酰氨基酚等可解除上述副作用。
酪氨酸激酶抑制剂
甲磺酸伊马替尼
临床试验时名为STI-571 (signal transduction inhibitor-571),商品名Gleevec,Glivec,格列卫,属小分子化合物,是一种酪氨酸激酶抑制剂(TKI)。对体内众多酪氨酸激酶,它仅能抑制BCR-ABL融合基因产物P210和P190、PDGFR与c-Kit。所以是一种特异性很强的基因产物抑制剂,但并不能消除疾病基因。自1999年末至2001年经过Ⅰ期和Ⅱ期临床试验证实了IM的安全性、适合剂量和有效性后,于2001年5月美国FDA经快通道批准IM用于治疗IFN-α失效或不耐受的慢性期和进展期CML(我国于2002年获准上市)。由于国际Ⅱ期临床试验证明了IM疗效与病期明显相关,对慢性期的疗效明显优于加速期,更优于急变期,使人们推测IM早期应用可能更具优势。遂于2001年开始了一项著名的国际随机Ⅲ期临床试验(IRIS),共1106例初诊未经治疗的CML慢性期患者根据Sokal评分随机分为两组,一组为IM 400mg/d,另一组为IFN-α联合Ara-C[IFN-α 500万U/(m2•d)皮下注射+Ara-C 20mg/d皮下注射×10天/月],每组各553例。如果出现以下情况之一则交叉到对组:①不耐受;②失去完全血液学缓解(CHR);③失去主要细胞遗传学缓解(MCyR);④6个月未达到完全血液学缓解;⑤12个月未达到主要细胞遗传学缓解;⑥白细胞增高。近几年来每届美国血液学年会上各学者都会从不同角度更新并分析IRIS的结果,可归纳如下:
1)7年时IM组60%患者继续IM一线治疗,而由于不耐受、治疗效果不满意、副作用、疾病进展等原因绝大部分IFN-α+Ara-C组患者转入IM组治疗或中断治疗,仅1. 6%患者继续IFN-α+Ara-C治疗。IM组中断治疗的原因半数与CML无关,包括CML无关死亡、撤销知情同意书和进行造血干细胞移植等,只有8%是由于不良反应,还有15%是由于缺乏疗效/疾病进展。
2)18个月时IM组95%患者获得CHR,85%患者获得MCyR,74%患者获得完全细胞遗传学缓解(CCyR)。到7年时,CHR率达97%,MCyR率达89%,CCyR率达82%。提示IM治疗初治CML慢性期疗效持久确切,证明了缓解强度随治疗时间长而增强,反映了体内残存白血病细胞在长期治疗下可持续减少。
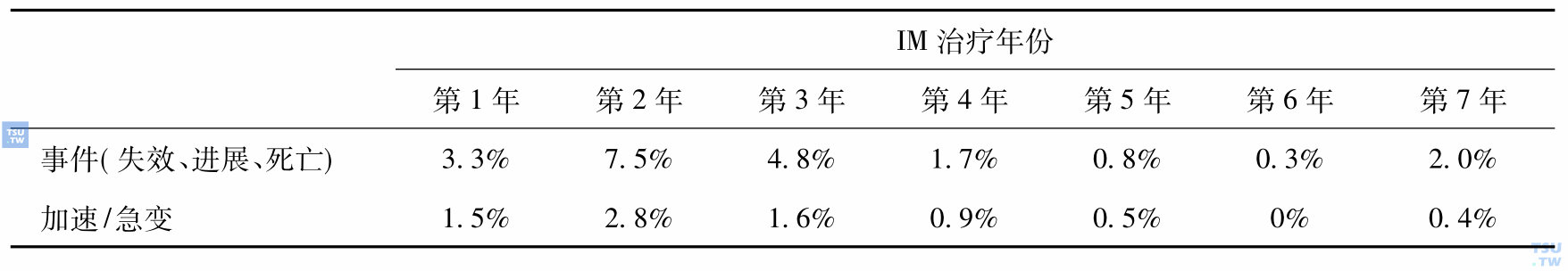
3)8年时IM组无事件生存(EFS)率81%,无加速急变生存(PFS)率92%。IM治疗8年中失效或进展集中在治疗后的前3年,而第2年是高峰,此后逐年递减(表1)。另外当IM治疗获得CCyR之后的第1年有5. 4%失效或进展,此后逐年递减,获得CCyR者3年后加速/急变率为0%。说明长期治疗使体内白血病负荷进一步减少,病情更为稳定,但继续长期治疗是否能达到治愈尚不能确定。
表1 IM治疗CML慢性期的失效或进展率
4)IM组共456名患者达到CCyR,7年时84%仍为CCyR,其中71%继续IM治疗,另外13%由于不良反应等原因中断IM治疗但仍为CCyR。16%的患者获得CCyR后又失去,其中5%失去后再次达到CCyR并继续IM治疗,9%中断IM治疗。IM治疗6个月内、6~12个月、12~18个月、18个月以上达到CCyR的比例分别为52%、19%、7%、10%。可以看出大多数患者(71%)12个月内获得CCyR,不同时间达到CCyR的患者间72个月OS、EFS及PFS率无明显差异,未获得CCyR患者的72个月OS、EFS及PFS率则明显低于获得CCyR的患者。所有达到CCyR的患者持续CCyR时间没有明显差异,也就是说达到CCyR的时间不影响CCyR持续时间。而英国的一份报道持不同意见,认为在1年内获得者CCyR者的5年PFS和OS均明显高于1年后获得CCyR者。治疗12个月获CCyR并获主要分子生物学缓解(MMoR)的患者在72个月时无一例进展,治疗18个月时获CCyR同时MMoR者的预期PFS率为100%,而仅达CCyR但未达MMoR者的预期PFS率是98%,而未达CCyR者的PFS率为87%,明显低于前两者。持续CCyR与MMoR是保证患者长期存活的要素。同时反映了即使疾病基因不被清除,也可获得较长久的无病存活。IM问世前CML年死亡率15%~20%,中位生存期3~4年。历史资料显示CML的4年存活率为43%,IFN-α时代的5 年OS率为68%~70%,进一步证明IM超过了以往的任何药物疗效。
5)Kantarjian等分析了IRIS试验中106例(占20%)因未获预期疗效而增加IM量至600~800mg/d者36个月的疗效。中位加量时间22个月,PFS率89%,OS率84%。他们提出未获预期疗效者应首选增加IM量。但有学者提出应先检测是否存在BCR-ABL区点突变,若有突变应考虑更换二代酪氨酸激酶抑制剂(TKI)。
6)351例患者在服用IM 400mg/d的第29天检测IM血浆谷浓度,近一半的患者(178例,50. 7%)的浓度在647~1170ng/ml之间,87例(24. 8%)低于647ng/ml,86例(24. 5%)高于1170ng/ml,IM血浆谷浓度与细胞遗传学和分子学反应率正相关。
鉴于IM的显著疗效,2008年国际上已公认IM 是CML慢性期的一线治疗。2008 NCCN CML治疗指南1类推荐IM 400mg/d为CML的一线治疗,干扰素不再推荐作为CML的主要治疗选择,删去2007 年NCCN关于异基因造血干细胞移植作为CML一线治疗的推荐,达沙替尼、尼罗替尼作为CML二线治疗的选择。2007年欧洲白血病网(ELN)专家治疗推荐中IM由一线可选择治疗改为一线治疗,并建议IM治疗失败时进行突变检测;异基因移植由一线可选择治疗改为IM治疗失败的二线治疗。除非患者高疾病风险、低移植风险(详见表2和表3),否则药物优于移植;干扰素仅在IM不耐受时可选用,患者生活质量降低是其临床应用的主要缺点;达沙替尼和尼罗替尼作为二线治疗。
表2 Sokal和Hasford危险分层
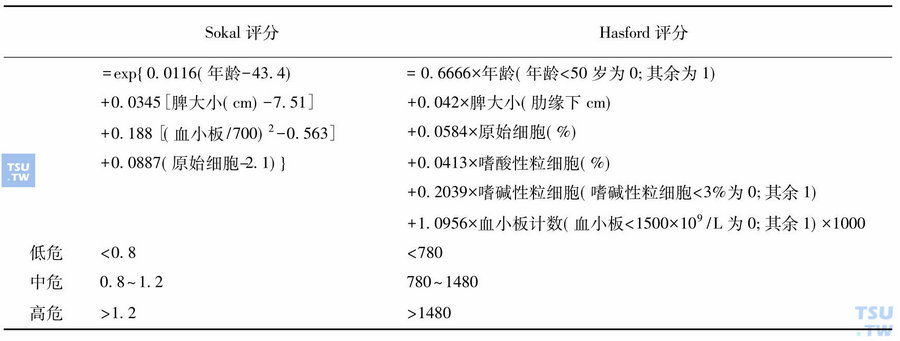
表3 EBMT移植风险评分
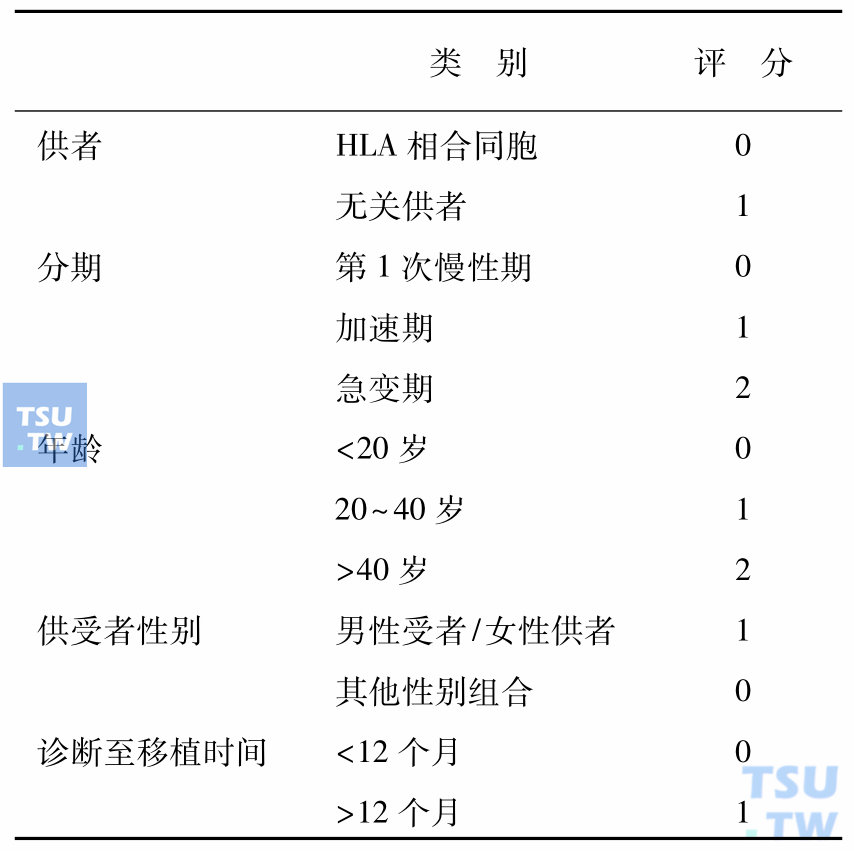
注:0分代表风险最低,7分代表风险最高
IM治疗开始最初2个月每周测定血常规一次,血象受抑时缩短测定的间隔,血象稳定后可每月查一次,达CCyR后可1~3个月复查一次。每3个月复查骨髓包括形态学,染色体核型,实时定量PCR (RQ-PCR)测定BCR-ABL mRNA连续两年。达CCyR者两年后可每6个月复查骨髓。疗效标准见表4。定期监测的目的是及时发现是否治疗失败或疗效不理想(标准详见表5和表6),2008 NCCN CML治疗指南中推荐如果出现治疗失败,并且耐药不是因为出现了对IM高度不敏感的突变,在患者能够耐受的情况下应增加IM剂量至600~800mg/d;若出现了IM高度不敏感的突变如Y253、E255,则应该换用二代酪氨酸激酶抑制剂(TKI)如达沙替尼或尼罗替尼;若为对伊马替尼和其他TKI都耐药的T315I突变则进行造血干细胞移植(HSCT)。如果出现疗效不理想,在患者能够耐受的情况下应增加IM剂量至600~800mg/d,若为高疾病危险、低移植风险患者可进行异基因HSCT。2010 NCCN CML治疗指南中对于IM治疗失败的患者强调了对患者依从性、药物相互作用的评价,并推荐考虑突变分析。ELN 2007专家推荐中特别警告对那些诊断时属于高危组或者有del 9q+或者Ph+细胞出现附加染色体异常(ACA)的患者,以及IM治疗12个月未获得MMoR或者任何时间出现任何的转录水平升高或在Ph-细胞中出现其他染色体异常的患者更应严密的监测,并检查患者治疗依从性。
表4 CML疗效标准
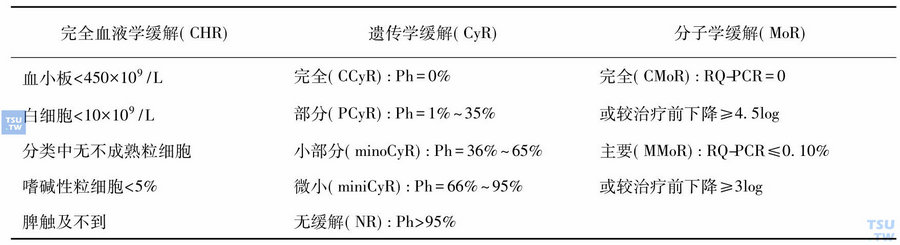
注:有的文献中将CCyR+PCyR统称为主要遗传学缓解(MCyR),有的文献中称Ph=1%~35%为MCyR
表5 伊马替尼治疗失败界定(ELN与NCCN对比)
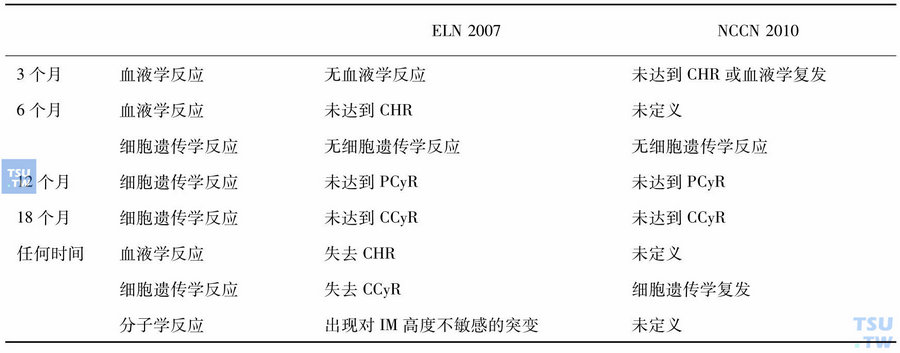
表6 伊马替尼治疗疗效不理想的界定(ELN与NCCN对比)

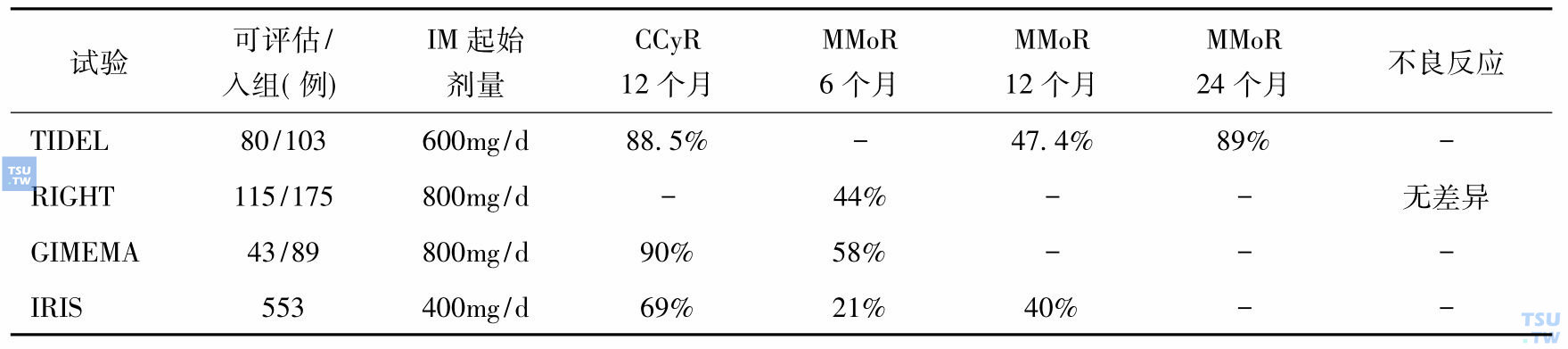
分子学反应监测是评估治疗反应和微小残留病灶/复发监测的重要手段,BCR-ABL mRNA水平降低的水平和时间影响无进展生存,达到MMoR后仍可能丧失MMoR,丧失MMoR或BCR-ABL mRNA水平增高提示复发,丧失MMoR更常见于BCR-ABL转录水平没有持续下降的和无CMoR患者,获得CMoR是新的目标。临床前研究和Ⅰ期研究的资料显示IM治疗存在剂量-疗效关系,有几个试验证实初治CML慢性期患者使用较高剂量IM治疗可获得更早更高的细胞遗传学和分子学反应(详见表7)。上述结果虽可证明高剂量IM可提高和加速疗效,但观察时间尚短,病例数不多,早获CCyR或MMoR者是否肯定能提高长期OS/PFS,减少抗药发生率等尚有待于长期观察。现今治疗CML慢性期的常规剂量仍为IM 400mg/d,疗效不满意时可增量至600~800mg/d,2010 NCCN CML治疗指南推荐在可耐受的情况下直接增量至800mg/d,或改用二代TKI或其他治疗。在2008 NCCN CML治疗指南中2A类推荐更高剂量IM为初治CML慢性期患者的治疗剂量,尤其是高危患者。
表7 高剂量伊马替尼治疗初治CML慢性期患者的试验与IRIS比较
IM治疗CML虽显示了突出的疗效,仍有约15%~20%患者治疗失效。2003年Apperley的报告中提出了抗药分为原发性和继发性(获得性),定义见表8。Hochhaus及Hughes指出抗药可分为血液学抗药、遗传学抗药和分子学抗药。治疗反应失败的时间点判定不能等同于IM耐药,因为部分患者达CCyR时间较晚,并且IRIS试验72个月的结果显示较晚达到CCyR患者生存预后与较早达到者无明显差异。
表8 IM耐药的临床定义

IM耐药的原因很复杂,主要有两方面——白血病细胞以外的因素和白血病细胞因素,前者如由于口服生物利用度不同导致IM血药浓度个体差异大、血清蛋白与IM的高度亲和力影响IM作用于靶细胞、细胞对IM的摄入和排出影响细胞内IM药物暴露;后者又分为BCR-ABL相关因素,如基因突变、不规则扩增、转录和BCR-ABL非依赖因素,如克隆演变、DNA修复功能缺陷、磷酸酶活性减低、干细胞休眠等。为了尽可能地预防IM耐药,应在慢性期早期开始IM治疗:疾病处于越早阶段,治疗后Ph+细胞的清除率越高,并且IM必须从≥400mg/d的剂量开始,低于治疗剂量的IM初始剂量可以导致耐药。迅速减少肿瘤负荷以及最大限度抑制BCRABL激酶活性可能减少治疗中突变风险,使用大剂量IM或多种TKI联合使用可能减少治疗中突变发生。维持有效血药浓度和细胞内伊马替尼浓度是保证治疗效果、克服耐药的重要途径。对IM治疗反应不佳的患者,有必要检测血药浓度,对达不到有效血药浓度患者,应加量保证达到最佳疗效。及时、积极处理不良反应,保证有效剂量治疗。密切监测治疗反应,及时地剂量递增使对标准剂量伊马替尼治疗失败或反应次优患者生存获益。依据细胞遗传学和分子学资料作出治疗决策,如换用二代TKI、进行异基因HSCT或T315I抑制剂试验等。
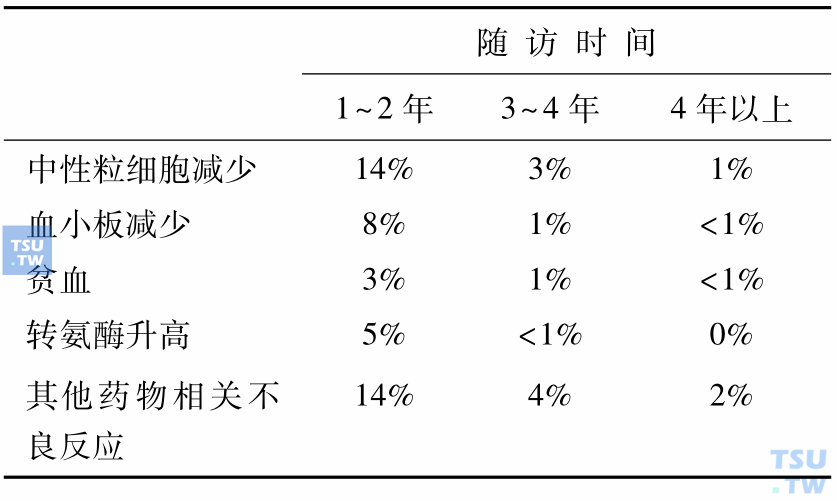
IM常见的毒副作用是水肿,胃肠道反应,皮疹等过敏反应,肌痉挛,骨痛和血细胞减少等。多出现于治疗初期,以1级和2级居多,多可耐受或可控制。严重毒副作用5%。在治疗两年后新发生的3/ 4级毒性少见,心衰发生率<1%。说明IM毒副作用并不因为长期治疗而增加,未见积蓄毒性。从表9可以看出随着IM的持续使用,3~4级不良反应逐年减少。IM治疗CML的血液学不良反应多在IM应用早期或疾病进展时出现,应与疾病进展本身引起外周血细胞减少区别,可以给予成分输血支持和应用粒系集落刺激因子,但是美国FDA指南不支持红系集落刺激因子在髓性恶性疾病中应用。NCCN 2010对于非血液学不良反应的具体策略如下:①腹泻:支持治疗;②水肿:利尿、支持治疗;③体液潴留严重:利尿、支持治疗,减量、暂停或中断治疗,考虑超声心动图检测左室射血分数;④恶心:服药同时进食,大量饮水;⑤肌肉痉挛:补钙、奎宁水;⑥皮疹:激素治疗,减量、暂停或中断治疗。合理处理不良反应是坚持IM治疗取得最佳疗效的保证,因不良反应减量后的剂量应不低于300mg/d。
表9 IM治疗初治CML慢性期的3~4级不良反应率
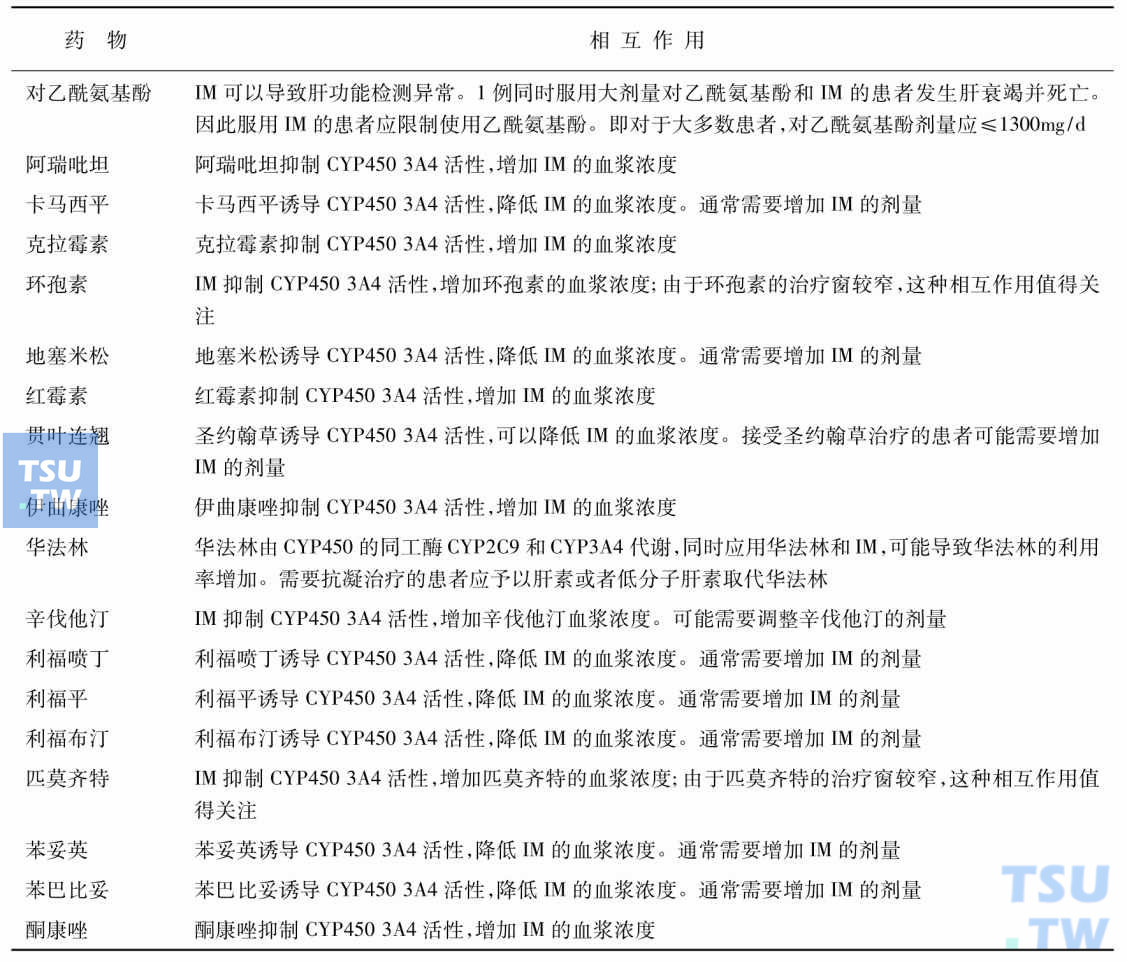
IM半衰期18~22小时,食物对IM吸收影响甚小,IM谷水平与性别、年龄、体重和体表面积不相关,不需依据年龄和体表面积调整剂量。但受多种药物干扰,所以IM治疗期间若患者有其他合并症时应注意药物的配伍。IM对中枢神经系统白血病无预防和治疗作用。细胞色素氧化酶(CY)P450是一组结构和功能相关的超家族基因编码的同工酶,500多种产物,74个家族,至少14个家族与人类有关,许多药物通过CYP450进行代谢,因此存在相互作用。IM可能会引起CYP2D6底物的血药浓度升高,如阿米替林、苯丙胺、阿立哌唑、卡维地洛、氯丙嗪、可待因、氟哌啶醇、丙米嗪、利多卡因、甲氧氯普胺、昂丹司琼、普罗帕酮、普萘洛尔、利培酮、他莫昔芬、曲马多、硫利达嗪等。IM也可能会引起CYP3A4/5底物的血药浓度升高,如对乙酰氨基酚、洋地黄毒苷、胺碘酮、地尔硫■、维拉帕米、奎尼丁、利多卡因、地西泮、咪达唑仑、三唑仑、丙米嗪、卡马西平、氯雷他定、酮康唑、氟康唑、伊曲康唑、红霉素、克拉霉素、环丙沙星、环孢素、环磷酰胺、异环磷酰胺、紫杉醇等。NCCN 2010 CML治疗指南简略列出了IM与其他常见药物的相互作用和应对策略(详见表10)。
如果治疗有效,IM应继续应用多久,目前仍无定论。迄今为止所发表的最大的系列研究中,12例CML慢性期患者获得CMoR后停止IM治疗,其中6例在停药5个月内出现了分子生物学水平复发,但是另外6例在15个月的中位随访期内依然处于完全分子生物学缓解状态。体外研究表明,“静态”白血病干细胞对IM高度耐药,即使获得完全的分子生物学缓解,部分患者体内的白血病干细胞仍可长期存活。总之,在前瞻性的研究提示其他结果之前,对于治疗有效的患者,IM应用多久仍无定论。NCCN 2010 CML治疗指南中对于IM治疗有效的患者依旧不推荐停药。
第二代酪氨酸激酶抑制剂
一、尼罗替尼(nilotinib)
在IM基础上成功研发,临床试验时名为AMN107,商品名Tasigna,是一种高选择性、强效BCR-ABL抑制剂,与ABL的非活化区结合,较IM强25倍,靶点高亲和力是其治疗IM耐药且BCR-ABL突变患者有效的原因,能够抑制除T315I外的32种IM耐药BCR-ABL突变,抑制效应与突变的IC50相关但其IC50和IM不同,说明两药的细胞摄入途径不同。尼罗替尼不能诱导CML-CD34+CD38-细胞凋亡,也不能抑制其磷酸化的CKRL。尼罗替尼的Ⅰ期临床试验结果示绝大多数抗IM的慢性期患者可达CHR,约1/3以上加速/急变期患者可获血液学和遗传学反应。常见副作用是骨髓抑制,胆红素增高、血糖升高、脂肪酶增高和皮疹等。Ⅱ期临床试验共研究320例对IM抗药和(或)不耐受的CML慢性期患者,服用尼罗替尼后77%可达CHR,57%获得MCyR,41%获CCyR,达CHR中位时间1个月,达MCyR中位时间2. 8个月。3/4级血小板和中性粒细胞减少占29%。另一项Ⅱ期临床试验共研究119例对IM抗药和(或)不耐受的CML加速期患者,服用尼罗替尼后54%可获得确认的HR,31%获得MCyR,19%获CCyR,达MCyR中位时间2个月,达CCyR中位时间3. 3个月。严重非血液学不良反应少,治疗对IM不耐受的患者很少出现交叉不耐受。除了对IM抗药和(或)不耐受的患者有良好效果之外,尼罗替尼用于初治CML慢性期患者取得了更加突出的疗效,一项临床试验以尼罗替尼400mg q12h治疗了32例初治CML慢性期患者,3个月时95%患者获得了CCyR、14%获得MMoR,6个月时100%患者达CCyR、54%获得MMoR。在欧美已被批准用于既往治疗失败或不耐受(包括IM)的慢性期和加速期CML,推荐剂量是400mg q12h。在中国已于2009年上市。
表10 NCCN 2010 CML指南——药物相互作用
二、达沙替尼(dasatinib)
临床试验时名为BSM-354825,商品名SprycelR,按研发的化学家Jagabandhu Das命名为dasatinib。是一个口服的多种酪氨酸蛋白激酶抑制剂,可以特异性抑制BCRABL、SRC家族、c-Kit、EPHA2和PDGFRβ。对BCRABL激酶的抑制能力是IM的325倍。它可以作用于BCR-ABL的活性和非活性两种构象,所以可克服P-loop、BCR-ABL活化环和羧基末端的点突变,体外实验显示对19种IM耐药突变有效,但同样不能抑制T315I突变,不能诱导静止期原始CML干细胞死亡。口服生物利用度14%~34%,同样被CYP3A4代谢。疗效与突变类型的IC50相关。START-C是一项观察达沙替尼70mg q12h治疗IM治疗失败/不耐受CML慢性期的Ⅱ期临床研究,共387例患者,6个月时90%获CHR、45%达MCyR、33%达CCyR,8个月时90%获CHR、52%达MCyR、39%达CCyR,15. 2个月时91%获CHR、59%达MCyR、49%达 CCyR,24个月时62%达MCyR、53%达CCyR。中位随访15. 2个月,PFS率90%,OS率96%。获MCyR 的230例中进展率为3%。
骨髓抑制较重,大约一半的患者出现3/4级中性粒细胞减少和血小板减少,并且同时出现血小板功能障碍。常见的非血液学不良反应主要有腹泻、皮疹、头痛、水肿、出血、肌痛、乏力、神经病变、记忆力损伤、眩晕等,比较突出的是35%的患者出现了胸腔积液,其中9%为3/4级;另外有4%出现充血性心力衰竭,其中3%为3/4级。START-A是一项观察达沙替尼70mg q12h治疗IM治疗失败/不耐受CML加速期的Ⅱ期临床研究,8个月时39%获CHR、33%达MCyR、24%达CCyR,24个月时50%获CHR、40%达MCyR、33%达CCyR。骨髓抑制较慢性期患者更重,约四分之三的患者出现3/4级血液学毒性,其中82%的患者出现3/4级血小板减少。非血液学毒性与慢性期患者类似,但是消化道出血较突出,11%的患者出现了3/4级消化道出血。一项Ⅲ期临床试验共观察了670例IM耐药和(或)不耐受的CML慢性期患者,比较达沙替尼100mg qd、50mg q12h、140mg qd和70mg q12h的疗效。中位随访8个月,CHR 86%~92%,MCyR 54%~59%,CCyR 41%~45%,四组达到遗传学缓解时间相同,100mg qd与70mg q12h两组出现胸腔积液的比率分别为7%、16%(P= 0. 024),3/4级血小板减少发生率分别为22%、37%(P=0. 004),需减量的比率分别为30%、55%,停药率分别为16%、23%。
由此证明了达沙替尼100mg qd既可保持药效又可减少副作用,从而推荐CML慢性期用量为100mg qd。一项临床试验以达沙替尼100mg qd治疗了37例初治CML慢性期患者,3个月时79%患者获得了CCyR,6个月时94%患者达CCyR,12个月时100%获得CCyR。达沙替尼治疗IM耐药的CML加速、急变期或Ph+急性淋巴细胞白血病的疗效并不理想,仅半数以下患者可获血液缓解,30%~40%获MCyR,几乎全部的急淋变患者和Ph+急淋患者在半年内复发。该药已在欧美各国上市。关于达沙替尼易出现胸腔积液的原因尚不清楚,目前经单中心回顾性分析提出有三个独立的预测因素:①既往使用达沙替尼出现皮疹;②有自身免疫疾病病史;③高胆固醇血症。另一个比较特殊的毒性是血小板功能障碍,由于可在血小板计数正常时发生,因此接受达沙替尼治疗的患者应避免同时使用其他抑制血小板功能的药物。
达沙替尼与尼罗替尼均可使IM耐药的CML慢性期患者获得CHR,但仅50%可获得CCyR。提示这些病人最终会TKI治疗失败,失效原因或许与等待时间长有关。达沙替尼和尼罗替尼均可致新突变。有报道证明尼罗替尼耐药的CML患者对达沙替尼有效,或达沙替尼耐药的CML患者用尼罗替尼有效。应该如何选择二代TKI?从疾病分期考虑,如为疾病晚期——急变期时,首先考虑达沙替尼;病情相对稳定时,可能会首先考虑毒副反应相对轻的尼罗替尼。从药物毒副作用方面考虑,患者有胰腺炎病史或年轻肥胖易患胰腺炎时,首先考虑达沙替尼,老年有充血性心力衰竭病史的患者首先考虑尼罗替尼。从基因突变方面考虑,如为Y253F/H突变选择达沙替尼,V299L突变选择尼罗替尼。总之,应依据医生经验,病人特点,终止IM的原因,突变类型,可能发生的药物副作用等,个体化治疗。
三、伯舒替尼(bosutinib)
临床试验时名为SKI-606,是ABL和SRC的强效双相激酶抑制剂,但不抑制PDGFR和c-Kit,可下调VEGF介导的血管通透性和肿瘤细胞的外渗物,可克服除T315I外多数ABL点突变。Ⅱ期临床试验观察115例IM耐药和(或)不耐受或曾用过达沙替尼或尼罗替尼的CML慢性期患者,用量为500mg/d,中位治疗5个月,89%获得CHR,41%达MCyR,30%达CCyR,33%达MMoR,19%达CMoR。有/无突变者有效率相同。耐受性好,3/4级血小板减少发生率14%,3/4级中性粒细胞减少发生率19%,有少数患者发生水潴留或胸腔积液。消化道不良反应是最常见的非血液学不良事件,68%患者出现腹泻(7%为3~4级)。另有报道伯舒替尼治疗57例IM耐药和二代TKI耐药的CML加速/急变患者,中位治疗2. 7个月,约1/3患者达CHR和MCyR,达MCyR时间为8. 9~12周,维持MCyR已18周。19例接受分子学检测者中有4例获MMoR,3例获CMoR。证明了此药对已上市的TKI抗药的各期CML均有一定的疗效,欧美国家有望在短期内获准上市。
四、INNO-406(CNS-9,NS-187)
和尼罗替尼相似,是IM的衍生物,对T315I突变体无效。试管内实验证明其对BCR-ABL激酶的抑制能力是IM的55倍,靶向BCR-ABL及Lyn激酶(但对其他SRC家族成员不抑制)。可克服除T315I外大部分ABL点突变。耐受性好,可致转氨酶升高。其特点为可以通过血脑屏障,在Ph+急淋中有一定优势。
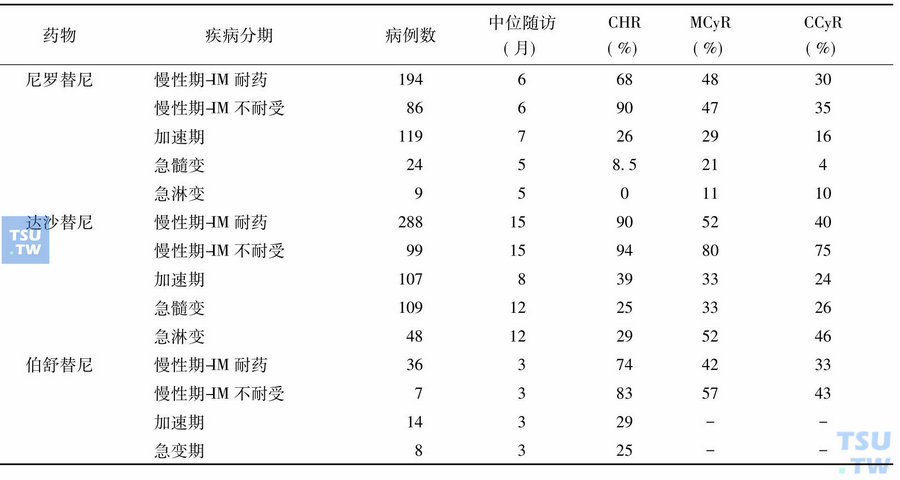
近年来有关二代TKI用于治疗IM耐药/不耐受的各期CML患者的Ⅰ期和(或)Ⅱ期临床试验非常多,主要是上述前三种,将其不同分期的血液学及细胞遗传学治疗结果简单归纳为下表。
二代酪氨酸激酶抑制剂的Ⅰ、Ⅱ期临床试验结果
造血干细胞移植(HSCT)
异基因造血干细胞移植(Allo-HSCT)是目前唯一可以使CML患者达到治愈的方法。但是并非所有CML患者均可采用,受年龄和供者的限制。另外HSCT存在移植相关死亡和远期并发症的风险,移植前又难以预测。以IM为代表的酪氨酸激酶抑制剂治疗CML的巨大成功,撼动了HSCT治疗CML的绝对地位,使得1999年以后CML移植患者的数量显著下降。IRIS试验的7年杰出疗效更使得“伊马替尼作为几乎所有初发CML患者的一线治疗”这一观点得到了广泛的认同。自2008年始,NCCN指南上推荐将HSCT用于IM治疗无效的慢性期患者,或加速期、急变期的患者。另外对已发生BCR-ABL区点突变的患者特别是达沙替尼和尼罗替尼所不能控制的突变是HSCT的适应证。目前移植的现状是多数CML患者移植前曾使用过IM,为了解移植前IM的应用对移植结果的影响,美国西雅图一组学者报道145例在移植前用IM至少3个月的CML患者与历史对照1999~2004年移植前未用过IM的231例患者进行比较,认为移植前应用IM不增加肝毒性或延缓植活,IM不影响OS率、无疾病存活率、复发及无复发死亡率。但IM疗效欠佳或失效者较获得CCyR/MCyR者的预后差。IM对CML慢性期、加速期和二次慢性期总体生存无影响,可增加急变期移植总体生存率。国际血液和骨髓移植登记研究中心(CIBMTR)82中心1999~2004年的资料进行回顾分析,移植前应用IM组(IM+组)共409例,移植前无IM应用组(IM-组)共900例,配对分析结果显示第一次慢性期CML患者移植前应用IM可提高生存率(RR:0. 48,P = 0. 001),除外第一次慢性期的其他CML患者(如加速期)IM应用未增加移植后并发症和移植相关死亡率。对无白血病事件生存和急性移植物抗宿主病(aGVHD)无明显差异。
如何选择CML的移植方式?CML慢性期的患者进行HLA匹配的同胞供者骨髓移植时,3年存活率约55%~70%,复发率约20%,20%~30%患者死于骨髓移植的相关并发症,通常为感染和GVHD。影响骨髓移植疗效的因素可能与组织配型的相容性、病期、供者与受者的年龄性别、预处理方案、GVHD程度、移植前治疗、T细胞去除等因素相关,欧洲骨髓移植组提出了移植风险评分以更好地判断预后。有一组单中心资料的回顾性分析显示非清髓性Allo-HSCT在总生存方面优于清髓性Allo-HSCT,但其复发率高于清髓性组,急性GVHD两组相似,慢性GVHD在非清髓性组高于清髓性组。异基因外周血HSCT与异基因骨髓移植相比,前者造血重建和免疫重建更快,二者近期疗效相似,但GVHD发生率增多,远期疗效尚待确定。HLA配型相合的同胞一直是异基因HSCT的最佳供者,但在同胞中,HLA完全相合的概率仅为25%,而随着我国独生子女家庭的普及,HLA相合的同胞供者将逐年减少,如何跨越HLA的免疫屏障,使HLA配型不合的移植成为常规一直是人们的理想。随着移植技术的不断进步,HLA相合的非血缘供者移植、单倍体血缘供者HSCT以及脐血移植越来越多,相信移植技术的完善将最终解决供者来源的问题。GVHD、感染一直是移植最常见的并发症。随着对并发症的认识不断深入、诊断技术的发展、新型药物的推出以及经验性治疗的早期应用等,移植相关死亡率逐渐降低。IM问世前CML患者自体移植与药物治疗组相比,无生存优势。伊马替尼应用达CCyR患者可成功动员BCR-ABL阴性CD34+细胞,对CML进展无影响。伊马替尼体内净化后自体移植,可能是异基因移植后挽救治疗的可行性方式。
强烈的移植前预处理方案并不能完全清除CML患者体内的白血病克隆。移植后BCR-ABL阳性细胞的数量变化预示着疾病的转归,连续增高的BCR-ABL转录水平预示着疾病的复发,因此移植后应密切监测微小残留病(MRD)的变化。CML患者移植后长期生存依赖移植后异体反应诱导的移植物抗白血病(GVL)效应,这也是移植后复发患者进行供者淋巴细胞输注(DLI)治疗的理论依据,目的是诱发GVL,DLI可使约75%复发患者再次获得CR。
尽管上面已经提到现在CML慢性期的治疗进入了分子靶向治疗时代,但在我国TKI高昂的费用是个实际问题,而且我国Allo-HSCT治疗CML的疗效好,长期生存可以达到75%以上,因此对于年轻的第一次慢性期患者具有配型相合的亲缘供者时仍可首选Allo-HSCT,若无HLA相合供者,则首选IM;非亲缘及HLA不合HSCT最好推迟至疾病有进展时进行。一方面医生应该严格地掌握移植的适应证,制定个体化移植方案,选择合适的供者、适当的移植时机以及适宜的移植方式。另一方面应该努力改进移植技术,提高CML慢性期患者移植的生存率,提高生存质量,比如:改良预处理方案,用IM联合非清髓性预处理;通过CD34+细胞移植联合DLI减少GVHD;加强MRD监测,及时应用DLI、IM进行干预治疗。
脾切除术
20世纪70年代国内外推崇脾切除术,但后来的研究证实此法不能延长慢性期或生存期,不能提高生存质量,已少应用。只有在少数情况下如巨脾引起不适、脾梗死、脾破裂、出现脾功能亢进症状时才考虑切脾治疗。
新的治疗措施
VX-680:也称MK-0457,极光激酶抑制剂(Aurora Kinase Inhibitor),可抑制T315I突变和JAK2。Ⅰ期临床试验治疗11例T315I突变的CML,经8~40mg/(m2•h)持续静脉滴注5天,9例有效,其中4例获得细胞遗传学疗效(1例CCyR,2例PCyR,1例mCyR)。骨髓抑制较重,未见4级毒性,可发生黏膜炎。
PHA-739358:靶向BCR-ABL和Aurora激酶A-C,抑制组蛋白H3,CKRL磷酸化和Aurora B活力。对BCR-ABL阳性(包括T315I突变)和阴性细胞具有抗增殖和抗凋亡作用。对未治CML-CD34+细胞有强烈抗增殖作用。
AP23464:为嘌呤类似物,抑制SRC和ABL激酶,在细胞株实验中抗增殖,阻断细胞周期,促凋亡。AP23464可抑制T315I,但有非细胞毒作用。
virinostat:是一种全组蛋白脱乙酰基酶抑制剂(hydroxamic acid inhibitor,HDACI)。已获准治疗皮肤T淋巴瘤。临床前实验证明它可激活外源与内源性细胞凋亡,诱导氧化损伤,诱导自体吞噬的细胞死亡和衰老。通过抑制ClassⅡHDAC6导致乙酰化和伴侣蛋白Hsp90的失功能,它防止了包括BCRABL等蛋白的复合物形成、聚泛素化和蛋白水解。可增强IM及其他TKI的作用,可与极光激酶抑制剂干扰有丝分裂。以virinostat加MK-0457可抑制原代CML-34+细胞,T315I、E255K、K351T突变的BaF3细胞和IM耐药的K562(BCR-ABL不依赖性,Lyn依赖性)细胞,使野生型和突变BCR-ABL失活和下调。
反义寡核苷酸:以BCR-ABL为靶标设计的反义寡核苷酸可以降低BCR-ABL的转录水平和体外培养的CML细胞的增长(可能通过诱导凋亡),现主要用作CML自身干细胞移植的“净化”。已有用BCR-ABL和C-MYB反义寡核苷酸体外净化后骨髓成功植活和获部分细胞遗传学缓解的初步报道。反义寡核苷酸联合化疗药物方案现已在SCID小鼠动物实验证实可显著延缓白血病的发生。
基因治疗:已有用逆转录病毒载体构建的BCR-ABL反义基因联合一个MTX耐药基因的所谓“双基因治疗策略”的报道,体外实验结果表明该方法可用于CML自身干细胞移植体外净化和移植后化疗,以进一步根除微小残留病。
免疫调节治疗:现已有具有免疫源性的P210 BCR-ABL融合片段和结合主要组织相容性Ⅰ类抗原等位基因复合物多肽的报道,亦已建立识别BCR-ABL表达细胞的肽特异性CD4+T细胞系,体外实验证实利用肽特异性CD4+T细胞可以使P210 b3a2产物降解。这些结果提示可以用人T细胞介导的肿瘤相关抗原的识别来进行CML的治疗。此外,有治疗潜能的还有白介素2激活NK细胞和细胞毒T细胞。CML患者自身NK细胞能抑制CML祖细胞生长,因此,可利用自身激活的NK细胞经体外扩增后用于自身干细胞移植净化和CML免疫治疗。最近,又有实验发现CML患者骨髓体外培养获得的树突状细胞能刺激自身细胞,并具有抗增殖作用,而抗正常骨髓活性极低,提示该方法可用于CML的过继免疫治疗。
法尼基转移酶抑制剂(tipifarnib):PI3K/ AKT信号传导调节抑制剂LY294002、西罗莫司以及BCR-ABL P210蛋白疫苗等均在试验中。
治疗策略的选择
随着CML治疗方法的不断增多,应根据病人具体情况制订出一个最佳的个体化治疗方案,美国NCCN指南和欧洲白血病网专家推荐每年都在更新CML的治疗指南。正如上述,目前国际上已公认IM 为CML慢性期一线治疗,但是在我国IM高昂的费用成为限制其广泛应用的瓶颈。Allo-HSCT在国内仍作为CML的一线治疗,但是Allo-HSCT受年龄、供者以及医疗费的限制,同样不能使中国的大部分CML患者受益。中国还有很大一部分初治CML慢性期患者在接受干扰素治疗,甚至仅仅接受羟基脲治疗。作为中国的血液学工作者应该向CML患者细致地介绍CML的自然病程以及几种可选治疗方案的优缺点,再根据患者的年龄、有无合适供者、疾病危险分层以及经济状况等因素与患者共同商讨出最适合的个体化治疗方案,使我国的CML患者得到最佳的治疗方案。
