根据临床线索筛查GH瘤
详细病史和体格检查是诊断的基本依据,实验室检查和特殊检查有助于确定疑难病例的诊断,为防止漏诊非典型病例,对所有的垂体瘤患者都要行血PRL、GH和IGF-1测定。从存在下列表现的患者中筛查GH瘤,有助于本病的早期诊断:①身材过高或全身骨骼均匀性增长变粗、面貌改变、肢端肥大、多汗、关节及肌肉疼痛;②血GH和(或)IGF-1明显升高,且缺乏睡眠依赖性分泌特点,熟睡后1小时内的血浓度高峰消失;③多囊卵巢综合征(PCOS)样表现,但生化检查不支持其诊断;④不明原因的血磷升高;⑤不明原因的糖代谢异常;⑥不明原因的视力障碍。
巨人症/肢端肥大症诊断包括功能评价/肿瘤定位/生物学行为判断
肢端肥大症/巨人症的诊断应包括下列项目:①明确是单一的垂体GH瘤、GH/PRL瘤或其他导致GH分泌过多的病变(如GHRH分泌异常);②判断GH瘤的良恶性特征以及肿瘤的活动性;③是否存在垂体功能减退、继发性糖尿病、视力障碍等并发症;④排除多发性内分泌腺肿瘤(MEN)和G蛋白病(如McCune-Albright综合征)可能。
功能诊断与定位诊断
- 典型GH瘤诊断:典型病例的诊断并不困难,一般根据患者的特征性外貌及其他典型临床表现,结合血GH和IGF-1测定结果,即可确立诊断。肢端肥大症/巨人症的血GH诊断标准是:在没有应激情况下,随机血GH≥0.4μg/L,或OGTT时的GH最低值≥1.0μg/L(应用敏感方法测定时可能更低)。正常人OGTT时,GH开始下降,而当血糖降至正常时GH升高,而GH瘤者的GH分泌不被抑制。GH瘤对OGTT的反应有3种类型,约1/3的GH升高,1/3无变化,1/3呈中度下降。
- 垂体GH微腺瘤诊断:较困难,多依赖于高分辨CT 或MRI检查,但其结果不能作为诊断或排除诊断的依据;如果血GH明显升高,即使CT或MRI阴性,诊断亦可成立。
- GH瘤作为伴发症的诊断:偶尔,垂体GH细胞增生或GH瘤可见于多发性内分泌腺肿瘤综合征、Carney复合症或McCune-Albright综合征。因为这些遗传综合征均有各自的特殊临床表现,故诊断一般无困难。
- 异位GHRH/GH瘤诊断:以类癌最常见。当40岁以上患者出现肢端肥大症表现数年,血GH、GHRH升高,垂体CT或MRI检查无异常发现时,应警惕异源性GHRH/GH综合征(罕见),需进一步行胸部X线照片、腹部B超或胸、腹部CT、MRI以寻找原发肿瘤病灶,必要时可考虑111In-奥曲肽闪烁照相检查。诊断依据是:①血GHRH和GH升高;有的患者血GHRH可高达0.3~5μg/L(0.3~5ng/ml);正常空腹GHRH常低于60ng/L(0.06ng/ml),而垂体GH瘤致肢端肥大症患者的外周血GHRH低于200ng/L(0.2ng/ml)。TRH兴奋后,几乎所有患者的GH都呈反常性升高,而对外源性GHRH刺激无GH分泌增加的反应,但不能以此作为诊断和鉴别诊断的依据,因为肿瘤细胞在体外培养时可分泌GH,而血中GHRH检测不到。②无垂体瘤依据,但GH细胞增生可引起垂体扩大;③垂体外组织存在肿瘤,且其组织的动静脉GHRH和GH的浓度梯度明显;④手术切除异位肿瘤后临床症状消失,血激素水平转为正常;⑤异位肿瘤合成和分泌GHRH多肽。
活动性和生物学行为判断
GH瘤病情活动或病情加重可从以下几个方面来判断:①肢端进行性增大;②视野进行性缩小;③头痛、多汗、关节和肌肉疼痛加重,或出现溢乳、高钙尿症、高磷血症或高磷酸酶血症;④继发性糖尿病症状加重;⑤血GH或IGF-1明显升高。⑥IGFBP-3是由GH通过IGF-1诱导产生的,在肢端肥大症活动期,IGFBP-3升高。在判断疾病是否处于活动期以及手术疗效方面,血IGFBP-3 比IGF-1更有价值。作葡萄糖抑制试验时,有的患者虽血清GH及IGF-I被抑制,但IGFBP-3仍升高。正常成人的血IGFBP-3为2~4mg/L,而病情活动的本病患者常>10mg/L。
建议每数月监测1次血清GH和IGF-1。在大多数情况下,血清IGF-I是监测肿瘤活动性的重要指标,尤其在使用GH受体拮抗剂(培维索孟)后,因为不能用GH作为评价指标,故血清IGF-I测定显得更为重要。血清GH和IGF-1的变化是一致的,但也可出现分离现象。如果血清IGF-1正常而葡萄糖不能抑制GH的分泌,说明患者的病情并没有完全恢复。另一些患者的GH正常而IGF-1仍明显升高,此时需要排除营养不良、甲状腺疾病等情况。如果不存在上述原因,那么应重点以IGF-1水平作为判断依据。肢端肥大症活动期的血钙轻度升高,如血钙显著升高要考虑MEN-1可能,同时测定血清PTH有助于鉴别;当存在低血糖时,应高度怀疑为MEN-1(伴胰岛素瘤)。尿钙排泄增多和血磷升高是病情活动的重要指标,但必须排除肾功能不全后才有意义。活动期患者血清碱性磷酸酶升高,常伴糖耐量减退或糖尿病。血PRL升高提示肿瘤同时分泌PRL(GH/PRL瘤)或肿瘤压迫了垂体柄。多次检测发现血GHRH升高应考虑垂体外肿瘤异位分泌可能。持续的血GHBP降低提示肢端肥大症处于活动期。此外,血FT4、睾酮测定有助于了解肿瘤压迫垂体的程度。
血GH正常不能否定GH瘤而轻度升高不能诊断GH瘤
正常GH分泌
人GH呈脉冲式分泌,具昼夜节律分泌特征,但受睡眠、运动、应激及代谢变化的影响。GH的分泌有睡眠依赖性分泌(sleep-entrained secretion)特点,熟睡后1小时内的血浓度最高。因此,正常人血GH值可在不可测得至30μg/L内波动。应用放射免疫法测得的血清GH最低值仅1.5~2.0μg/L,其灵敏度为0.5μg/L,但仍有50%~80%的正常人的基础值低于此值。免疫荧光或免疫发光测定的灵敏度达0.005~0.01μg/L,可准确地测得正常人的血GH基础水平。放射免疫分析技术是检测GH的免疫反应性水平,而不是生物活性。GH要发挥其生物效应必须与其特异性受体结合。用免疫放射受体法测得的结果能更好地反映GH的生物作用。
每日的GH分泌有5~10个峰,峰值2~40μg/L,峰间谷值<0.2μg/L,正常人在运动、应激或GH分泌高峰时取血,血GH值偏高(女性明显)。肢端肥大症患者的GH分泌丧失昼夜节律性,但仍保持着间断的脉冲式分泌,其血浓度的个体差异较大。GH在血中的半衰期为20~25分钟,故测定血GH分泌谱时,每5~20分钟取血1次,连续多次。有报道年龄每增加10岁,其血GH值下降7μg/L,GH检测的误差较大,仅1次血GH测定不能作为诊断的依据。
血GH组分不均一性
血清中的GH组分很不均一,含有20kD、22kD的GH聚合体等多数形式。在多数情况下,患者血中过量的GH主要是分子量为22kD的GH单体。随着其浓度的升高,出现GH受体下调。编码GH受体的细胞外序列与GHBP相同。用FPLC凝胶色谱法区别结合GH与游离GH,发现患者的GHBP水平明显下降,经奥曲肽(octreotide)治疗或手术切除垂体瘤后,其GHBP水平又恢复正常。患者血中存在GH受体抗体,用色谱法分离和Nb2法在肢端肥大症患者血清中发现IgG,且其血中的GH和IGF-1也升高。
测定血GH谱是确诊GH过度分泌的较佳方法。因可了解血GH增高的组分及其比例,资料提示,GH谱可能与血GH浓度有关,口服葡萄糖后的血清中以20kD GH为主,而行TRH/GnRH刺激后,血中以22kD的GH占优势。但由于个体的GH谱是未知的,所以其价值有限。血液中的GH 以22kD为主(约占全部GH免疫活性的25%),按WHO规定的国际标准(WHO international standard for somatotropin,international reference protein 88/624,1994)可明显提高测定的准确度。
GH瘤的GH变化
患者血GH基础值比正常人升高数倍至数十倍,多在1μg/L以上,GH脉冲分泌峰频率增多2~3倍。垂体GH瘤大多呈GH自主性分泌。患者分泌GH脉冲频率增加,且血GH基础值与空腹结果均增高(轻症及老年患者取血为分泌峰的谷值时,增高可不明显)。如果血GH处于临界值,可留置静脉导管,每5~20分钟采血1次,进行24小时动态测定(建议同时测定血清IGF-1水平,见后述)。
血IGF-1显著升高是GH瘤的确诊依据
血IGF-1能反映慢性GH过度分泌,这是由于:①肢端肥大症的临床表现主要是由于IGF-1的作用增强所致;②血IGF-1持续升高或既往有过肿瘤的患者特别易于伴发结肠、直肠、甲状腺、胃等部位的肿瘤,男性较女性具更大危险性;③患者血清IGF-1浓度与病情活动性及测定前24小时血GH值相关,故能反映测定前24小时分泌的GH的生物作用;④血IGF-1与IGF-1结合蛋白结合,半衰期长,其血浓度在24小时变化很小,且不受取血时间、进餐与否、睾酮和地塞米松等的影响;⑤病情较轻者,血GH仅稍增高,但血IGF-1多明显升高;⑥GH对低血糖症的反应迟钝、GH缺乏脉冲性分泌特点,而血IGF-1和PRL升高显著,可能与组织对GH特别敏感有关。解释血IGF-1结果时须注意以下两点。
血GH与IGF-1的关系
血GH与IGF-1水平呈对数性而非直线关系 当血GH高于20μg/L时,血IGF-1即达高峰平台,也是GH刺激肝脏合成IGF-1的最高有效水平。这可解释为什么不同GH水平的患者的病情活动性可以相似;由于GH分泌呈脉冲式,峰值与谷值相差较大,故不能仅靠基础GH值来诊断本病。一般可根据需要和重点怀疑的病因选择必要的检查,如T3、T4、FT3、FT4、TSH、ACTH、皮质醇、LH、FSH、PRL、睾酮、雌二醇等。
排除以上影响因素,一般成年人IGF-1浓度超过333μg/ L时可确诊肢端肥大症。若患者临床上有肢端肥大,但血IGF-1正常,应怀疑有IGF-1结合蛋白缺乏、GH分泌瘤栓塞、病情处于非活动期或为类肢端肥大症。
血GH与IGF-1的影响因素
IGF-1测定的影响因素较多,取血后应及时分离,储存及运输时标本处理应恰当,测定前应去除IGF-1结合蛋白,否则易出现假阳性或假阴性结果。青春期儿童的血IGF-1较高,而老年人轻度肢端肥大症患者的血IGF-1可在正常值范围内(55岁以上人群),易导致误诊或漏诊。糖尿病患者病情控制不良时刺激肝脏产生IGF-1,导致血IGF-1升高。血IGF-1受营养状态影响,伴营养不良、饥饿及肝病时血IGF-1下降。妊娠妇女的血IGF-1升高,可达正常人的2~3倍。胎盘能分泌胎盘GH,故妊娠时有肢端肥大症面容、皮肤变粗、手脚增大、出汗增多等表现。
动态试验协助GH瘤诊断
口服葡萄糖抑制试验
为临床确诊肢端肥大症和巨人症的常用试验。患者口服葡萄糖后,分别于服葡萄糖前30分钟,服葡萄糖后30分钟、60分钟、90分钟和120分钟采血测GH。正常人于服糖120分钟后,GH降至2μg/L或更低,男性(<0.05μg/L)比女性(<0.5μg/L)降低更显著。多数肢端肥大症患者血GH不降低,呈矛盾性升高,GH对葡萄糖无反应或部分被抑制。应用此试验的困难是血GH在1~3μg/L的活动性肢端肥大症患者,不能用降至2μg/L以下作为诊断标准。近来用免疫发光技术测得口服葡萄糖后正常年轻女性和男性的血GH分别抑制到0.2μg/L及0.1μg/L以下,如OGTT时的GH最低值在1.0μg/L以上有诊断价值。但尚需在各种人群尤其是在血GH较低的肢端肥大症患者中取得更多的资料来验证其应用价值。
OGTT同时测定GH 有助于轻度高GH血症的诊断,但对诊断的GH截点仍有不同意见,因为GH截点受分析方法、分析的敏感性、年龄、性别等多种因素的影响。用高敏GH测定法发现,GH的正常最低值为0.71μg/L(女性),而男性的正常最低值可能为0.057~0.25μg/L。因此以前诊断共识提出的1μg/L切割值(2000)应予废除,而代之以0.30μg/L作为截点。在估计治疗反应时,更实际的做法是根据多项观察指标(如IGF-1)进行评价。
TRH兴奋试验
用于GH瘤术后复发的预测。TRH兴奋试验对血GH正常而IGF-1升高患者的诊断有一定帮助,注射TRH后的GH升高反应为非特异性。本试验偶可诱发垂体GH瘤出血,亦不能鉴别GH瘤和异源性GHRH瘤。正常人对静脉注射TRH 200~500μg无GH分泌反应,但肢端肥大症患者多有反应,其机制为:①垂体GH瘤细胞不成熟,其GHRH受体缺乏特异性;②GH瘤细胞识别TRH不受下丘脑的控制。静脉注射TRH 200~500μg,分别于注射前15分钟,注射后即刻、15分钟、30分钟、45分钟、60分钟、75分钟、90分钟及120分钟检测血GH(以TSH或PRL作为内对照),GH上升50%或GH浓度高峰值达到5μg/L为阳性反应(75%)。GH分泌被TRH兴奋表明有残留肿瘤组织,故可用来预测手术后复发的可能性。但TRH在一些非肢端肥大情况下可刺激GH分泌,如未控制的糖尿病、饥饿、肝肾衰竭、抑郁症、精神病及健康年轻妇女。
其他动态试验
目前应用的其他动态试验有:①多巴胺抑制试验:正常情况下,多巴胺(通过下丘脑)间接促进GH分泌,GH瘤患者应用多巴胺后,GH分泌受抑制,大概是多巴胺直接作用于瘤细胞,抑制GH分泌所致。静脉注射用量为每分钟5μg/kg,于注射后即刻、15分钟、30分钟、60分钟、90分钟、120分钟采血测GH(平均抑制率为70%)。②精氨酸抑制试验:精氨酸通过抑制生长抑素使GH分泌增加,肢端肥大症活动期可表现为无反应。试验前1天晚餐后禁食,次日早晨在空腹休息时静脉滴注L-精氨酸0.5g/kg(溶于250ml生理盐水中),持续滴注30分钟,于滴注即刻、30分钟、60分钟、90分钟及120分钟采血测GH。③L-多巴(L-dopa)试验:原理同多巴胺试验,试验前1天晚餐后禁食,次晨上午口服L-多巴500mg,于即刻、30分钟、60分钟、90分钟及120分钟采血测GH,L-多巴抑制功能比多巴胺弱,但如出现抑制作用,常提示为肢端肥大症。
GHRH曾是GH瘤的诊断试验,现已禁用。GH释放肽(GHRP)引起GH释放。另一种不同于GHRH受体的受体被克隆并在垂体和下丘脑内表达,其化学结构为异三聚体的GTP结合蛋白耦联受体,可介导几种合成肽类(包括GHRP)物质的GH分泌效应。这些发现预示,内源性选择性配体参与了GH的调节。在肢端肥大症患者,GHRP刺激GH分泌,其方式不同于TRH和GHRH诱导的GH分泌,但静脉注射100μg的GHRP-6后,GH分泌的反应性和平均高峰时间与TRH兴奋试验结果相似。
影像检查提供诊断信息
全身骨骼均匀性增长变粗,二次骨化中心出现及愈合均可延迟,在颅骨及手足骨具有较典型的X线表现,但骨皮质与骨松质密度及结构一般正常。内外板增厚、以板障增厚为著;下颌骨升支伸长、下颌角变钝、体部前突,咬合时下齿在上齿之前,鼻窦及乳突均气化过度。末节指骨骨丛增生呈花簇状为其特征,可并有手足骨增粗、骨皮质增厚、关节间隙增宽、掌骨与近侧指骨头部小的外生骨疣。跟垫软组织增厚(>23mm),椎体增大,椎体后缘呈贝壳样变形,胸椎体楔形变及脊柱后突畸形。
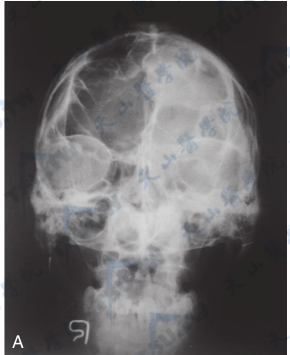
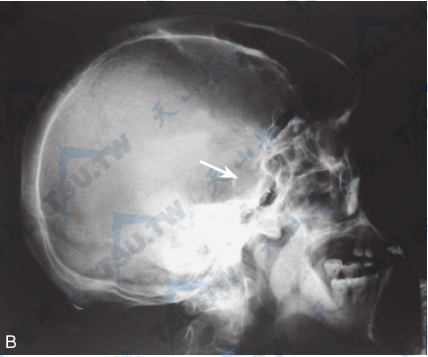
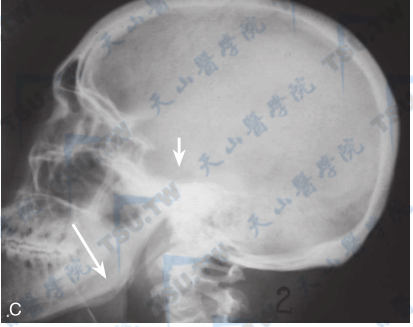
巨人症
注:A和B:男性,26岁,巨人症颅骨正侧位平片。颅骨内外板增厚,以板障增厚为著;鼻窦气化过度,鞍底有骨质吸收(↑),提示有垂体肿瘤存在。C:男,21岁,颅骨内外板增厚明显,板障基本消失,下颌骨升支伸长,下颌角变钝(长箭头),鞍底及后床突均有骨质吸收、破坏(短箭头),提示有垂体肿瘤存在
正常成人蝶鞍长7~16mm(平均7mm),深7~14mm(平均9.5mm)。多数肢端肥大症患者蝶鞍显著扩大,鞍底呈双重轮廓,肿瘤巨大时可破坏鞍背和鞍底。为了发现较小的垂体瘤,应尽早行垂体CT或MRI检查。垂体及鞍区病变的发现与定位MRI最可靠,CT次之,但后者对评价蝶鞍骨质情况、发现病变内或周边的钙化以帮助定性诊断较MRI为优,因此有时需两者配合才能得到较可靠的结论。CT和MRI对垂体瘤的诊断都较敏感,但MRI更具有优越性:①能显示垂体瘤的周围关系,如视交叉受压和海绵窦受压、移位;②组织分辨率高,能显示肿瘤内出血、坏死和囊性变。
胸腹部CT主要用于诊断或排除垂体外肿瘤。必要时可用111In或123I标记的奥曲肽扫描或PET协助诊断和观察疗效。
GH瘤分泌GH过多,刺激软骨(特别是骺板软骨)增生,使骨骼过度生长,但对骨的成熟无明显影响,所以骨骺融合延迟。另一方面,GH瘤可同时累及TSH及FSH/LH的正常分泌,致功能减退,是造成骨骺闭合延迟的原因之一。巨人症表现为全身骨骼呈对称性、均匀性增长、增粗,尤以肢体长、短管状骨明显,骨骺的出现及融合均延迟,骨龄落后于年龄。颅骨增大,颅板增厚,蝶鞍增大(亦可正常),骨骺的结构正常。肢端肥大症表现为蝶鞍增大或破坏。额窦明显增大,气化过度,严重者可直达颅顶,其余鼻窦亦相应增大,乳突气化广泛,1/3患者枕外粗隆异常突出或形成钩状骨突,眶上嵴及颧弓突出。下颌骨升支伸长、下颌角变钝、体部前突,咬合时下齿在上齿之前。椎体增大、椎体后缘呈贝壳样变形、胸椎体楔形变及脊柱后凸畸形。手部关节间隙增宽(关节软骨增生所致),在手的关节附近肌腱附着处可见骨赘形成(以掌骨远端明显),末节指骨远端呈丛状膨大,呈铲状。足部骨骼的改变与手部大致相同,唯有足的软组织增厚,跟垫平均25.6mm(正常值为17.8mm,X线测量大于23mm、B超测量大于21mm有临床意义)。肢端肥大症发生在骨骺融合之后,骨的纵向生长不明显,但可有不同程度的骨骼增粗。骨质结构正常或骨密度增高。
