血液凝固功能是哺乳动物维持循环系统完整性的一种重要防卫功能。止血功能是指机体对血管损伤的反应,使受损血管壁产生局部选择性凝血,而其他部位仍能维持循环通畅。止血反应所涉及的血管组成、血液和血浆蛋白间的相互作用,受一系列调节机制的严格调控。但是止血反应并不依赖血管损伤的性质。穿透性损伤或血管壁/血液的病理性改变都可触发并激起相同的过程。参与止血反应过程的细胞和分子反应、凝血因子的凝血活性与因此诱发的血块溶解活性之间的平衡将决定后果:出血、受控制的止血,抑或血栓形成。
止血反应的特征为一种酶促的凝血阶梯或瀑布反应,使多种血浆酶原蛋白转化成有活性的蛋白酶,在初期止血栓(血小板止血栓)形成的部位进一步形成纤维蛋白凝块。凝血阶梯反应能使最初的促凝反应迅速放大及增强,并大大超过触发事件所能预计的大小。止血反应最终的酶是α-凝血酶。通过有限蛋白溶解作用,α-凝血酶将稳定的纤维蛋白原转变成不溶性纤维蛋白多聚体。下表列举凝血蛋白的结构、生物特征以及在功能改变或缺陷时发生的临床疾病。多种凝血蛋白被相继发现,并经鉴定,确认为凝血因子。它们:①数量较多;②与人类疾病相关;③体外试验影响实验测定;④有特殊的结构特征。
凝血因子
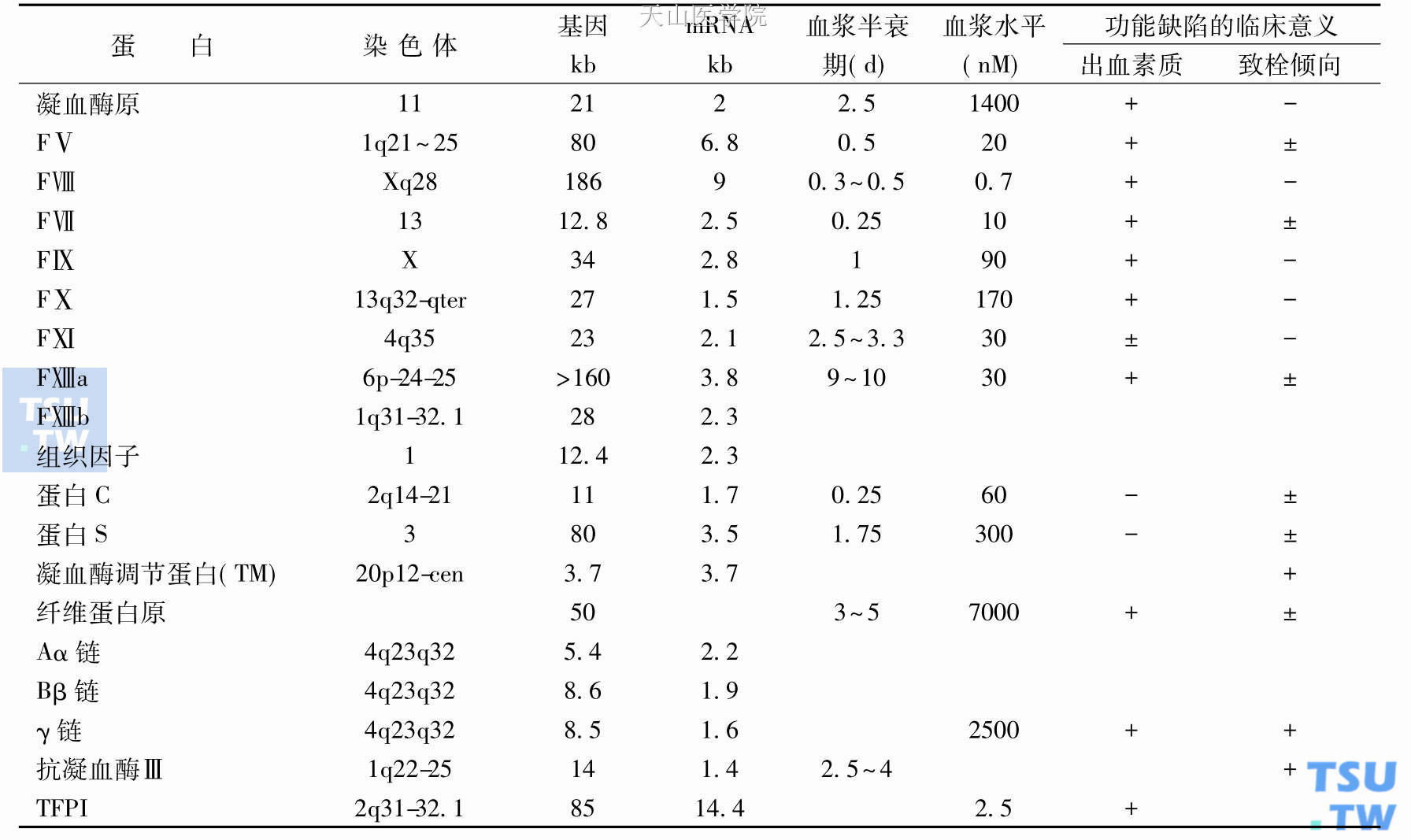
血浆含有至少16种促凝物,又称凝血因子。它们几乎全部是在肝脏合成的糖蛋白,只有少数是由单核细胞、内皮细胞和巨核细胞所制造。8种酶以不活化的酶原蛋白形式循环,6种辅因子结合并稳定其相应的酶。酶原蛋白和辅因子在凝血过程中被激活,产生局限性血栓。此外,至少有7种血浆糖蛋白是凝血过程的制控和调节者。
1958年,血液凝血因子命名标准化国际委员会按照血浆促凝物被发现或最初被描述的次序,采用罗马数字,分别给予官方正式命名。在凝血过程中,当一个促凝物,例如某个凝血酶原蛋白或辅因子被激活,在相关的罗马数字下角,即标以“a”(活化的FⅦ为FⅦa)。
习惯上,我们将FⅠ称为纤维蛋白原,FⅡ为凝血酶原。组织凝血活酶是一种未经提炼的组织蛋白和磷脂的混合物,被称为FⅢ。目前组织因子(tissue factor,TF)的精细结构已明确,因此,不再按罗马数字FⅢ予以命名。FⅣ等同于血浆阳性钙离子。目前,只采用它的化学标志Ca2+,废弃FⅣ的命名。原先曾将某个促凝物称为FⅥ,之后发现就是FⅤ,FⅥ遂即从命名系统中被撤销。前激肽释放酶又称激肽释放酶原(prekallikrin,Pre- k),也称Fletcher因子,以及高分子激肽原(high- molecular- weight kininogen,HMWK),也称Fitzgerald因子,两者都属于激肽释放酶和激肽系统,没有按罗马数字予以命名。血小板磷脂,特别是磷脂酰丝氨酸,虽然对止血过程很重要,但没有授予罗马数字命名,而被统称为血小板因子3(PF3)。
在体外的血浆凝固过程可以由内源或外源凝血系所启动(下图)。体外的α-凝血酶生成过程能译解为6个多组成的酶性复合物。所有与α-凝血酶生成有联系的酶都需要和表面相结合,以多组成催化复合物的方式来表达它们的活性。这种催化复合物通常由一个丝氨酸型蛋白溶解酶、一种以上的辅因子和一个表面(或膜)所组成,并且大多数复合物需要二价金属离子参与。因此,凝血过程中酶与表面结合的选择是由复合物中酶性蛋白结构上的精细差异所决定的。
根据Davie、Ratnoff和Mcfartand的观察,1964年提出相应的逻辑学推理假设。凝血过程很可能是一系列程序性蛋白分解的阶梯(或瀑布)反应,其中每一步反应为下一步提供必需的蛋白酶复合物。活化的凝血因子是蛋白溶解酶(丝氨酸蛋白酶),能将下一步的酶原型凝血因子水解(活化)。因此,凝血酶联反应的主旋律是有限的蛋白溶解。阶梯反应的基本效应是将由血管损伤所散发的细小活化信号迅速扩大,生成大量α-凝血酶,最终生成大量的纤维蛋白,以取代血小板血栓,使之更持久。
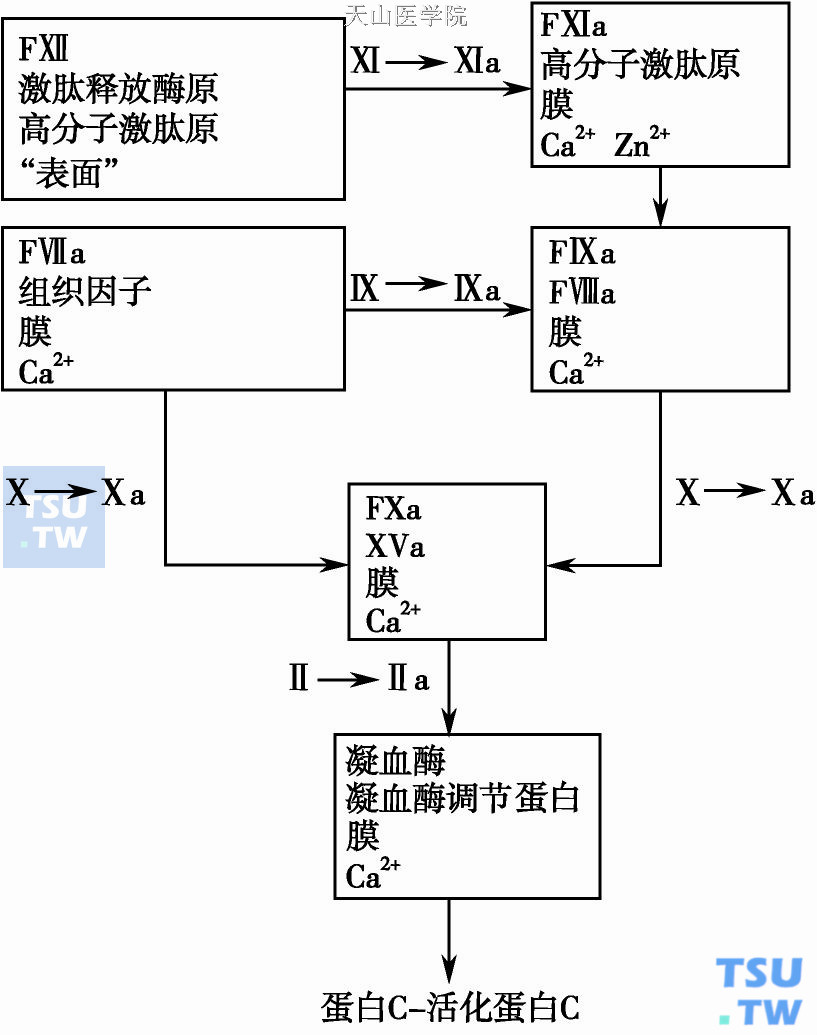
凝血瀑布反应中生成的多蛋白复合物
由一个丝氨酸蛋白酶,一个以上辅因子蛋白,二价阳离子和一个表面所组成的酶性复合物
早期观察体外启动凝血反应,认为有两种启动方式,其中一种为内源性凝血途径。血浆中加入Ca2+、酸性磷脂或阴性电荷的不溶性表面能触发凝固。在此过程中表达凝血酶活性和生成纤维蛋白凝块所参与的蛋白成分均源于血浆内。内源性凝血途径又称接触激活途径,因为首先需要由血浆内几种接触因子(FⅫ、激肽释放酶原、高分子激肽原)与外源性带阴电荷的表面如玻璃或高岭土相接触、相互反应,才能被激活。FⅫa裂解激肽释放酶原生成激肽释放酶,后者反过来活化FⅫ;FⅫa在高分子激肽原(辅因子)存在下使FⅪ转化成FⅪa;FⅪa在Ca2+存在下激活FⅨ成FⅨa;FⅨa与它的辅因子(FⅧa)在Ca2+和膜表面存在下使FⅩ转化成FⅩa。FⅩa与它的辅因子(FⅤa)相结合需要Ca2+和合适的膜表面才能促使FⅡ活化成FⅡa(α-凝血酶)。由此可见,促凝因子需要由坐落在特殊磷脂表面的辅因子来识别,以达到及时活化的作用。而酶-辅因子必须在细胞表面组装才能保证正常血液凝固的进程。
另一种凝血酶的生成途径称为外源性凝血途径。血浆中加入Ca2+及组织因子(一种富含磷脂的组织蛋白提取物),能产生三种酶性复合物:①FⅦ-TF-膜磷脂- Ca2+复合物(外源性Ⅹ酶)使FⅨ和FⅩ两者都活化而分别生成下列两种较之更高效的酶性复合物;②FⅨa-Ⅷa-磷脂复合物(内源性Ⅹ酶)提供一种重要的FⅩ激活剂;③FⅩa- FⅤa-膜磷脂复合物(凝血活酶又称凝血酶原酶),亦即凝血酶原活化的唯一已知的生理激活剂。
过去将凝血因子分为内源性或外源性凝血系因子并提出相应的测定方法,如部分凝血活酶时间(partial thromboplastin time,PTT)和凝血酶原时间(prothrombin time,PT),在诊断出血性疾病中有实际意义。这两种试验证实凝血因子阶梯反应活化的假设。但是体外呈现的凝血过程并不一定合理,因为上述假设不能正确描述生理止血:缺乏接触激活因子(激肽释放酶原、高分子激肽原、FⅫ)患者无自发性出血;FⅪ基因缺陷只在外伤或手术时出血。
近年来的资料支持生理性止血只由外源性凝血途径启动。血管损伤释出一种组织-磷脂复合物称组织因子(tissue factor,TF)。TF与FⅦa结合成TF-Ⅶa复合物而使FⅩ活化;另一方面,从外源途径生成内源性Ⅹ酶(FⅨa- FⅧa复合物)。后者似乎是多余的,但这一复合物对生理止血十分重要。缺乏X染色体性连锁蛋白FⅧ和FⅨ者临床表现出血素质,称血友病A和血友病B。FⅡ、FⅤ、FⅦ和FⅩ缺乏者与上述经典血友病有相似的出血表现。FⅪ在血液凝固、α-凝血酶生成过程中参与凝血正反馈扩增。TF的重要性在于使FⅦa活性能表达。维生素K依赖性蛋白酶复合物桥联内、外凝血途径,即外源凝血途径能通过两条通路(内外)产生FⅩa,经Osferud 和Rappaport(1997)首先证实。之后的研究报道FⅧa- FⅨa复合物不仅活化FⅩ且其功效大大超过FⅦa- TF对FⅩ的催化。故目前认为在有限组织损伤的止血事件中,主要通过FⅧa- FⅨa复合物催化FⅩ活化。
维生素K依赖性蛋白特征为其氨基末端含10个以上γ-羧基谷氨酸。凝血系中每一种依赖维生素K的酶性复合物在磷脂膜上的组装图解见下图。
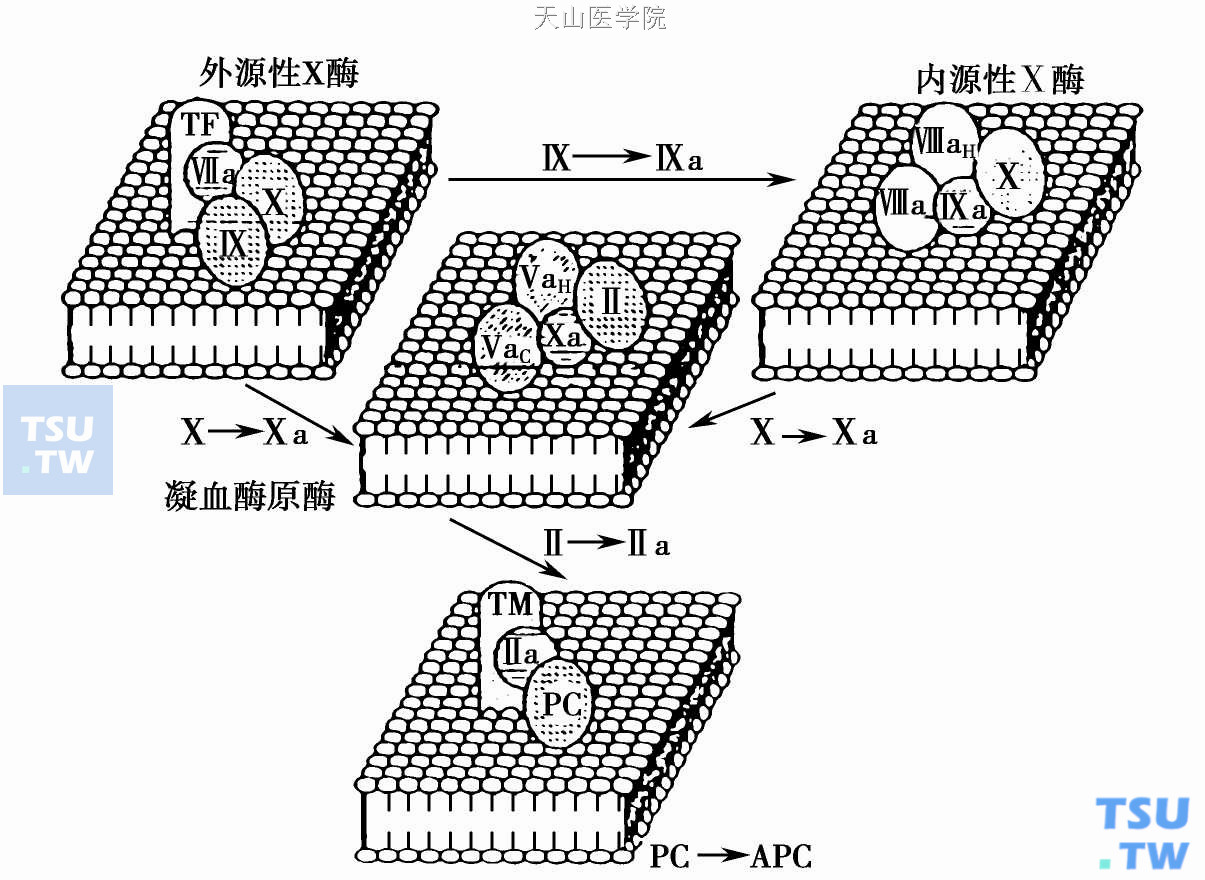
依赖维生素K的酶性复合物在磷脂膜上的组装
TF、FⅧa、FⅤ、TM(凝血酶调节蛋白)分别为辅因子;丝氨酸蛋白酶FⅦa、FⅨa、FⅩa、FⅡa在复合物中的底物分别为FⅨ、FⅩ、FⅡ和蛋白C(PC)。PC与内皮细胞膜上的凝血酶- TM(T- TM)复合物结合而活化。TM不仅为PC活化的辅因子,亦是凝血酶的膜受体,在PC活化过程中使凝血酶失去促凝活性。
凝血酶的生成是正常止血和血栓形成的中心环节,生成速度≤5分钟。凝血酶既能反馈性地自我加强,包括促使许多蛋白(FⅤ、FⅧ、FⅪ、FⅦ)活化而继续自我生成,从而触发血小板聚集、纤维蛋白原转化成不溶性纤维蛋白、FXⅢ活化及激活凝血酶活化的纤溶抑制物(thrombin activated fibrinolysis inhibitor,TAFI)而加强凝血;又能通过与内皮膜上TM结合而参与PC活化、负反馈调控性地阻止自我生成。这就是凝血酶生成后的两个通路。正常止血中凝血块只生成在血管受损的局部,是由于受损局部的细胞(血管壁基质细胞、血小板)控制凝血酶生成过程以及抗凝平衡。在受损区的周围环境中TM 和HSPG能使凝血酶转向激活PC、不再促成纤维蛋白的生成(见第119章第五节凝血的局限与调节)。凝血酶从强促凝活性转成APC的强抗凝活性过程中凝血酶失活、凝血酶的生成反应下调。ATⅢ能与凝血酶及凝血系其他蛋白酶以共价键结合而抑制凝血过程。TFPI是一种多价蛋白能同时与FⅩa和FⅦa结合而使二者灭活。活化蛋白C的抑制物(PCI)的作用是作为抗凝剂的抑制物而不是促凝剂的抑制物。
