成熟卵巢合成及分泌多种激素,包括雌激素、孕酮、雄激素及其前身物质。此外,卵巢还合成旁分泌/自分泌激素、激素样物质、细胞因子或生长因子等。
卵巢的类固醇性激素由胆固醇衍化而来,由甲、乙、丙三个6碳环和一个5碳环组成环戊烷多氢核激素(cyclopentanoperhydrophenanthrene)。含21个碳原子者为孕激素,基本结构为孕烷核;含19个碳原子者为雄激素,基本结构为雄烷核;含有18个碳原子者为雌激素,基本结构为雌烷(estrane)核。
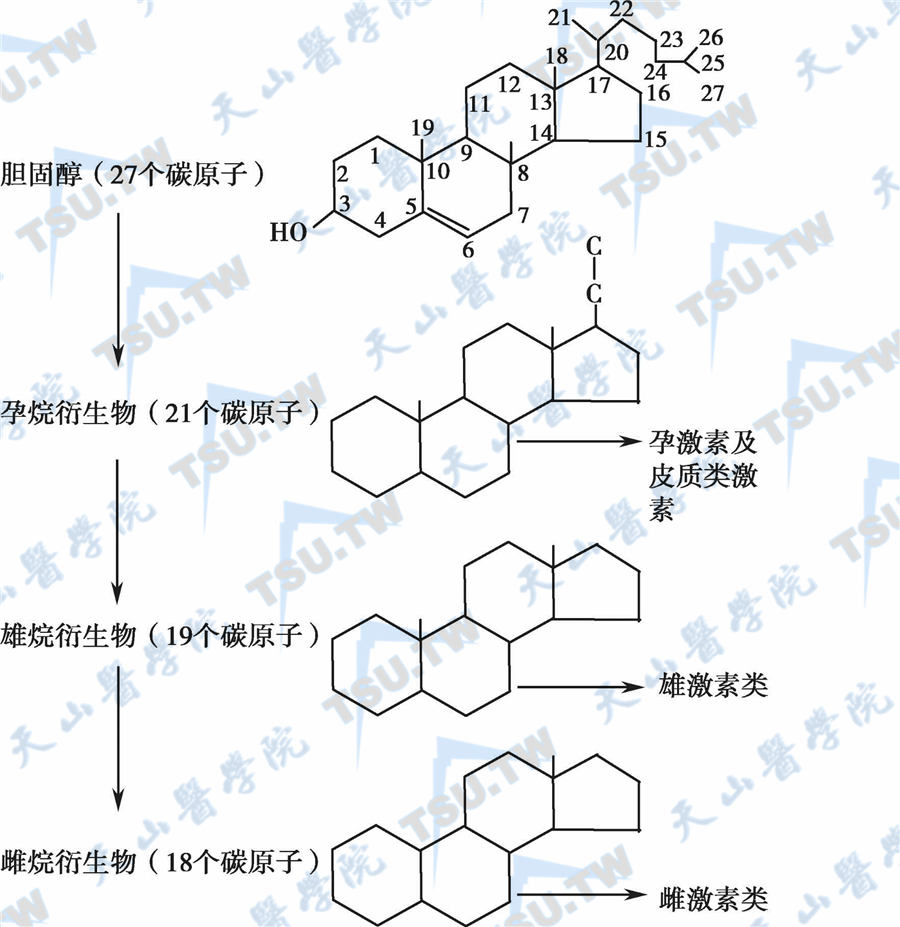
胆固醇和性激素的基本化学结构
合成类固醇激素的原料来源于胆固醇
合成类固醇性激素的来源有:①血浆脂蛋白中的胆固醇;②卵巢组织利用乙酸合成胆固醇;③贮存在脂滴中的胆固醇。卵巢的类固醇型激素主要是摄取血浆中LDL-胆固醇(LDL-C)合成的,高密度脂蛋白中的胆固醇也是合成类固醇激素的原料。
类固醇性激素的合成都从乙酸开始,先合成胆固醇,也可直接从血中摄取胆固醇作为原料,卵巢中的LH激活腺苷环化酶产生cAMP,cAMP诱导LDL受体mRNA合成,增加与LDL-C的结合和摄取。胆固醇经过20,22裂解酶的作用转化为孕烯醇酮(pregnenolone),它是所有类固醇性激素合成的前身物质,并是卵巢类固醇激素合成的限速步骤。孕酮是合成雄、雌激素的中间体。机体经两条途径合成卵巢类固醇性激素。卵泡期以Δ5途径为主,合成雄激素和雌激素;黄体期主要为Δ4途径(Δ5途径也有活动),主要产生孕激素。在卵巢中,大部分雄激素仅作为原料或前身物转化成雌激素,参见《肾上腺激素之:肾上腺皮质激素解读》及后续。
类固醇性激素合成需要多种酶催化
4种酶分别催化胆固醇转化为孕烯醇酮、孕烯醇酮转化为孕酮、孕烯醇酮转化为雄激素和雄激素转化为雌激素,见下图。LH调控胆固醇转化孕烯醇酮合成的第一步,FSH控制雄激素向雌激素的转化速率。
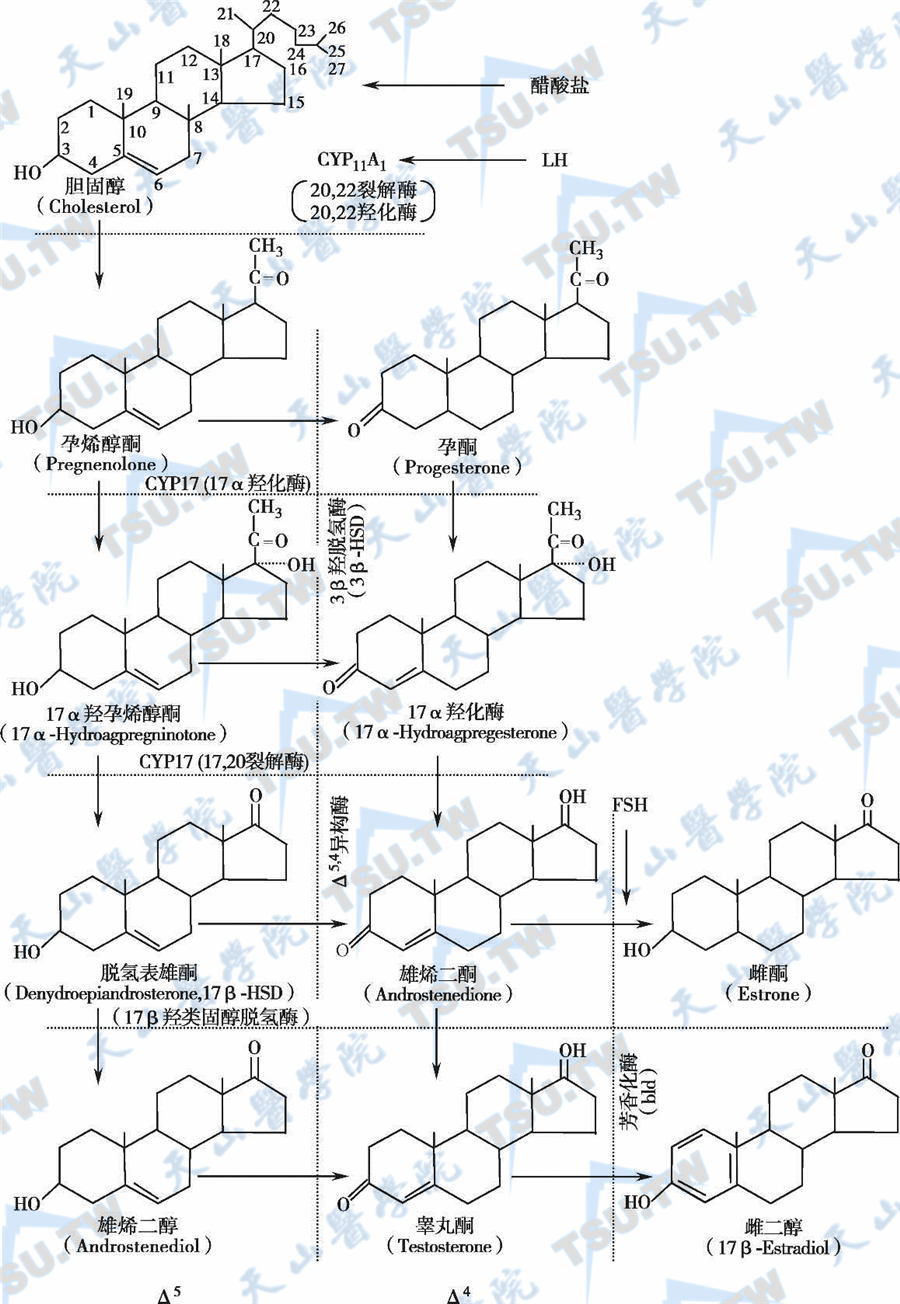
性腺类固醇类激素的生物合成
注:性激素生物合成经过两个途径,卵泡期以Δ5途径为主,黄体期Δ4和Δ5途径均有活动。→:代表激素合成的途径及FSH、LH作用的部位;……: 代表酶作用的部位。
在卵巢内,合成类固醇性激素的细胞主要有颗粒细胞、卵泡膜细胞和黄体细胞。卵泡在发育过程中,易受其他体外和体内因素的干扰,出现发育不良、发育静止或发育异常。例如,接受放射辐射后,卵泡(ovarian follicles)和粒层细胞(granulosa cell)凋亡加速(以粒层细胞的凋亡更突出)。在卵泡发育中,卵细胞比未成熟卵泡更敏感,而始基卵泡和初级卵泡受到的损害最明显。在生长的卵泡和黄体中均有CYP11A1、3β-HSD、CYP17、CYP19和17β-HSD1(其主要作用是使雌酮转化为E2)等酶的表达,成熟卵泡和囊状卵泡的粒层细胞、泡膜细胞、黄体化粒层细胞和黄体化泡膜细胞均有CYP11A1和3β-HSD酶系,而CYP17存在于卵泡的泡膜细胞和黄体化的泡膜细胞中。芳香化酶(aromatase,CYP19)位于粒层细胞及黄体化颗粒细胞中,FSH诱导CYP19及CYP19mRNA的表达,因此,人们提出了两种细胞-两种促性腺激素学说。
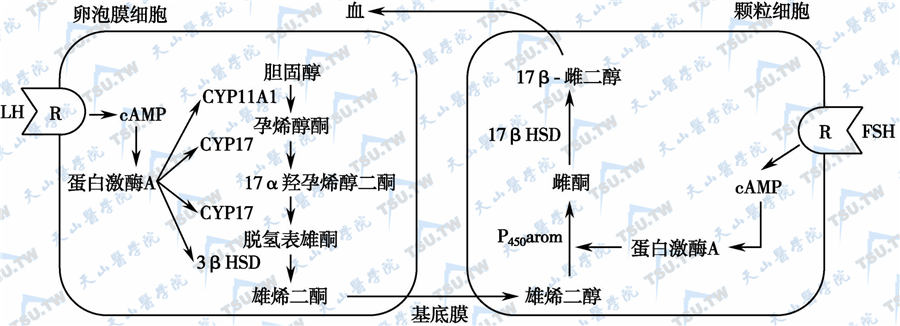
雌激素合成的“两种细胞-两种促性腺激素”学说
注:卵泡和黄体表达CYP11A1、3β-HSD、CYP17、CYP19和17β-HSD1等酶系,而CYP17存在于卵泡的泡膜细胞和黄体化的泡膜细胞中。芳香化酶(CYP19)位于粒层细胞及黄体化颗粒细胞中,FSH诱导CYP19及CYP19表达。
雌二醇/雌酮/雌三醇的雌激素活性依次降低
雌二醇(E2)和雌酮(E1)主要由睾酮衍化而来,后者多由雄烯二酮转化形成,此两种雌激素也可以互相转换。妊娠后胎盘可生产大量雌三醇(E3)。雌激素主要是由卵巢的卵泡膜细胞与颗粒细胞在FSH和LH的共同作用下合成的,卵泡膜细胞上有LH受体,当LH和LH受体结合后可使细胞内胆固醇形成睾酮与雄烯二酮。它们又可透过细胞膜进入颗粒细胞内而成为合成雌激素的前身物。颗粒细胞上有FSH受体,当FSH和FSH受体结合后,激活颗粒细胞中的芳香化酶活性,将睾酮和雄烯二酮分别转化成雌二醇和雌酮,进入血液循环与卵泡液中,此即所谓两种细胞与两种次性腺激素合成雌激素的学说。小部分E2和雌酮是从肾上腺皮质分泌的雄烯二酮衍变而来;每天所产生的20%~30%雌酮是从周围循环中的雄烯二酮(约1%)衍变来的。另有少部分E2和雌酮是由肾上腺皮质分泌的睾酮衍化而来。
在血浆中,绝大部分雌激素与特异性β球蛋白(性激素结合球蛋白,sex hormone-binding globulin,SHBG)及白蛋白结合转运。约有2%的E2是游离的,60%结合于白蛋白,38%与SHBG结合。SHBG浓度的变化影响性激素的代谢及靶组织的作用。由于雌激素、甲状腺激素刺激而雄激素抑制SHBG的合成,所以女性血浆SHBG比男性约高1倍。在妊娠和甲亢时,SHBG增高;相反,甲减和肥胖者降低。
卵泡膜细胞合成雄烯二酮和睾酮而芳香化酶将其转化为雌激素
大部分雄激素透过卵泡的基膜而进入卵泡内的粒层细胞。粒层细胞中的芳香化酶将雄激素转化为雌激素。卵巢组织的各种细胞分泌哪种激素取决于促性腺激素及促性腺激素受体水平、类固醇合酶的表达以及LDL-C的可利用度。
由于支配卵泡粒层细胞的血管不能直接利用血液中的LDL-C,且其卵泡液的LDL-C极低,因而卵泡粒层细胞有限制孕酮产生的能力。排卵后,大量新生血管侵入细胞层,为黄体粒层细胞提供大量胆固醇,因而孕酮的合成明显增加。在β-脂蛋白缺乏症妇女中,因LDL-C低,故在黄体期的孕酮分泌量降低。许多无排卵妇女的血清LH升高,表现为LH/ FSH比值升高,升高的LH导致睾酮和雄烯二酮生成增多,然而相对较低的FSH使雄激素转化为雌激素减少,不排卵可导致睾酮和雄烯二酮增高,表现为多囊卵巢、功能性子宫出血或不孕。
卵泡/黄体/间质细胞合成睾酮/雄烯二酮/脱氢异雄酮
在绝经前,卵巢分泌的睾酮占总量的25%;肾上腺皮质分泌者占25%,由雄烯二酮的外周转化占50%。循环中97%~99%的雄激素以结合形式存在,主要与SHBG结合,少量(<2%)呈游离状态,其代谢清除率受SHBG结合力的影响。与SHBG结合的雄激素不参加外周组织代谢转化。
雄烯二酮(androstenedione)的合成和分泌主要在卵巢和肾上腺皮质,且两者产生的量相近,另有10%在外周产生。在末梢组织转变为睾酮,睾酮及雄烯二酮均具有生物活性,但雄烯二酮的生物活性只有睾酮的20%。仅6%的雄烯二酮与SHBG结合,大部分与白蛋白结合,临床上常测定睾酮,很少需要测定雄烯二酮。雄烯二酮呈昼夜节律变化并与皮质醇相平行,当皮质醇升高时,雄烯二酮也同时上升(约50%)。另外,排卵期血中雄烯二酮上升。近年发现,11β-羟雄烯二酮(hydroxyandrostenedione)仅来源于肾上腺,可作为雄激素肾上腺来源的可靠指标。
70%~90%脱氢异雄酮(dehydroepiandrosterone,DHEA)由肾上腺皮质产生,10%~30%来自卵巢,亦有明显的昼夜节律变化,而硫酸去氢异雄酮(dehydroepiandrosterone sulfate,DHEAS)几乎全部来源于肾上腺。因此,DHEAS是肾上腺皮质雄激素合成功能的重要标志物。脑组织也合成少量的DHEA和DHEAS,并主要在局部起调节作用,可能具有神经保护(neuroprotection)、促进神经突生长(neurite growth)和抗氧化作用。青春期发育开始后,DHEAS显著上升。DHEAS>1.1μmol/L时,表明肾上腺皮质功能初现;血清DHEAS的平均浓度在25岁时达到高峰值,以后随年龄递增呈进行性下降,到70岁降至峰值的20%以下。各种性激素的生成率、血浆水平及代谢清除率见下表。
血浆卵巢激素的浓度、代谢清除率、生成率及卵巢的分泌率
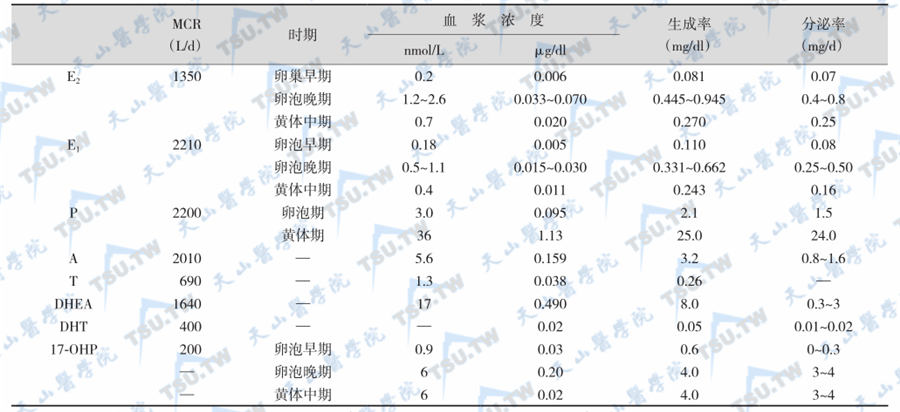
注:E2:雌二醇;E1:雌酮;P:孕酮;A:雄烯二酮;T:睾酮;DHEA:脱氢异雄酮;DHT:双氢睾酮;17α-OHP:17α-羟孕酮;MCR:代谢清除率(metabolic clearance rate)
