维生素D(Vitamin D)又名钙化醇,主要包括维生素D2 (ergocalciferol)及维生素D3(cholecalciferol)。维生素D2又称麦角钙化醇,是由酵母菌或麦角中的麦角固醇(ergosterol)经紫外光辐照后的产物。照射麦角固醇的方法是多年来人工合成维生素D2的主要方式。维生素D3又称胆钙化醇,可由存在于大多数高等动物的表皮或皮肤组织的7-脱氢胆固醇在阳光或紫外光照射下,经光化学反应转化而成。因此,麦角固醇和7-脱氢胆固醇又被称为维生素D原(provitamin D)。维生素D原结构上的先决条件是其类固醇的B环中5~7位为双键,这个特定分子的共轭双键能吸收紫外光区270~300nm波长的光量子。大多数地域的自然阳光可提供这种波长的紫外线,光照启动了一系列复杂的转化过程而最终形成维生素D。只要动物或一般成年人经常接受日照,维生素D就能内源生成而无需由膳食供给。维生素D原、维生素D及其衍生物的分子结构及主要转化途径见下图。图中所列的碳原子数目序列为理论化学与应用化学国际联盟于1960年制订的。
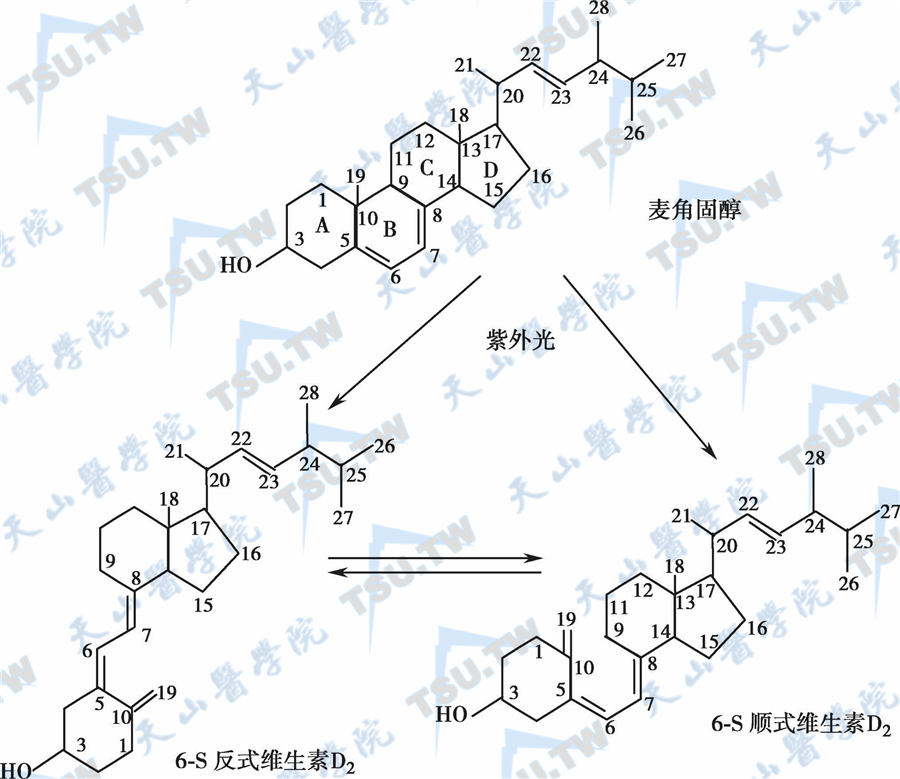
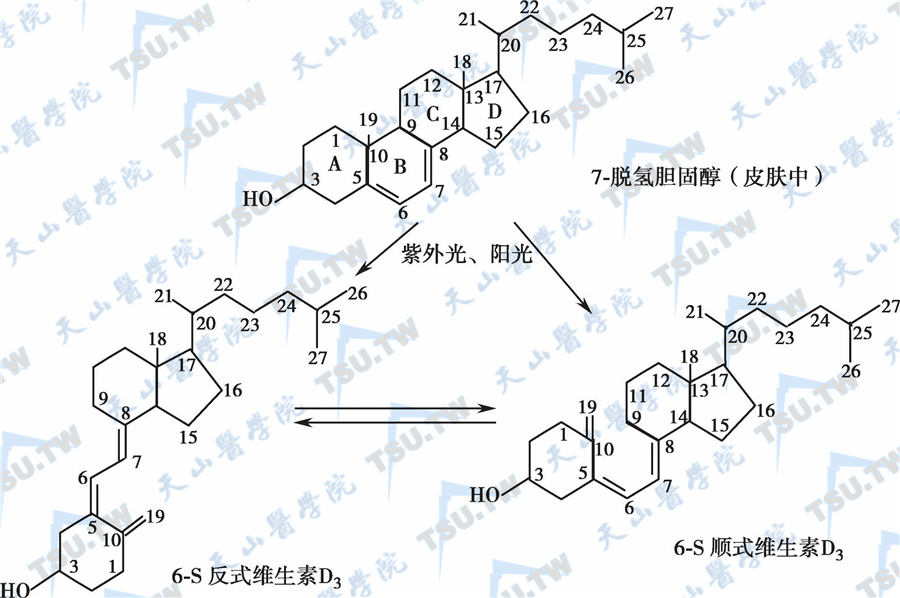
维生素D原、维生素D及其衍生物的分子结构及主要转化途径
维生素D为白色晶体,溶于脂肪、脂溶剂及有机溶媒中,在中性及碱性媒质中能耐高温和氧化,在130℃下加热90分钟,其生理活性仍能保存。光与酸促进其异构化,脂肪酸酸败可引起维生素D破坏,在维生素D油溶液中加入抗氧化剂后,能强化其化学稳定性。过量辐射照射可形成少量具有毒性的化合物。水溶液由于有溶解氧存在而使维生素D不稳定,双键还原也使其生物效用降低。因此,维生素D一般应储存于无光、无酸或氮气低温环境中。
以前用国际单位(IU)表达维生素D的量,现多用μg表示;两者的换算关系为:1.0U 维生素D=0.025μg纯维生素D;1.0U 维生素D=65.0pmol 维生素D。
人类从食物与皮肤转换获得维生素D原
人类皮肤维生素D形成与吸收
人体表皮及皮肤组织内的7-脱氢胆固醇经阳光或紫外线照射时,发生光化学反应,大约经3天时间可转化成维生素D。高强度紫外线照射15分钟后,每克皮肤可形成12.8U(0.32μg)维生素D。所形成的维生素D与血浆中维生素D结合蛋白(DBP)结合,从皮肤输送至肝脏为机体所利用。DBP在电泳中处于α-球蛋白带内,尚有部分维生素D由β-脂蛋白携带。光照不会引起维生素D中毒,因为7-脱氢胆固醇在紫外线的作用下先形成维生素D原(前维生素D,previtamin D),然后在体温作用下维生素D原逐渐转变为维生素D。血浆的维生素D结合蛋白与维生素D原结合的能力只相当于与维生素D结合能力的千分之一。在24小时内约只有50%的维生素D原转变为维生素D,因此不会有大量的维生素D被转运至肝脏形成25-(OH)D。而且25-(OH)D在肾脏进一步转变为1,25-(OH)2D又受到PTH分泌量的调节。以上的机制使日晒不可能成为维生素D中毒的原因。
在人类的进化过程中,皮肤颜色随着环境的变化,不断出现适应性改变。阳光的紫外线的强弱是改变肤色的最关键因素,以适应性方式预防了汗腺破坏、阳光损伤、皮肤癌、维生素D缺乏以及微生物感染等。移居至高紫外线的地区后,肤色加深,而移居至低紫外线的地区后,肤色变浅。此外,气温和实物也是肤色的决定因素,机体与环境的热交换(heat exchange)取决于外部环境的温度;长期摄入富含维生素D食物的居民即使居住在高纬度地区,其肤色亦可保持得较深,如因纽特人(Inuits)。此外,汗腺、皮肤血管也对肤色有一定影响。
由于玻璃也能吸收大部分日光中的紫外线,故室内工作者血维生素D和25-(OH)D低于室外工作者。不能经常在室外活动的儿童其佝偻病的患病率要比经常在室外活动的儿童高7~8倍。热带和亚热带阳光充足,佝偻病的发生较温带和寒带少。地理位置与日照量关系密切。东北地区幼儿佝偻病的发病率明显高于华北和西北地区。长江流域佝偻病发病率高于华南。哈尔滨寒冷且日照较少,2~4月份由于寒冷,儿童到室外活动少,佝偻病活动期在幼童高达43.5%,随着天气暖和情况好转,9~10月最轻,11月以后又渐加重。
老年人户外活动较少且日照机会少,日照时皮肤合成活性维生素D的能力也较低,故老人易有维生素D缺乏。脑瘫患者由于四肢瘫痪,日照甚少,其长骨骨折发生率高,以上肢骨折常见。这与日照少及用抗癫痫药有关。用维生素D 5000U/d,3个月治疗使临床情况显著好转。在此治疗期间血清钙与磷的平均值升高,ALP下降,因此认为维生素D不足是主要原因。若日照不足,维生素D应予补充。
消化道内维生素D吸收
食物中的维生素D与脂肪一起吸收,吸收部位主要在空肠与回肠。因维生素D与油脂并存,故胆汁的存在是其达到吸收最佳状态所必需的。当脂肪吸收受到干扰(如慢性胰腺炎、脂肪痢及囊性纤维化等疾病)时,均影响维生素D的吸收,肠道吸收的维生素D主要与乳糜微粒相结合,由淋巴系统运输,但也可与DBP结合,或与β-脂蛋白结合在血浆中转运至肝脏。口服维生素D与乳糜微粒的结合比从皮肤中转化而来的维生素D与DBP相结合者易于分解。
进入体内的维生素D2和维生素D3在体内分别进行代谢,两者的活性基本相同,但两者之间不发生转换,即维生素D2不会转换成维生素D,同样,维生素D3也不会转换成维生素D2。
活性维生素D为内分泌激素
维生素D3实际上是一种激素原,其本身无生物活性。只有首先在肝脏代谢成25-(OH)D,然后在肾脏转化为1,25-(OH)2D 及24,25-(OH)2D才生成具有生物活性的分子,目前已可分离出37种维生素D的代谢产物,并且基本上弄清了其化学特性。近期的研究表明,维生素D活化的最后一个步骤,即在肾近曲小管将25-羟维生素D转化为1,25-维生素D的过程涉及1α-羟化酶前体的细胞内摄取和转运。这种新机制可能解释维生素D在调控细胞增殖和分化的自分泌/旁分泌作用,因为1α-羟化酶在多种靶细胞中的广泛表达,而局部维生素D的产生可能与循环中的1α-羟化酶前体水平有关。
维生素D的结构及作用方式与经典的类固醇激素(如醛固酮、雌激素、皮质醇等)相类似。目前已公认维生素D为内分泌激素:
- 在皮肤中,7-脱氢胆固醇经光化学作用转化成维生素D或由膳食摄入维生素D。
- 维生素D在肝脏中被代谢成25-(OH)D。后者为血液循环中维生素D的主要形式。
- 肾脏将25-(OH)D转变为1,25-(OH)2D和24,25-(OH)2D两种主要的二羟代谢物。
- 通过系统转运将上述两种代谢物送至远端靶器官。
- 两种二羟代谢物,尤其是1,25-(OH)2D与靶器官的核受体或膜受体结合,发挥相应的生物学效应。DBP是携带维生素D及所有维生素D代谢产物到达各种靶器官的转运蛋白。
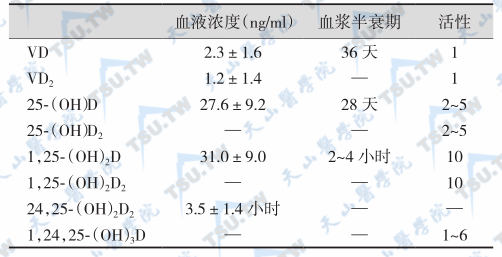
皮肤中合成及膳食中摄取的维生素D被转运至肝脏中,在肝细胞的内质网上经维生素D-25-羟化酶作用,将其第25碳处羟基化而形成25-(OH)D。维生素D-25-羟化酶是一种由细胞色素P450专一催化的混合功能氧化酶,这一酶系统的作用尚依靠NADPH的递氢过程以及Mg2+和分子氧的参与,肝外的其他组织也可摄取维生素D及25-(OH)D。维生素D主要贮存在脂肪组织与骨骼肌中,其次为肝脏,大脑、肺、脾、骨和皮肤亦有少量存在,因此维生素D及25-(OH)D在组织中的含量及其总量均高于血浆。总的来说,人体维生素D的储存量比VA要少。当机体靶组织需要时,贮存的维生素D及25-(OH)D可被释放出来,其中25-(OH)D为血液循环中维生素D的主要形式,正常人血中25-(OH)D的浓度为(69±23)nmol/L[(27.6±9.2)ng/ml],若小于10nmol/L(4ng/ml),临床上易出现佝偻病及骨质软化症。脂肪中25-(OH)D的释放速度最慢,当体重减轻,脂肪减少时,维生素D亦可释放出来。
血浆中的25-(OH)D可与一种专一的α-球蛋白(维生素D运输蛋白)结合并运载至肾脏,在肾细胞线粒体中25-(OH)D-1羟化酶和25-(OH)D-24羟化酶的作用下,可将第1碳或第24碳上第二次羟基化而形成1,25-(OH)2D或24R,25-(OH)2D。这两种具二羟基的维生素D是维生素D主要的代谢产物,尤其1,25-(OH)2D是维生素D在机体中最主要的生物活性形式。肾脏近曲小管的线粒体中还存在25-(OH)2D-24-1羟化酶,可将24,25-(OH)2D第3次羟化为1,24,25-(OH)3D。这种3羟基维生素D的生物作用有与1,25-(OH)2D类似之处,但活性仅为后者的60%,甚至更低。肾近曲小管线粒体中的25-(OH)D-1-羟化酶与25-(OH)D-24-1-羟化酶同肝脏中的维生素D-25-羟化酶一样均为由细胞色素P450专一催化的混合功能单氧化酶,且上述两种1α-羟化酶为肾脏中的关键酶。肾中1α-羟化酶与24位羟化酶是相互抑制的,其活性为血钙所控制,正常血钙(9.5mg%)时,两类酶均有活性;而当血清钙下降时,刺激1α-羟化酶活性升高,使1α-羟基化过程增强,而致24位羟基化产物减少。机体正是通过严格控制肾、肝1α-羟化酶的活性来调控维生素D的代谢与活性。
维生素D的分解代谢场所主要在肝脏内,1,25-(OH)2D与24,25-(OH)2D的分解代谢途径相类似,先转化为极性较强的代谢产物并结合形成葡萄糖苷酸形式后随胆汁排入肠道。口服维生素D比从皮肤中形成的维生素D易于分解。25-(OH)D以及1,25-(OH)2D也可以葡萄糖苷酸形式经胆汁形成肠肝循环或从粪便中排出。口服生理剂量48小时后,30%从粪便中排出,仅2%~4%从尿中排出。维生素D及主要代谢产物的生物学特性见下表。
维生素D及代谢产物的生物学特性
维生素D代谢受PTH/钙/无机磷/FGF23调节
由于维生素D的结构及活性型维生素D的作用方式与经典的类固醇激素相类似,并且活性型维生素D——1,25-(OH)2D可在体内合成,故1,25-(OH)2D实质上是一种类固醇激素。它的生物合成与代谢过程均受到其作用底物及其他内分泌因素的调控和影响。维生素D的代谢及主要调节作用见下图。
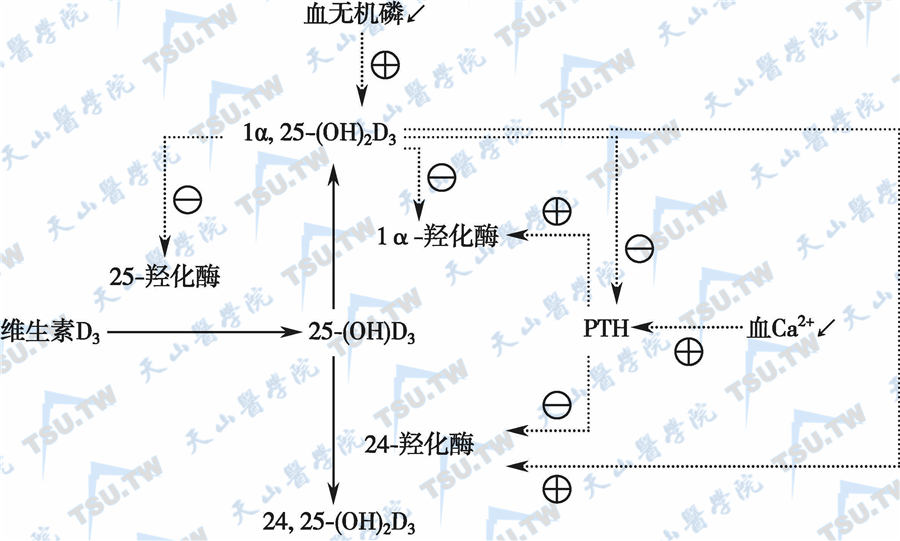
维生素D的代谢及主要调节作用
注:图中实线箭头表示代谢途径;虚线箭头表示调节作用; 表示激活或促进作用;
表示激活或促进作用; 表示抑制作用
表示抑制作用
甲状旁腺素与维生素D相互调节
PTH是肾内合成1,25-(OH)2D的主要调节者,PTH分泌增加可使肾内1α-羟化酶的活性增加,从而促进肾脏合成1,25-(OH)2D,反之亦然。体内及体外试验均已证明,给予PTH后可使血浆中1,25-(OH)2D升高。但生理状态下,PTH对动物的1,25-(OH)2D水平起精细调节作用,即使服用维生素D制剂后,人和动物血中1,25-(OH)2D的水平波动范围也很小。PTH还可抑制肾内24,25-(OH)2D的合成。此外,1,25-(OH)2D还可通过血清钙离子对PTH的分泌起反馈调控作用。当1,25-(OH)2D升高时,可通过促进肠黏膜对钙的吸收增加而升高血清钙,血清钙离子增加可抑制PTH分泌,从而抑制肾脏中1,25-(OH)2D的合成。PTH正是通过其对1α-羟化酶的作用和与活性维生素D的相互调节作用来完成其对1,25-(OH)2D水平的精细调节作用的。
钙与无机磷对维生素D的影响
膳食钙增加可抑制1,25-(OH)2D的合成而抑制24,25-(OH)2D的生成。如前所述,人或动物体内1,25-(OH)2D的合成与其血浆内钙浓度相关。体内试验表明,低钙血症时1α-羟化酶活性升高。而在体外肾细胞培养试验中发现,高钙水平使24-羟化酶活性升高。由于PTH对血清钙浓度起监控作用,血清Ca2+浓度是调节PTH分泌的主要信号,血清钙离子水平下降可刺激PTH分泌,因此认为低钙血症对1,25-(OH)2D的合成起信息传递作用,即血清钙浓度对1,25-(OH)2D合成的影响是通过调节PTH的分泌而间接起作用的。
低磷血症时亦可刺激1,25-(OH)2D的合成量增加,但只有在去除甲状旁腺后或其他无PTH分泌的条件下,血清无机磷浓度才与1,25-(OH)2D的合成量相关。事实上,低磷膳食引起的低磷血症均可导致甲状旁腺细胞中PTH的mRNA下降,而使PTH的分泌减少。与低钙血症刺激PTH分泌增加不同,血磷水平对1,25-(OH)2D合成的影响可能是因其自身作用或其他途径而并非通过调节PTH分泌起作用的。
FGF23
Klotho与FGF23组成钙磷代谢的调节轴,维持血磷正常,并与PTH和维生素D一道调节钠/磷同转运体(sodium-phosphate cotransporters)的功能。因此,Klotho是保持FGF23的作用和可用性的重要因子。在高血磷和1,25-(OH)2D升高情况下,骨细胞和成骨细胞分泌的FGF23增多。FGF23基因突变、GALNT3基因突变(影响FGF23翻译后修饰)或Klotho(FGF受体1转换为FGF23受体的辅助因子)突变引起低磷血症和肿瘤样钙盐沉着症(tumoral calcinosis)。
1,25-(OH)2D自身调节
维生素D的活性形式1,25-(OH)2D作为第1碳处第2次羟基化反应的终产物,对其本身的合成起反馈抑制作用:①尤其对于动物而言,其维生素D的营养状态可能是1-羟化酶活性最重要的决定因素,因此,维生素D及1,25-(OH)2D对肾脏内1,25-(OH)2D合成的作用是调节维生素D代谢的主要部位。早年的体内试验即表明:当血液循环中1,25-(OH)2D的浓度降低时或在维生素D缺乏的动物模型中,肾脏内1,25-(OH)2D合成增加直至达到合成的最大速率;反之,其血浆浓度升高或给予1,25-(OH)2D制剂后即可抑制1α-羟化酶,肾脏中1,25-(OH)2D合成量迅速减少。②1,25-(OH)2D能抑制肝内的维生素D-25-羟化酶。服用维生素D制剂可引起血清25-(OH)D升高,但给以小剂量1,25-(OH)2D后可完全抑制,而25-(OH)D本身对维生素D-25-羟化酶的反馈抑制作用较弱。由于成人肝脏中没有1,25-(OH)2D核受体,因此,1,25-(OH)2D抑制D-25-羟化酶的机制至今不明。③维生素D 和1,25-(OH)2D还可以激活维生素D-24-羟化酶,使25-(OH)D转化为24,25-(OH)2D而减少第1碳位羟化。由于24,25-(OH)2D的生物活性很低,因此实质上是减少了活性维生素D 合成。体内及体外试验均表明,当维生素D缺乏时,24,25-(OH)2D的合成显著减少。
影响维生素D代谢的其他因素
降钙素是由甲状腺C细胞和甲状腺旁腺分泌的一种多肽,其分泌亦受血清Ca2+调节,血清Ca2+水平升高可促进其分泌,降钙素可抑制1α-羟化酶,减少肾脏中1,25-(OH)2D的合成,降钙素可对抗PTH的作用,但前者的作用较弱,作用时间亦短,对维生素D代谢的调节作用可因继发引起PTH的分泌而抵消。
性激素对维生素D的代谢亦起调节作用。给成熟的鸟类注射雌二醇后,6小时内即出现1α-羟化酶被激活而24-羟化酶活性受抑制。这种作用在睾酮和(或)黄体酮同时存在时才起作用并表现出对雌激素的专一性。人群研究中亦发现,使用口服避孕药的育龄妇女其血浆25-(OH)D的水平比对照组高约40%,停止使用口服避孕药后则25-(OH)D显著下降。妊娠期1,25-(OH)2D血浆浓度上升。哺乳期继续上升,至断乳后母体才逐渐恢复至正常水平。24,25-(OH)2D水平波动则恰与其相反,说明孕激素及泌乳素均可促进1,25-(OH)2D的合成。
肾外组织生成1,25-(OH)2D
肾外的1α-羟化酶活性升高亦可导致高钙血症(骨化三醇所致的高钙血症,calcitriol-mediated hypercalcemia)。Kallas等报道1例播散性肉芽肿病(disseminated granulomatous disease)患者表现为显著的乏力和体重下降。因为血清25(OH)D水平降低和血钙处于正常低值而诊断为维生素D缺乏性肌病(vitamin D deficiency myopathy)。每天给予维生素D 治疗1个月后,血清钙升高,尿钙增多,血清25(OH)D水平恢复正常,1,25-(OH)2D水平为正常高值,PTH降低,甲状旁腺激素相关蛋白(PTHrP)测不出,且肾功能正常。使用二磷酸盐与糖皮质激素2周后,虽然血钙恢复正常,但因急性心力衰竭死亡。尸体解剖诊断为播散性巨细胞性肌炎(disseminated giant cell myositis,骨骼肌、心肌和胃肠平滑肌),免疫组化证实上述的炎性肌肉均表达1α-羟化酶。据文献报道,骨化三醇所致的高钙血症可发生于30多种临床病变(如炎症、异物、肿瘤),多数属于肉芽肿病性质。本例说明,维生素D缺乏可以掩盖高活性的1α-羟化酶作用,而在补充维生素D后,即出现高钙血症。
血25-(OH)D反映维生素D营养状况
由肝脏产生的25羟化酶将维生素D转化为25(OH)D,而肝脏的储备功能大,25羟化酶几乎不受肝功能状况的影响。25(OH)D是血清维生素D代谢产物中含量最多而且最稳定的一种,其血清浓度可代表机体维生素D的营养状况。然后由肾脏产生的1α羟化酶将25(OH)D转化为1,25(OH)2D,而阿法骨化醇不通过肾脏代谢,只需在肝脏中25-羟化后就能活化为1,25(OH)2D。
多种因素影响维生素D的合成,这些因素包括光照、年龄、性别、种族、肤色、服装、文化习俗、膳食营养和生活条件等。例如,北纬35°以上冬季的太阳光入射角太小,大多数紫外线被臭氧层吸收,皮肤合成维生素D的功能明显降低。又如,深色皮肤或使用防晒霜者的维生素D合成较少。
25-(OH)D是体内维生素D的主要储存形式,而1,25-(OH)2D是体内维生素D的主要活性形式。1997年,美国食品与营养委员会决定以血清25-(OH)D 作为评价维生素D的应用标准,其理由是血清25-(OH)D反映了食物维生素D的摄入量和阳光照射量,同时也反映了肝脏对维生素D的处理能力。血清1,25-(OH)2D水平不能反映维生素D的营养状况,这是因为:①尽管人体缺乏维生素D,但血清1,25-(OH)2D可能完全正常;②维生素D缺乏患者的血清1,25-(OH)2D即使降低,也是由于肾脏功能障碍和1α-羟化酶活性降低所致而非维生素D缺乏的结果,而肝功能对维生素D的25 -羟化无明确影响。另一方面,即使在维生素D中毒的患者中,血清1,25-(OH)2D水平可能仍然是正常或降低的。虽然已经有大量的流行病学调查报道,一般认为,维生素D缺乏/不足是一个全球性的健康问题,但目前仍未就血清25-(OH)D的正常范围达成共识。25(OH)D的检测方法有竞争性蛋白结合分析法(CPBA)、放射免疫法(RIA)、酶标法(EIA,ELISA)、化学发光法(RAAA)、高效液相色谱法(HPLC)、液相色谱-质谱法(LC-MS),但这些方法的准确性尚存在争议。
维生素D具有多种生理作用
维生素D促进小肠黏膜上皮对钙、磷的吸收。 促进肾近曲小管对钙、磷的重吸收。维生素D对骨有两种作用:骨是人体的钙库,当血钙降低时,1,25(OH)2D与甲状旁腺激素(PTH)协同作用,通过破骨细胞作用,使骨盐溶解,维持血浆钙、磷的正常浓度。1,25(OH)2D可促进骺板软骨和类骨组织钙化,维持钙、磷在血浆中的饱和状态,有利于骨盐的沉积。因此,如果维生素D缺乏,处于快速生长期的骨骼受的影响最明显。
但是,应用大剂量活性维生素D冲击治疗肾衰竭或MDS时,其药理作用主要表现为骨吸收增强。
维生素D是维持骨骼肌功能的重要激素,维生素D与维生素DR结合后,诱导肌细胞合成多种蛋白质,执行骨骼肌的功能,老年人容易跌倒与维生素D不足有关。此外,维生素D具有诱导细胞分化,抑制细胞增殖,拮抗胶原合成,调节癌基因表达及免疫调节等功能。因此,维生素D可预防感染、自身免疫性疾病(多发性硬化、类风湿关节炎、系统性红斑狼疮等)及某些肿瘤和2型糖尿病。婴儿期和儿童早期补充维生素D,可降低1型糖尿病的发病率。
补充维生素D是防治骨质疏松的基本措施
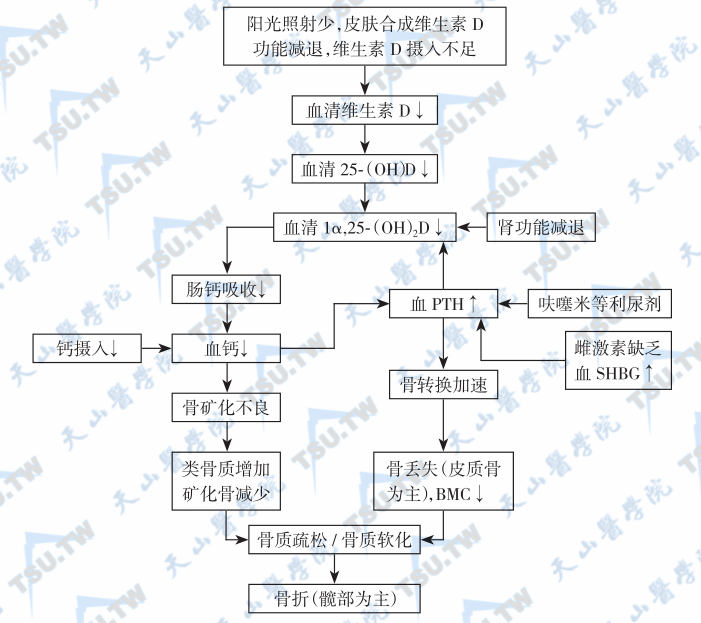
维生素D缺乏和继发性甲旁亢所致的骨病及骨折
注:老年人由于户外活动减少,皮肤合成维生素D不足和肾功能减退易导致维生素D缺乏,如摄入钙不足更易发生。此外,老年女性因同时有雌激素缺乏等原因,往往通过继发性甲旁亢进一步加快骨矿丢失。BMC:骨矿含量;PTH:甲状旁腺素;SHBG:性激素结合球蛋白。
维生素D缺乏和继发性甲旁亢所致的骨病及骨折见上图。理想的维生素D水平是骨骼健康和骨质疏松症防治的基本要求,维生素D被列为骨质疏松症防治的基础药物和重要营养素。理想的25(OH)D水平应满足以下要求:
- 能最大程度地抑制血PTH浓度;
- 能达到最大的钙吸收;
- 能达到最高的骨密度;
- 能最大程度地降低骨丢失率;
- 能最大程度地降低骨折率。
多数学者认为,能预防骨折的血清25(OH)D水平估计为75~80nmol/L(30~32ng/ml)。根据IOF的建议,补充维生素D的剂量取决于个体用药前的25(OH)D水平、BMI和有效日照。降低跌倒风险20%的剂量为17.5~25μg/d,降低非椎体和髋部骨折风险20%的剂量为10~20μg/d。需补充的剂量可根据测量值估算,补充每1μg的维生素D,可增加血清25 (OH)D 1ng/ml。NOF推荐50岁以上者的剂量为800~1000U/ d(20~25μg/d)。
服用维生素D应定期监测血钙、钙磷乘积及PTH水平,并根据监测结果调整剂量。
