BMD可作为评价治疗反应的方法,但评价的周期至少在半年或1年以上,有时需要3年,而且不能用于评价骨折发生率;而后者主要依靠骨的代谢转换率来判断。
破骨细胞活动所降解的骨基质成分的片段和分泌的产物,以及成骨细胞形成新骨所释放的代谢产物进入血液和尿中,构成了反映破骨细胞活性的骨吸收指标和反映成骨细胞活性的骨形成指标,这两种指标统称为骨转换生化指标(biochemical markers of bone turnover)或骨代谢生化指标(biochemical markers of bone metabolism)。随着科学技术的迅速发展,新的骨转换生化指标不断被发现(下表)。
骨形成生化指标

注:IRMA:免疫放射分析法;EIA:酶免疫分析;RIA:放射免疫分析法;ELISA:酶联免疫吸附法;CLIA:化学发光免疫分析法。
骨吸收生化指标
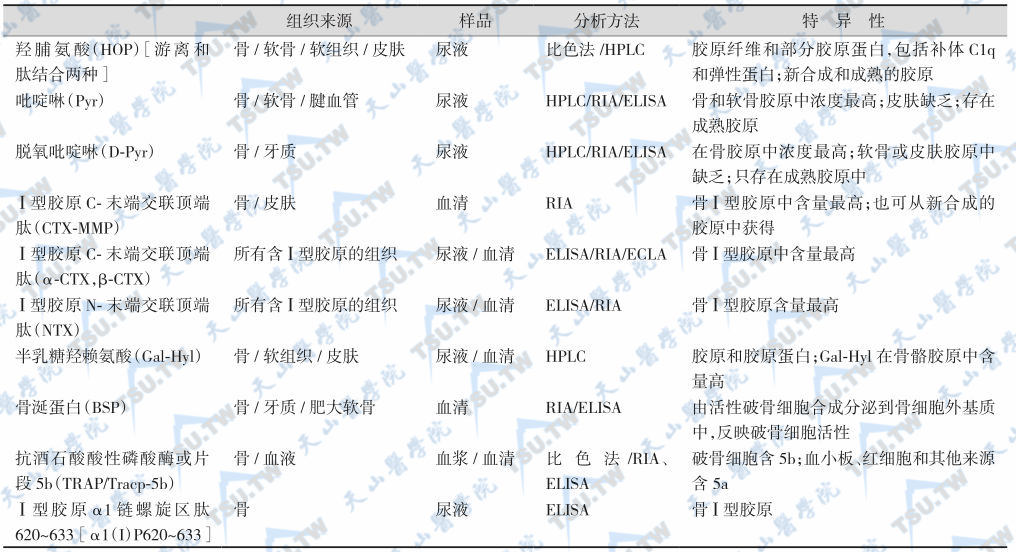
注:HPLC:高效液相色谱法;ECLA:电化学发光法。
最近的研究表明,骨生化指标可提供有关骨龄(bone age)和骨质量(bone quality)方面的信息。因此,测定骨生化指标有助于发现骨质疏松的高危患者,并可为药物的使用和病情观察提供指导意见。
血总钙和离子钙是诊断的基本指标
各实验室的血清总钙(serum total Calcium)正常值范围略有差异,测定方法不同对结果有一定影响。常用的正常值为:婴幼儿2.5~3.0mmol/L(10~12mg/dl);成人2.10~2.55mmol/ L(8.4~10.2mg/dl)。成人至70岁前,血清总钙均较稳定,95%以上的人群波动在2.20~2.50mmol/L(8.8~10.0mg/dl)之间。一般认为,如血清总钙低于2.20mmol/L(8.8mg/dl)或高于2.55mmol/L(10.2mg/dl)则属异常。除疾病外,实验性干扰因素很多,分析结果时应予注意。
血钙值偏高
主要原因有:①标本处理不当,试管口软木塞接触血清,木塞中钙进入血标本中;②血标本久置空气中,血液被浓缩。
血钙值偏低
主要原因是:
- 用草酸盐抗凝,血清钙与草酸结合成草酸钙沉淀。
- 血细胞吸收钙。
- 血清白蛋白降低,1g白蛋白可结合0.8mg钙。因此,可用4.0g/dl白蛋白为基数,每降低1g白蛋白加0.8mg钙校正。或用下列公式计算校正值,即校正后的血清总钙(mg/dl)=实测的血清总钙-0.09×[血清白蛋白(g/dl)-4.6]=实测的血清总钙/[0.55+血清总蛋白(g/dl)/16]=实测的血清总钙-[(血清白蛋白(g/ dl)-3.4)×0.72]=实测的血清总钙(mg/dl)-血清白蛋白(g/ dl)+4.0。
- pH对血总钙也有一定影响,pH升高,总钙趋向于降低,Ca2+向细胞内转移;相反,pH下降,总钙趋向于偏高,Ca2+由细胞内向细胞外液和血浆转移。低钙血症和高钙血症的病因很多,详见后述。
血离子钙反映甲状旁腺功能和骨代谢状况
离子钙测定法
用专用的离子钙(ionized Calcium)测定仪,实验误差较小。正常值(1.13±0.03)mmol/L,女性稍高,老年人稍低。
计算法
先测定滤过负荷钙(超滤钙),离子钙=0.83×超滤钙;或反之,超滤钙=1.2×离子钙。但计算值常有一定误差。而且个体的离子钙可有10%之差异,不一定能真正反映离子钙水平。一般用离子钙=0.47×总钙来推算。目前,测定血液及其他体液中Ca2+浓度的最好方法是选择性钙离子电极法。本法的非技术性干扰因素较少,但必须限定抗凝所用的肝素剂量(肝素使Ca2+测定值偏低)或改用其他抗凝剂。所测样本中的pH和存在的钙结合物对Ca2+测定值有影响。
在临床上,有时要特别关注血Ca2+的变化(如肝移植、胰腺炎、输血、新生儿和老年人等)。
国际临床化学专业组(IFCC)对血离子钙的标本和测定提出标准和规范要点。其主要内容是:①用于Ca2+测定的样本可以是全血、血清或血浆,标本中的Ca2+浓度受pH、肝素和抗凝剂用量(使血液稀释)等因素的影响,要注意标准化。全血标本要密封,以减少CO2的排出;标本要立即测定,否则要置于冰水(防止乳酸生成)中待测;并同时测定标本的pH。②血浆或血清标本亦应立即测定,全血样本要立即离心去除血液细胞,因久置后CO2排出,标本pH升高,因此在测定前要用混合气体平衡,其中PCO2=5.3kPa,当pH在7.2~7.6内,可根据实测pH对Ca2+测得值进行校正。同时要将肝素钠终末浓度控制在15U/ml以内,样本管应干燥成肝素钠结晶。
测定离子钙具有一定的技术难度,一些单位改用测定可滤过钙也具有同样意义。血清可滤过钙正常值为1.18~1.7mmol/ L(4.7~6.8mg/dl),其与离子钙的相关性良好,但可滤过钙在诊断间发性轻型甲旁亢方面的敏感性低于离子钙。用第二代或第三代的离子电极可满足临床上的各种特殊需要和诊断目的。
有机磷和无机磷是磷的两种存在形式
血清无机磷水平随年龄变化有较大差异。与血清磷不同的是,血钙的测定对高钙血症很有诊断意义,但对体内钙缺乏和非甲状旁腺性骨代谢性疾病的诊断价值有限,因为为了维持血钙(尤其是离子钙)的正常浓度,机体可动员骨钙随时入血。血磷受饮食摄入磷的影响明显,摄入的磷不足时,机体不会像缺钙那样立即动员骨磷入血,而是先出现血磷降低。血清无机磷升高除见于VD中毒(血钙、血磷均升高)和甲旁减外,以肾滤过磷障碍(如肾衰竭)为常见。高磷血症的治疗必须妥当。治疗不当(如使Ca×P乘积升高)也同样引起血管钙化或异位钙化。另外,也见于多发性骨髓瘤、骨折愈合期、肢端肥大症和巨人症等。血磷降低见于VD缺乏、高胰岛素血症、儿童型侏儒症、脂肪泻、甲旁亢、输注葡萄糖液等。
儿童顽固性低磷血症要想到几种遗传性佝偻病/骨质软化症可能。X-性连锁显性低血磷性佝偻病/骨质软化症(X-linked dominant hypophosphatemic rickets/osteomalacia,XLH)、常染色体显性遗传低血磷性佝偻病/骨软症(autosomal dominant hypophosphatemic rickets/osteomalacia,ADHR)和肿瘤所致的佝偻病/骨质软化症(tumor-induced rickets/ osteomalacia,TIO)的临床表现十分相似,均表现为血磷下降,尿磷增多,骨质软化。其中XLH和ADHR的病因为PHEX基因和排磷素(phosphatonin,FGF23)基因突变。PHEX基因产物为一种膜结合型内肽酶(endopeptidase),PHEX基因失活性突变后,不能将phosphorin灭活,过多的phosphatonin使肾小管的Na/P同转运体减少,磷的重吸收下降,导致磷利尿。
血清无机磷正常参考范围
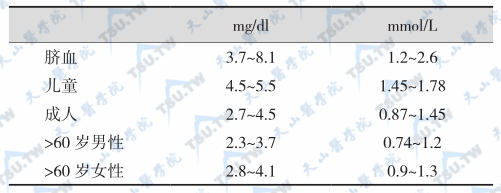
正常成人血清钙总量(mg/dl)×无机磷(mg/dl)之乘积范围为36~40。低于35,有骨质软化症或佝偻病可能,高于40可见于VD或VA中毒。
血镁测定有助于代谢性骨病的诊断
血清镁正常并不能排除镁代谢异常。此外,高镁血症很少单独存在,往往并发于某些疾患或作为某些疾病的表现之一。
正常人血清镁总量为0.7~1.0mmol/L。其中,游离镁0.40~0.55mmol/L,阴离子结合镁0.23~0.35mmol/L。严重的高镁血症(hypermagnesemia)可导致心律失常、心肌梗死、昏迷、心跳骤停和呼吸衰竭。低镁血症(hypomagnesemia)常合并低钙血症和手足搐搦症,尤其多见于重症疾病、新生儿心肌梗死、恶性高血压、心力衰竭及许多慢性消耗性疾病,血镁下降和镁缺乏常见于骨质软化症、PMOP、甲旁减、甲旁亢、甲状腺疾病、糖尿病、肾脏疾患、子痫、急慢性肾脏疾患、肾上腺疾病、肝脏疾病、蛋白-营养不良症等。
血镁升高可见于急性肾衰竭少尿期、急慢性肾衰竭晚期、甲状腺功能减退、甲旁减、慢性肾上腺皮质功能减退症、原发性高血压、多发性骨髓瘤、白血病、重症失水和糖尿病酮症酸中毒治疗前等。
尿钙排量受肠钙吸收和进餐时间的影响
尿钙排泄量的表示方法
正常人尿钙排泄量为200~250mg/24h。由于尿钙排出量受肠道钙摄入量和每日进餐时间的影响,故最好测定24小时尿钙含量。如不能测定全日尿钙,则可收集随意尿或1、2、8或12小时尿测定,但必须用尿肌酐校正。肌酐校正法不能消除体重对测量结果的影响(尿钙排泄与体内骨质总量有关),可用尿钙mg/(kg·d)来避免体重带来的差异,如欲进一步排除肾小球滤过率差别的影响,也可用mg/dl GFR来表示尿钙排泄量。在某些特殊情况(如尿路结石)下,应该用mg/ml尿量来反映尿液中的钙盐浓度。
尿钙排量的影响因素
分析尿钙结果时,还要考虑下列一些因素对尿钙排量的影响:
- 年龄:20岁前的尿钙排泄量较高,20~60岁较稳定,一般不应超过250mg/d,如超过300mg/d,可以认为属于高钙尿症。
- 体重:由于骨代谢和机体生理需要量等原因,尿钙排泄量与体重(严格讲,应该是骨组织总重量)有正相关关系。
- 性别:男性较同龄女性摄入更多的钙盐,而且肠吸收钙、磷、镁等矿物质的表面积比女性大,故男性的尿钙较高。
- 肾小球滤过率:尿钙和肌酐清除率呈正相关。肾衰患者尿钙的变异大,原因是除肾小球滤过率外,肾小球的滤过负荷和肾小管的重吸收率对尿钙的影响更明显。继发性甲旁亢可致尿钙排泄量增加。
- 昼夜节律性:出现尿钙排泄量的昼夜节律性变化有3个主要原因,即GFR、饮食,尿中钠、磷和镁等的排泄量。
- 其他因素:如饮食中的钙、磷、草酸盐,活动量及其他并发疾病等。
高钙尿症
高钙尿症(hypercalciuria)见于:
- 生长发育期、剧烈活动或长期制动、使用利尿剂、代谢性酸中毒、糖类摄入过多。
- 各种原因所致的甲旁亢。
- GH过多。
- 糖皮质激素分泌过多或应用糖皮质激素制剂。
- 甲亢。
- VD中毒或应用较大剂量VD制剂。
- 遗传性高钙尿症性低钙血症(congenital hypercalciuric hypocalcemia)。
- 其他原因引起的高钙血症。尿钙减少见于:代谢性碱中毒、甲状腺功能减退、甲旁减、GH缺乏症、肾上腺皮质功能不全、VD缺乏症等。
年龄/性别/体重/饮食/劳动强度影响尿磷和尿镁排量
如不考虑饮食摄入量和肾小球滤过负荷及肾小管重吸收率的影响,尿磷排泄量在临床上一般意义不大。尿磷排泄的最好表示方法是肾小管磷的重吸收率(见后述)。
尿磷排泄量也受年龄、性别、体重、饮食磷含量、钙含量和劳动强度等的影响而有波动。在使用利尿剂、细胞外液扩充剂(钠、氯化物等)、洋地黄类强心苷、VD制剂,或遇代谢性酸中毒、代谢性碱中毒等时,尿磷增加。此外,尿磷增加亦见于甲旁亢、甲亢、肾小管性酸中毒及其他骨吸收增强的代谢性骨病或骨肿瘤性疾病。尿磷降低一般无重要临床意义。
影响尿镁排泄的因素与钙和磷相似,尿镁的排泄量随年龄增大而有变化,一般壮年及老年人的尿镁水平稍下降。性别和体重对尿镁的影响与尿钙类似。摄入镁是影响尿镁含量的最重要因素。尿镁增高主要见于甲旁亢、原发性或继发性醛固酮增多症、慢性肾炎、甲亢、肾小管病变、糖尿病等。尿镁降低见于甲状腺功能减退、甲旁减、VD缺乏症、乳糜尿、阻塞性黄疸和尿毒症晚期等患者。
骨源性碱性磷酸酶反映骨形成和骨代谢转换率
在正常生理条件下,成人的骨源性碱性磷酸酶(BALP)与肝源性ALP之比大约为1∶1;在儿童期,ALP的活性范围分布很广,并与身高和体重呈正相关,到青春期,BALP约占总ALP(TALP)的77%~87%。BALP还与性别和激素水平有关,与30~40岁的成年妇女比较,老年妇女的血清BALP增加73%,女性在绝经后10年内的BALP增加77%。反映骨形成的BALP主要由成骨细胞分泌,起促进骨矿化作用。在体内,BALP的半衰期为24~48小时。血清中的各种ALP对56℃的热稳定试验显示,来自胎盘组织的ALP在56℃环境下完全稳定,肝源性ALP的热稳定性居中[半衰期(7.6±1.5)分钟]。不同组织来源的ALP其糖链结构存在差异,可利用ALP分子量的大小、所带电荷数的多少和其他理化性质上的差异,对其进行分离和分析。
骨钙素和Ⅰ型前胶原前肽反映骨形成水平
骨钙素(osteocalcin)亦称骨γ-羧基谷氨酸蛋白(BGP),主要由成熟的成骨细胞、成牙质细胞和肥大型软骨细胞分泌。骨钙素的半衰期为15~70分钟,由肾脏清除。因此,骨钙素水平取决于肾功能状态。血清骨钙素水平存在昼夜节律变化,早晨到中午下降,随后逐渐升高,午夜后出现高峰,峰值与谷值之差为10%~30%。此外,血清骨钙素受血离子钙、VD、月经周期和季节等因素的影响。因此,需严格控制采样条件,才能对骨钙素水平做出可靠评价。完整的骨钙素(BGP1-49)在18~25℃下的EDTA抗凝血浆中置6小时,血清或EDTA/肝素抗凝血浆置冰冻8小时,血清置-70~-135℃ 5年,其测定结果稳定。
前Ⅰ型胶原在成骨细胞中合成,其羧基端和氨基端分别向两端延伸,形成前Ⅰ型胶原的前体,向羧基端延伸的前肽称为C前肽(procollagen type Ⅰ C-propeptide,PICP),向氨基端延伸的N前肽(procollagen type Ⅰ N-propeptide,PINP)。这两种前肽实际上不是肽,而是一种不均一的三聚体蛋白,它们分别由两条前α1(I)链和1条前α2(I)链组成,又分别由两个二硫键连接成一个球形糖蛋白。在各自蛋白酶的作用下,前Ⅰ型胶原的两个前肽被切脱而成为成熟的Ⅰ型胶原。PICP 和PINP进入血液循环,由肝脏代谢分解。血清中的PICP半衰期6~8分钟。PICP存在24小时节律性波动,凌晨达峰值,午后达最低值。若于8小时内分别采血测量PICP,其最大起伏波动可达4倍。PICP和PINP在儿童和成人中的代谢清除率存在差异,儿童的PINP含量比PICP高2~3倍,而健康成人的两种肽的含量相当。从软组织Ⅲ型胶原而来的PⅢCP(Ⅲ型前胶原C-末端前肽)与PICP在序列和结构上的同源性不可忽视,但血清中的PⅢCP比 PICP低1个数量级,对PICP的实际影响较小。PICP主要由肝脏分解,因此患肝病时PICP升高。
两者均可分别采用RIA和ELISA测定。RIA测PICP的灵敏度为1.2μg/L,批内和批间变异系数分别为3%和5%。改进标记抗原和标准品后,检测灵敏度可提高到0.03nmol/L。RIA检测PINP的灵敏度为2μg/L,批内CV和批间CV分别为3%和9.3%。
BALP、BGP、PICP和PINP是广泛采用的骨形成指标,具有较好的特异性。其余的骨形成指标虽有报道,但因反映骨形成的特异性相对较差,其临床应用受到限制,而未被普遍采用。
尿羟脯氨酸反映骨吸收状态和骨转换率
体内胶原约50%在骨和肌肉,40%在皮肤;羟脯氨酸(hydroxyproline,HOP)是多种胶原的降解产物,为胶原总氨基酸的13%~14%。HOP是脯氨酸的残基羟化衍生而来,在胶原分子内形成氢键,起稳定胶原纤维的作用。破骨细胞骨吸收时,骨Ⅰ型胶原被降解,HOP释放入血,呈游离、寡肽和多肽结合形式。游离HOP经肾小球滤过,可完全被肾小管重吸收,并在肝脏进一步降解。肽结合HOP排泄到尿中,主要以与肽结合的形式存在。HOP是常用的骨吸收指标。但在正常情况下,尿中HOP只有10%来自骨Ⅰ型胶原的降解,从非骨胶原、前胶原前肽和细胞内胶原降解而来的HOP占有很大比例,弹性蛋白和补体C1q也释放HOP,从明胶食物中吸收的HOP同样使结果假性增高。在骨吸收严重的疾病(如Paget骨病、甲旁亢等)或骨转换很高的生长发育期,HOP测定有一定意义。对骨转换速率较低的绝经后骨质疏松缺乏敏感性,大约有30%的患者在正常范围。
尿HOP的检测有比色法和高效液相色谱法(HPLC)。比色法测尿HOP的批内CV或批间CV分别在10%和12%左右,检测灵敏度为5~20μmol/L。比色法测尿HOP,操作繁杂费时,精密度较差,HPLC法的变异系数小于5.3%。
骨吸收指标
吡啶啉与脱氧吡啶啉
在成人骨骼Ⅰ型胶原中,吡啶啉(pyridinoline,Pyr)与脱氧吡啶啉(deoxypyridinoline,D-Pyr)的分子比约为3.5∶1~1∶1,而其他结缔组织Ⅰ型胶原中,两者至少为10∶1。当赖氨酰氧化酶作用于成熟的胶原时,Pyr 和D-Pyr即成为降解产物释放到血液循环中,不经肝脏进一步降解而直接排泄到尿中。Pyr和D-Pyr在血液和尿中以游离和肽结合形式存在。尿中游离形式占40%,肽结合形式占60%。各种形式的Pyr和D-Pyr都非常稳定,在-20℃暗处保存20年和反复冻融10次以上或在强酸条件下加热水解,其结构不被破坏。在37~50℃条件下,Pyr和D-Pyr的稳定性明显下降,两者半衰期是37℃为5.5周,50℃为0.9周。
现在多用免疫学方法或HPLC测定Pyr和D-Pyr。测总Pyr和D-Pyr需经去肽处理。用离子对反相HPLC分析Pyr和D-Pyr的最低检测限为1pmol/L,分析全过程总误差为12%~16%。用改良Vbelhart法测Pyr和D-Pyr的检测限为0.2mmol/L,Pyr的回收率为(86±3)%,D-Pyr为(86±2)%。用固相提取和反相HPLC自动分析Pyr和D-Pyr的精密度CV<3%,与加热预处理提取法的结果高度相关(r>0.97)。免疫学方法是采用单克隆抗体识别游离的Pyr和D-Pyr,两者之间的交叉反应<1%,与交联肽没有交叉反应。批内CV和批间CV分别<10%和<15%,检测灵敏度为3nmol/L。
Ⅰ型胶原C-末端交联肽
Ⅰ型胶原C-末端交联肽(crosslinked C-terminal telopeptide of Type 1 collagen,CTX)有3种不同形式,即由基质金属蛋白酶(matrix metalloproteinases,MMP)加工而成的CTX-MMP和只含8个氨基酸序列的α-CTX 及β-CTX。CTX-MMP(以前称ICTP)是含有Pyr和D-Pyr的3条多肽链的C-末端肽,其中两条为1个Ⅰ型胶原分子C-末端非螺旋区的α1(I)链,另一条为另1个Ⅰ型胶原C-末端螺旋区的α1(I)链或α2(I)链。在骨Ⅰ型胶原分子的C-末端螺旋区连接交联的部位,只存在一种由α1(Ⅰ)C与α1(Ⅰ)C相互作用形成的C-末端肽,这可能与α2(Ⅰ)C末端缺乏1个赖氨酸残基有关,使之不能形成α1(I)C与α2(Ⅰ)C末端肽。骨Ⅰ型胶原中的D-Pyr只有40%来源于C-末端。骨CTX-MMP的结构在各种组织的Ⅰ型胶原分子中也存在,推测CTX-MMP是一个特异性较低的指标。
α-CTX和β-CTX以前统称为CrossLaps。在α-CTX和β-CTX的结构中均不含Pyr和D-Pyr。β-CTX是α-CTX的异构体形式,两者的唯一区别是在β-CTX的肽序列中的天冬氨酰(Asp)是L-对映异构体。它们均来自Ⅰ型胶原分子C-末端非螺旋区的α1(I)链上第15~22位氨基酸残基组成的特异肽序列,其组成为Glu-Lys-Ala-His-Asp(α或β)-Gly-Gly-Arg。α-CTX和β-CTX成为骨吸收指标的依据是它们含有骨Ⅰ型胶原分子间交联物的重要区段和近似交联物的残基,其紧密结构可以保护其不受肾脏的进一步降解,有较好的稳定性。尿液置-20℃7天或反复冻融5次,结果不受影响。
两者只能用RIA和ELISA检测。RIA测定的批内和批间CV分别为5.3%和6.6%,分析回收率100%。ELISA的检测灵敏度为0.34μg/L,精密度CV<8%。
Ⅰ型胶原N-末端交联顶端肽
Ⅰ型胶原N-末端交联顶端肽(N-telopeptides of type 1 collagen,NTX)可用RIA和ELISA检测。从骨骼生长发育期的正常男性尿液或人骨骼中提取的NTX含有相同的抗原决定簇,在戊二醛的作用下连接锁眼形血蓝蛋白(keyhole limpet hemocyanin)作为免疫原,免疫动物获得抗NTX的单克隆抗体。用NTX连接BSA作为包被抗原,第二抗体结合辣根过氧化物酶(HRP),N-四甲基联苯胺(TMB)为显色底物,建立竞争抑制ELISA检测血清或尿中NTX。该方法的批内CV和批间CV<10%。
抗酒石酸酸性磷酸酶是特异的骨吸收指标
抗酒石酸酸性磷酸酶(TRAP)是酸性磷酸酶6种同工酶(0~5型)中的一种,即第5型。它主要存在于巨噬细胞、破骨细胞、Gaucher细胞、红细胞、血小板、脾脏毛状细胞以及单核吞噬细胞中,但在肺泡巨噬细胞和破骨细胞中含量最丰富。血清中的TRAP主要来源于破骨细胞。
测定TRAP和Tracp5b的方法有化学比色法和免疫分析法。化学比色法的批内CV和批间CV分别为1.9%和7.9%。测定简便易行,但受酸性磷酸酶其他同工酶的干扰,使结果假性增高。免疫分析法的批内CV和批间CV<12.5%,分析范围为3.5~30μg/L,回收率约94%~106%,是特异性较好的测定方法。
