骨质疏松与骨质疏松性髋部和胫骨近端骨折
老年性骨质疏松发生于老年男、女性人群中,女性的发生率约比男性高1倍。以70~80岁为发病高峰年龄。老年性骨质疏松所致的骨折可发生于任何部位,但以髋部骨折为最多见和最严重,其次为胫骨近端。脊椎骨折可导致脊椎和胸部畸形、身材变矮,伴进行性加重的腰背疼痛和活动受限。Ⅰ型(PMOP)与Ⅱ型(老年性骨质疏松)的临床表现比较见下表。
Ⅰ型和Ⅱ型骨质疏松性以及创伤骨折的特点
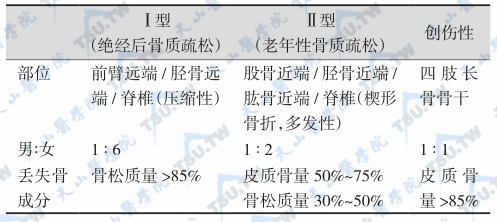
老年性骨质疏松的严重后果是骨折及其并发症,髋部骨折的主要危险因素是高龄、摔倒和已经存在的骨质疏松,但必须注意排除老年性甲旁亢可能。Benhamon等报道,在老年人骨质疏松性髋部骨折病例中,有不少是由于原发性或继发性甲旁亢(主要病因为钙和VD缺乏,其次是肾衰竭)所致。所以首先要测定血PTH和肾功能。另有一些患者的骨质疏松是由于甲亢所致,但由于甲亢的症状、体征不典型,所以极易漏诊。对于长期腰背疼痛和急起腰背疼痛患者要想到脊椎骨折可能,尽早作必要的影像检查明确诊断。
非骨质疏松并发症
老年人患有多种慢性疾病,如慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)、冠心病、高血压、肾衰竭、营养不良等。患者除有这些疾病表现外,还常使原有的骨质疏松加重,或成为骨质疏松性骨折的重要诱因,应引起重视。老年性骨质疏松的临床转归与PMOP基本相同,髋部骨折和严重的脊椎骨折需要手术治疗,如因各种原因不能接受手术,其预后不良,65岁以上男、女性髋部骨折后的年内存活率低。
骨质疏松和骨折风险因素评估
风险评估是防治骨质疏松和骨折的前提,也是临床决策的依据。临床医师应充分应用WHO推荐的FRAX系统评估患者10年内髋部与其他部位骨折概率,缺乏FRAX应用条件时,也可以应用更为简便的亚洲人骨质疏松自我筛查工具(OSTA指数)代替。遗传、年龄、体重和相关激素与骨质疏松和骨质疏松性骨折的关系密切。
骨质疏松和骨折遗传因素
一、髋部骨折的遗传性状
现已明确,骨质疏松的遗传没有性别差异(因遗传性状全部集中在常染色体上)而父母在60岁前髋部骨折史是遗传性骨折风险增高的重要依据。骨质疏松遗传因素的表现在BMD降低、骨骼尺寸细小、股骨颈较长、骨形成功能不足、骨丢失过多、1型胶原变异、破骨细胞活性增强和皮质骨较薄等。对于具体病例来说,虽然高风险的遗传因素可能有多种,但更多的往往是后天性因素,通过不可变与可变危险因素综合作用,产生所谓的“漏斗效应”(funnel effect,即多种风险因素具有相加或交互作用),使患者的骨量降低或使骨脆性增加而骨折。多项研究发现,同胞儿的任何部位骨折易感性为16%~35%,而髋部骨折为46%~53%;Richards等Meta分析了150个候选基因和40个候选基因的多态性,确定了骨质疏松/骨折的4种相关基因类型:①BMD相关基因(9个):TNFRSF11A、ESR1、LRP4、ITGA1、LRP5、SOST、SPP1、TNFRSF11B和TNFSF11。②骨折相关基因(4个):TNFRSF11A、SPP1、SOST和LRP5。③骨吸收相关基因(3个):TNFRSF11A、TNFRSF11B和TNFSF11;④药物反应相关基因(3个):VDR、ERα/ERβ和COL1A1。其中,编码RANK的TNF-α受体家族11A基因(tumor necrosis factor receptor superfamily,member 11a,TNFRSF11A)变异是低骨量/骨质疏松症(尤其是骨吸收增强)的重要致病因素,但目前有关该基因变异的特征和具体发病机制仍未明确,值得深入研究。
TNFRSF11A变异除与BMD、骨吸收水平及骨质疏松性骨折相关外,还是许多常见疾病的危险因素,这些疾病大致可分为3类:①代谢性骨病,如低骨量/骨质疏松症、骨质硬化/动脉钙化、脊椎炎/骨关节病、Paget骨病、Camuratiengelmann病和散发性高磷血症综合征等;②炎症性疾病,如类风湿关节炎、高同型半胱氨酸血症、低γ球蛋白血症、类白血病反应、网状组织细胞增多症等;③肿瘤,如乳腺癌与前列腺癌骨转移、多发性骨髓瘤、骨肉瘤、黑色素瘤、淋巴瘤等。
二、非髋部骨折的遗传性状
决定遗传性状的研究需要极大的样本数,尽管文献报道的结果对非髋部骨折的遗传性状认识不一,证据不充分,但一般认为非髋部骨折的遗传性状明显低于髋部骨折。
骨质疏松和骨折的年龄因素
各部位的BMD达到峰值骨量(35岁左右)后开始下降,普通人群至80岁时降低约30%(男性)或50%(女性)。但是,骨量随增龄下降的速度有明显性别差异,女性明显快于男性,提示雌激素缺乏对骨量的影响比雄激素要重要得多。如果某个体的增龄性骨量下降明显快于一般人群,那么就是骨质疏松和骨折的高危对象。临床发现,虽然男、女性70~80岁后的BMD变得较平稳,下降速度明显变慢,但脆性骨折却显著升高。BMD下降速度变慢也可能是一种假象(脊椎压缩、动脉-软组织钙化所致),而脆性骨折显著升高主要与骨质量显著恶化关联。BMD相同的老年人群可能至少存在两种不同的骨质量类型,一类的骨质量相对较好,虽然BMD降低,但骨折风险无明显增高;另一类的骨小梁和皮质骨结构明显紊乱。三维重建发现,在相同BMD的脊椎骨骼中,个体的骨小梁分布存在明显差异,微结构极不均匀者的压力变形所需应力极低,皮质骨多孔性更明显。因此,尽管BMD的T值正常或轻度降低,但常在不经意中发生骨折。认识高龄患者脆性骨折发生率与BMD分离现象十分重要,独立于BMD的骨质量下降是老年骨折的更关键因素,因此BMD不能用于高龄患者的骨折风险和药物疗效预测,而FRAX系统虽然综合了多种风险因素,但将适应人群的上限定为90岁似乎与上述研究结果不符,值得进一步研究。
增龄性骨量下降的速度除由遗传素质决定外,后天性因素主要有慢性炎症状态、性激素缺乏和VD不足等;骨吸收指标有助于判断骨转换水平,但骨质量评价应该更重要。目前尚缺乏可供临床应用的骨质量评价技术,高分辨外周定量CT(high-resolution computed tomography)-微CT(micro-CT)、微CT-有限元分析(finite element analysis,FEA)、容量拓扑分析(volumetric topological analysis,VTA)和数字拓扑分析(digital topological analysis,DTA)已经有了实质性进步,有望成为骨质量的有效评价方法。
骨质疏松和骨折的体重因素
肥胖是许多老年疾病的共同发病基础。追踪10年后,肥胖使主要慢性病(如代谢综合征、2型糖尿病、冠心病、高血压、血脂谱异常、某些肿瘤、胆囊炎、胆石症、痛风、骨关节病和哮喘等)的发病率明显升高,而用BMD评价的骨质疏松发病率无升高,因而一般认为,肥胖是骨质疏松的保护因素。但是,这一结论没有涉及老年人的骨折问题。
间充质干细胞可分化为成骨细胞、内皮细胞、成纤维细胞、脂肪细胞或软骨细胞;脂肪细胞、成骨细胞和破骨细胞分泌的细胞因子可调节骨代谢,脂肪细胞与成骨细胞的分化还存在相互抑制现象。肥胖者的脂肪细胞TNF-α、IL-1β、IL-6分泌增多,抑制成骨细胞分化,而且这些前炎症因子属于破骨细胞生成因子,可促进破骨细胞生成和骨吸收。能量积蓄引起肥胖,血脂和血糖升高,后者导致二酰甘油(diacylglycerol,DAG)、神经酰胺(ceramide)、反应性氧族(reactive oxygen species,ROS)、toll样受体4(toll-like receptor 4,TLR4)活化,激活炎症信号通路中的IKK/NF-κB与JNK/ AP-1,引起全身性慢性低度炎症。
肥胖的一般定义是体重指数(body mass index,BMI)超过正常。为方便起见,临床常以体重(body weight,BW)作为肥胖的粗略估计方法,当体内贮积的脂肪量≥标准体重的20%(不是指实际体重≥标准体重20%)时称为肥胖。但是,肥胖与“健壮(muscularity)”是两个完全不同的体质概念,前者系指体内脂肪比例增多,伴或不伴体重增加。因此,用体脂/体重百分比(体脂%)更能准确反映肥胖的本质。
研究发现,即使在体重正常的人群中,小梁骨的骨矿含量(BMC)仍与体脂%相关,体脂%越高,BMC越低;即小梁骨的BMC随体脂%升高而下降;显然,体脂%升高是骨丢失的风险因素。Melton等曾分析过1950~1969年间美国Rochester居民的资料,没有发现T2DM与骨折相关。但是,1970~1994年间的资料[T2DM 1964例,年龄(61.7±14.0)岁,男51%;危险因子用Andersen-Gill骨折/时间回归模型分析]显示,在23 236人年中,700例糖尿病患者发生1369次骨折,骨折风险明显升高,其危险因素包括年龄、既往骨折史、继发性骨质疏松、神经病变和糖皮质激素等;保护因素是较强的体力活动与二甲双胍。诊断肥胖型T2DM时,骨折风险已增高约30%,骨折风险随病期延长而升高,30年后高达50%。因此,肥胖至少不是骨的保护因素。但在临床上,体重较高者的确不易发生骨质疏松,此可能与个体的其他营养因素有关,而非肥胖本身。
中心性肥胖对骨代谢具有更多的不利影响。研究发现,内脏脂肪组织(visceral adipose tissue,VAT)/皮下脂肪(subcutaeous adipose tissue,SAT)比值与腰椎BMD和全身BMC(whole body BMC,WB-BMC)均呈负相关,认为主要与肥胖引起的慢性炎症有关,故应用VAT/SAT比值能预测炎症状态。另一方面,减肥干预对骨骼的影响并非是负面的,虽然减肥影响钙的吸收,但肥胖者减重时,如果摄入正常钙量,钙吸收率降低;而当摄入高钙饮食时,钙吸收率增加50%。因此,通过补充钙剂可以弥补肠道钙吸收减少所带来的不利作用。一些研究发现,虽然减肥后骨代谢指标升高而BMD有所降低,但骨折发生率却是降低的。因而减肥干预对骨代谢的利弊应采用终点事件——骨折概率来评价。
骨质疏松和骨折的激素因素
一、性激素:
性甾体类激素调节骨代谢特异性基因表达,睾酮在5α还原酶的作用下转换成二氢睾酮(DHT),在芳香化酶的作用下转换成雌二醇(E2),两者均抑制骨吸收并促进骨形成。有人发现,老年人的生物可用性雌激素降低47%,生物可用性雄激素降低64%,性激素结合球蛋白升高124%。老年男性雌激素和雄激素均明显下降(约50%),LH和FSH分别升高285%和505%。FSH刺激卵巢分泌E2,E2抑制FSH分泌。E2和GH诱导IGF-Ⅰ生成,刺激成骨。当E2缺乏时,FSH促进骨髓细胞和免疫细胞分泌TNFα和ILs,后者刺激骨吸收。绝经后雌激素缺乏者的骨髓间质细胞、B淋巴细胞和T淋巴细胞表达RANKL增高,RANKL高表达促进骨吸收。研究发现,在417例绝经后女性(60~80岁)中,给予经皮E2 0.014mg/d,血清E2水平只从4.8pg/ml升至8.5pg/ml(1年)和8.6pg/ml(2年),而腰椎BMD升高2.6%,髋部BMD升高0.4%。这一研究提示,极低剂量的E2仍然具有较强的骨保护作用。
值得特别注意的是,雌激素对男性同样具有骨保护作用。低浓度E2时,皮质骨体积BMD(vBMD)与血清E2呈正相关;高浓度时两者无相关,高-低浓度的拐点为E2的作用阈值,低于该阈值则导致骨丢失。而此时的小梁骨vBMD与E2仍相关,说明小梁骨缺乏E2的阈值现象。临床研究发现,E2和流离睾酮能预测老年男性骨质疏松;有人提出,老年男性骨质疏松的高危判断阈值是:计算的流离睾酮(calculated free testosterone,CFT)7ng/dl、生物可用性睾酮(bioavailable testosterone,BT)180ng/dl、E2 36pg/dl。
二、糖皮质激素:
高糖皮质激素血症引起骨丢失,其发病机制十分复杂,涉及许多激素、细胞因子和炎症因子的表达,如护骨素(osteoprotegerin,OPG)、RANKL(receptor activator for nuclear factor-κB ligand)、Runx2(runt-related protein 2)、骨形态生成蛋白(bone morphogenetic protein,BMP)、Dkk-1 (dickkopf-1)、GSK3β(glycogen synthase kinase 3β)、PPAR (peroxisome proliferator-activated receptor)等。此外,糖皮质激素也通过骨硬化素(osteosclerosis)抑制骨形成,糖皮质激素激活骨硬化素的骨膜细胞作用,使成骨细胞失活,从而抑制骨形成,而PTH和物理刺激(如负重)抑制骨硬化素表达,故可促进骨形成。
从病理上看,糖皮质激素引起骨质疏松(GIOP)和骨折的大致过程是:血管生成因子合成减少→骨陷窝-骨小管和血流量减少(早期骨折风险增加)→骨形成降低伴破骨细胞增多→小梁骨微结构破坏伴骨丢失(后期骨折和骨坏死风险增加)。长期使用糖皮质激素后,松质骨出现过多脂肪细胞,而成骨细胞缺乏伴骨吸收增强,骨小梁退化和断裂;孔腔扩大、增多而缺乏破骨细胞,骨形成过程延长或缺陷。股骨头骨坏死区可见骨细胞和骨膜细胞大量凋亡。
三、VD:
VD是经典的内分泌-旁分泌激素,钙代谢和其对机体的影响与VD密切相关。钙和VD缺乏对细胞增殖-分化的影响途径主要在成骨细胞。成骨细胞增殖分化低下使骨形成减少,骨量不足,儿童或青少年引起佝偻病/骨质软化,成人则导致骨质疏松症。老年人血清25-(OH)D明显低于正常,并随年龄增长而下降。克隆细胞增殖亢进可促进肿瘤形成,克隆细胞分化障碍则引起免疫功能紊乱、慢性应激和代谢异常。钙与VD慢性缺乏/不足状态对人类健康的影响远远超过人们已有的认识。到目前为止,研究还嫌欠缺。不过,钙/VD缺乏与骨质疏松症、直肠-结肠癌、某些肿瘤(乳腺、肾、前列腺、子宫、卵巢、食管-胃、胰腺、膀胱、淋巴瘤)、心血管病、神经肌肉疾病、T1DM、结核病、牙龈炎、牙周病有密切关系,与代谢综合征、T2DM、炎性肠病和多发性硬化症也相关。
骨质疏松/骨折风险评价工具的应用
目前主要有亚洲人骨质疏松自我筛查工具(OSTA指数)和WHO的FRAX系统评估10年内髋部与其他部位骨折概率(http://www. shef. ac. uk/FRAX)。
- 亚洲人骨质疏松自我筛查工具(OSTA指数):筛查方法简便易行,而且强调了年龄和体重对骨质疏松评估的重要性。
- 10年内髋部与其他部位骨折概率评估系统(FRAX工具):被广泛采用的FRAX工具方便实用,能在较大程度上反映被评估对象的骨折风险。系统中用BMI代替体重,显得更为合理,因为身高对骨质疏松没有影响。FRAX的适用人群(40~90岁)是没有发生过骨折而存在低骨量的男性和女性(T值>-2.5),40岁以下和90岁以上的个体分别按40岁或90岁计算。
