铜是人体必需的微量元素。铜在人体内作为辅因子与多种酶和蛋白结合,维护正常造血功能和铁的代谢;维护中枢神经系统的健康;维护骨骼、血管、皮肤的正常;保护机体细胞免受超氧离子的毒害。当铜稳态遭到破坏导致铜过量或缺乏时均可致病,Wilson病(WD)和Menkes病(MD)分别是其中最具代表性的两种疾病,本章着重描述Wilson病。
Wilson病又名肝豆状核变性(hepatolenticular degeneration,HLD),Wilson于1912年最早对该病进行详细而确切的报道,并将此病命名为Wilson病(WD)。此病是常染色体隐性遗传病,由于先天性铜转运蛋白酶缺陷而导致铜在一些器官中堆积引起铜中毒,使器官功能受损。临床上以肝、神经系统损伤最为突出,还有角膜色素环。WD在世界范围内流行,其患病率为3/10万,基因携带者占1/90。好发于青少年,是至今少数几种可治的神经系统遗传性疾病之一。
铜是人体必需的微量元素。正常人体内铜的总量约为100~150g,以肝和大脑中含量最多。每日从饮食中摄入的铜和从粪便中排出的铜大致相等,为2~5mg。正常人体内铜保持平衡状态。血浆中的铜以铜蓝蛋白(ceruloplasmin,CPN)形式存在。铜主要由胆汁排入肠道,再经粪便排出,不足10%的铜从小便排泄。
P-型ATP酶突变导致遗传性铜累积病
Bull、Tanzi和Yamaguchi等3个研究小组于1993年同时鉴定出WD的致病基因为ATP7B,编码ATP7B蛋白(P-型ATP酶),该基因突变使铜不能从胆汁排泄而堆积于细胞中。ATP7B属于体内重金属转运蛋白家族中的成员,基因定位于13q14.3-q21.1,又称WCI基因。ATP7B与Menkes病致病基因ATP7A(又称MCI)约有76%的同源性。
ATP7B基因含有21个外显子,肝肾中的ATP7B基因约300kb,编码约1500个氨基酸残基,与细菌中的铜转运ATP酶相似。ATP7B蛋白N末端有6个重金属结合的基序GMT/ HCXXC。外显子21编码ATP7B蛋白的羧基端和poly(A)尾。ATP7B蛋白在许多器官中均有表达,但以肝和脑组织的表达量最高。肝细胞的ATP7B蛋白将细胞铜运至细胞外,然后一部分与肝脏合成的α球蛋白结合,形成铜蓝蛋白而转运入血循环中,大部分则经肝中毛细胆管从胆汁中排入肠道,从粪便排出,后者是体内铜排泄的主要途径。
ATP7B基因突变致ATP7B酶丧失活性,不能将细胞中铜转出细胞外从而引起铜中毒和器官功能受损。铜累积病的发病机制(下图)可能为:①铜积蓄毒性;②铜离子反应产生氧类物质过多和脂质过氧化,引起细胞破坏和坏死。
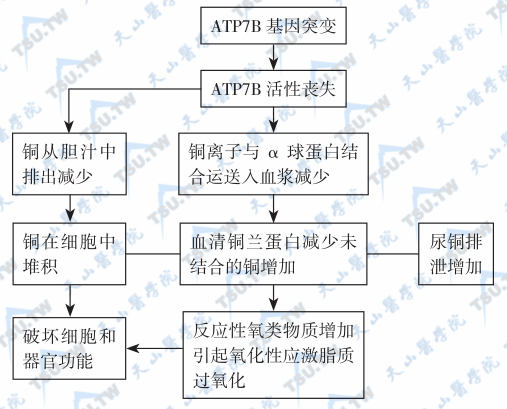
Wilson病的发病机制;注:ATP7B:P-型ATP酶
文献中已报告的ATP7B基因突变有300多种,包括插入、缺失、无义、错义、点突变和剪接异常。基因型可以是纯合子、杂合子或复合性杂合子。在不同地区的人群中,最常见的突变位点各不相同,如欧洲、北美洲最常见的突变为H1069Q,亚洲为R778,西班牙为M45A,我国台湾地区以8号外显子T2273A突变最常见。一些研究认为,如ATP7B基因有纯合子H1069Q突变,则与临床表现较迟或病情较轻有关;如果是复合性杂合子,临床表现则取决于同时与H1069Q存在的另一种突变;而R778L突变与肝病表型相关;Palsson等报告1例16岁女孩,既往健康,突发严重性肝衰竭,死于顽固性休克的Wilson病者,ATP7B有2007del7突变,而其他患者均为迟发性神经病。
因此认为,此患者与ATP7B特殊突变有关。另外一些作者则认为,突变并不能预测表型。如Prella等报告1例19岁女性WD患者,首发症状为溶血性贫血和血小板减少,ATP7B在Arg1319处被截短,故作者认为不能根据突变来预测表型。Shah等对109例WD患者进行突变与表型关系分析,未发现H1069Q突变与患者年龄、临床表现、血清铜蓝蛋白水平、肝脏铜的含量和K-F环相关。除ATP7B基因突变与表型有关外,还有其他因素在决定表型中起作用,如环境和突变基因外显率不同等。
铜积蓄引起多器官损害
患者体内有铜的堆积,但堆积的量在不同组织和器官中各不相同,堆积最多的为肝脏和中枢神经系统。肾、肺、关节、角膜、心脏等都有铜的堆积。患者出生后大多数无临床表现,待铜堆积到一定量时,会导致较明显的病理改变,从而引起临床表现。
肝脏损害
肝脏是铜代谢器官,故WD最先累及肝脏。早期只有肝细胞脂肪变性,核内糖原堆积,细胞内线粒体扩大,内膜与外膜分离,线粒体嵴扩张,其内有脂肪颗粒及空泡出现。肝细胞质和溶酶体内有铜沉积。由于铜离子产生氧化应激,氧类物质产生增多以及脂质过氧化反应,引起肝脏急性或慢性炎症,肝细胞溶解、坏死并伴有纤维化,最后形成结节;少数患者出现大结节性坏死后肝硬化。肝细胞质中可形成mallory小体,其形成机制尚不清楚,与酒精性和非酒精性肝病中所见相似。肝硬化引起继发性门脉高压、脾大和脾功能亢进症。
中枢神经系统病变
主要是退行性变。神经系统对铜离子引起的氧化性应激最敏感。常见受累部位为豆状核、基底神经节、丘脑、苍白球、红核、尾核齿状核,大脑灰质与白质均有病变。表现为神经元丧失、毛细血管扩张和巨噬细胞浸润。星状细胞有AlzheimerⅡ型细胞的胶样变性(Oplski细胞)。其特征为细胞体积较大,胞质呈泡沫状,核偏心,有大的核仁。其他病变包括脑软化、脑萎缩、脱髓鞘性病变等。脑组织受累部位可见大量未结合的铜沉积。大体脑标本可见脑软化,由于铜的沉积而呈棕红色。
其他组织病变
由于铜沉着较少,对器官功能影响较轻,但患者如果铜沉积较多也可引起器官病理改变,如肾小管退变,角膜铜沉积形成K-F(Kayser-Fleischer)环和心肌变性。关节可发生炎症、骨软化、骨质增生、脊椎骨软化炎和异位钙化等。
