血红素也称为亚铁血红素,化学命名为亚铁原卟啉Ⅸ,它是血红蛋白的辅基,分子量614D,其化学结构见下图。血红素由原卟啉Ⅸ和亚铁原子组成。原卟啉分子中含有四个吡咯环,它们借助次甲炔键相连形成,称为卟吩的四吡咯化合物。卟吩分子上可接上四个甲基,两个乙炔基和两个丙酸基侧链,因这些侧链位置的变换有15种变构体,按图11-1方式排列的称为原卟啉Ⅸ,存在于生物体中。
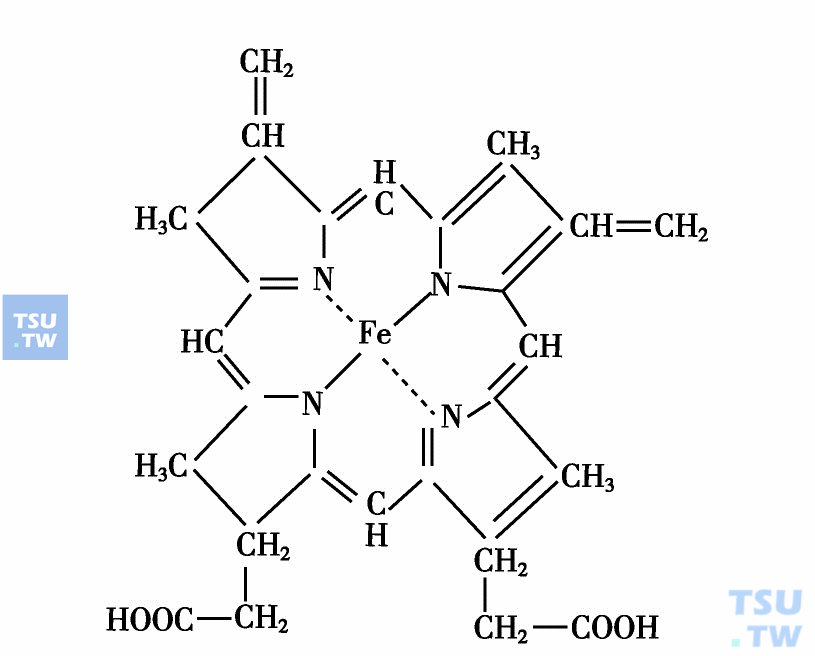
血红素的结构
血红素中的亚铁原子位于卟啉环的中心,它有六个配位键,其中四个是与原卟啉分子中心处的四个氮原子耦联,与卟啉环处于同一平面。另两个称为第五及第六配位键,分别位于血红素平面的两侧。当Hb分子中亚铁血红素与珠蛋白肽链F螺旋段第八位(F8)的组氨酸的咪唑氮原子相结合,不管和氧结合与否,都是如此,这个占据第五配位位置的组氨酸称为近位组氨酸,铁原子离开卟啉平面约0. 3Å,偏离F8组氨酸的一侧。但是位于亚铁血红素平面一侧的第六配位位置情况则不同,此为氧结合部位,并和E螺旋段第7位(E7)中的组氨酸残基发生间接作用,E7位置的组氨酸称为远位组氨酸。当Hb没有与O2结合时,第六位配位位置是空着的,发生氧合时,此位置被O2占有,从而体现血红蛋白的生理功能(下图)。但是如果血红素中的亚铁(Fe2+)被氧化为高价铁(Fe3+),Hb变成为高铁Hb,此时铁原子的第六位配位位置为水分子占有,O2被排斥在外,这种Hb就不能与O2结合,从而失去运输O2的功能,所以血红素亚铁原子的第六配位位置是很重要的,它被O2占据与否,或被任何种物质占有,对血红蛋白的运氧功能影响极大。例如大家所熟悉的煤气中毒即一氧化碳(CO)中毒,就是CO与这个第六配位键结合(CO结合力比O2的结合力强200倍),而严重影响Hb携带O2功能的结果。血红素铁原子与O2以及其在Hb分子中的情况见图。
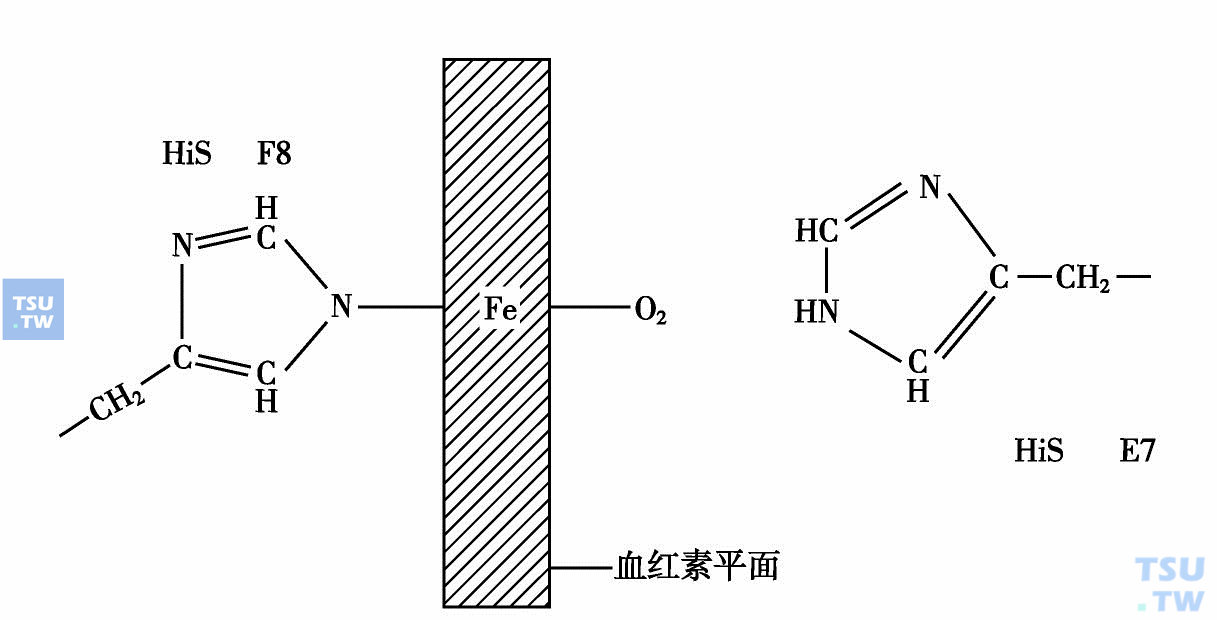
血红蛋白中氧结合示意图
第五配位位置被F8组氨酸所占据,氧结合在第六配位位置上,E7组氨酸靠近第六配位位置
血红素中的亚铁原子因电子所占外层轨道不同,有高自旋状态和低自旋状态两种形式。铁原子在低自旋状态时半径较小,它能进入卟啉环平面的中央;高自旋状态时则偏离这一平面。当血红素与配位体O2结合时(Hb+O2→HbO2),铁原子从高自旋状态变为低自旋状态,其半径变小,比脱O2时体积约减少13%,从而使铁原子进入卟啉环平面内,导致Hb构象(conformation)发生变化,Hb从脱氧构象转为氧合构象,这时Hb成为氧合Hb(oxyHb,HbO2),当配位体O2脱离血红素时(HbO2→Hb+ O2),Hb从氧合构象转为脱氧构象,这时Hb称为脱氧Hb(deoxyHb)。
