对衰老(senescence)问题的研究是生命科学的一个热门,近二十年来人们一直在探讨其分子机制。而对红细胞老化问题的研究可以说已有50多年的历史。早在1946年Shemin及Rittenborg通过用14C-甘氨酸标记的方法来测定红细胞的寿命,发现红细胞成熟后,在血液循环中可以存活120天。红细胞成熟后细胞核即脱落,血液循环中的红细胞基本是成熟红细胞,少数为网织红细胞。成熟的红细胞无核,自身无修复能力,所以老化过程的效应易被检测。老化红细胞的消亡途径大约有两个:一是老化细胞本身破溶;另外是被吞噬细胞吞噬。不论是自溶或是被吞噬都是由于细胞膜结构发生了改变。
老化红细胞膜的变化
膜脂
前面介绍过,正常红细胞膜胆固醇与磷脂有一定的比值(C/P),正常值约在0. 8。细胞老化时,胆固醇含量增高,磷脂含量相对降低,故C/P值升高,约在0. 96±0. 07。经测定,老化红细胞膜脂流动性降低,这可能是由于胆固醇含量增高的原因。
老化红细胞膜脂不对称性减弱,PS在脂双层外层增多。PS是许多酶的激活剂(如蛋白激酶C),特别是凝血酶原的激活剂。PS外翻使凝血酶原活化成凝血酶,促进红细胞的凝集,并易黏附在血管内皮细胞上,形成血栓。
膜蛋白
电镜观察正常红细胞膜的骨架为6角或8角不等的网架,老化红细胞网架不均匀有大的空孔出现。膜骨架的变化主要与骨架蛋白的磷酸化有关,可能是老化红细胞膜骨蛋白磷酸化加强。我们测定了蛋白激酶C的活性,结果胞质内及膜上蛋白激酶C的活性有显著差异。年轻红细胞胞质中的蛋白激酶C活性高,老化红细胞膜上的蛋白激酶C活性高。胞质中的蛋白激酶C无蛋白磷酸化作用,只有在Ca2+的参与下,胞质中的蛋白激酶C转入膜内,才可对膜蛋白磷酸化。老化红细胞膜蛋白激酶C活性高,膜蛋白磷酸化加强,磷酸化的2. 1、4. 1蛋白与收缩蛋白的亲和力减弱,骨架蛋白网架松散,造成老化红细胞变形能力差,最终导致红细胞破溶。
老化红细胞膜SDS-PAGE电泳区带与年轻红细胞膜比较,主要在两个部位有变化:①有高聚物产生(胶的前沿),可能为膜蛋白被氧化,交联形成的产物;②4. 1a蛋白增加,4. 1b减少。
Bosman曾测定红细胞结合自身血浆IgG的量,结果表明,老化的红细胞可结合101±5个IgG分子/细胞,而年轻者仅5±2个IgG分子/细胞。Lutz用Protein A提取红细胞表面IgG时,发现提取的是IgG-带3蛋白的复合体。他又用带3蛋白的抗体作红细胞膜的免疫印迹实验,发现老化红细胞膜有带3蛋白寡聚体(oligomer),而年轻红细胞没有。于是他提出IgG与红细胞膜结合的部位是带3蛋白,带3蛋白的寡聚体很容易与IgG结合,结合了IgG的老化红细胞可被吞噬细胞识别而吞噬。Lutz的这个假设得到许多实验室的支持。带3蛋白的功能是阴离子通道,经实验测定,老化红细胞运转阴离子的功能下降;带3蛋白的胞质部分可与3-磷酸甘油醛脱氢酶结合,老化红细胞此酶活性降低,可能是由于带3蛋白聚集所致。这些实验结果都说明老化红细胞膜的带3蛋白确有改变。
膜糖
许多学者报道唾液酸含量降低是老化红细胞的主要标志。Bartosz报道老化红细胞膜唾液酸含量比年轻者低10%~15%(以每个红细胞计算)。由于血型糖蛋白含唾液酸最多,Platt分离了年轻及老化红细胞膜的血型糖蛋白,测定唾液酸含量,结果发现老化红细胞唾液酸比年轻者低12%~18%。Aminoff提出老化红细胞唾液酸减少是由于唾液酸转移酶(Sialyl transferase)的活性增加,将唾液酸水解,露出半乳糖。丢失唾液酸的老化红细胞易被吞噬细胞识别。如将年轻红细胞与唾液酸酶(neuraminidase)共同保温,去除部分唾液酸的红细胞与IgG保温,做吞噬细胞吞噬实验,结果未经酶处理的年轻红细胞几乎不被吞噬,酶处理后的细胞大量被吞噬。经分析可能是唾液酸丢失后,暴露出的半乳糖基可与IgG结合;吞噬细胞表面有IgG受体,可识别IgG,因此可将细胞吞噬。Aminoff作了各种糖基对吞噬作用的影响,结果表明乙酰氨基半乳糖及半乳糖与吞噬细胞的识别有密切关系,其他糖与识别关系不大。
红细胞老化的机制
ATP的消耗和钙的聚集
红细胞的能量来源主要靠糖代谢产生ATP,老化红细胞内糖代谢的酶活性都有所降低,所以ATP来源明显减少。一些需能反应的酶,如红细胞膜的钠钾泵、钙泵等难以正常行使功能,结果导致红细胞内Ca2+增多,K+减少。Ca2+在胞内的聚集,使膜蛋白交联,细胞变形性降低,细胞变脆,易破溶。
ATP对红细胞膜磷脂正常分布也起着重要的作用。如氨基磷脂移位酶(flippase)需ATP才能有活性。红细胞膜磷脂呈不对称性分布,脂双层的磷脂可以互相转换,氨基磷脂移位酶可将丝氨酸磷脂(PS)从脂双层的外侧转移到内侧,使PS主要位于膜脂质双层的内侧。可当ATP减少,氨基磷脂移位酶活性降低时,翻转到外层的PS不能正常翻转到内层,所以PS在脂双层外侧的含量增加,容易引起凝血酶原活化,血小板聚集,从而导致红细胞被吞噬。
文献报道,ATP的减少,促使红细胞囊泡化(vesiculation)。红细胞产生囊泡的因素很多:Ca2+增多、自由基氧化、ATP减少等,这些因素均影响膜脂膜蛋白结构,使膜稳定性降低,逐渐脱离,通过形成囊泡释放到血循环中去。囊泡中有带3、4. 5及7等膜蛋白,无区带1、2及5等膜骨架蛋白,可能是由于氧化使红细胞膜骨架蛋白与质膜联结松散,质膜形成中空的囊泡,与红细胞脱离。质膜与骨架蛋白联结减弱的原因可能是:①氧化使膜脂双层的内层磷脂聚集,从而将脂双层膜挤出,形成棘状,然后脱落;②骨架蛋白氧化后,收缩蛋白聚集,使膜骨架网出现不均匀的、大小不一的孔;正常时,收缩蛋白与质膜的带3蛋白及血型糖蛋白有结合;收缩蛋白变性后,与质膜结合松散,质膜与骨架蛋白脱离,易于形成囊泡;③血红蛋白的氧化聚集也影响骨架蛋白的正常网架。做带3蛋白的免疫印迹,发现血红蛋白处可结合带3的抗体,说明在氧化过程中,血红蛋白逐渐变性,与带3聚集,它们的聚集,促使红细胞变形,囊泡易脱落。
红细胞不断产生囊泡,使膜不断丢失,膜表面积减少,逐渐变成球形。囊泡化过程中膜脂膜蛋白结构的变化使红细胞膜更加不稳定,囊泡化后的红细胞变形性降低,易溶血。
氧化损伤
红细胞能在自由基的侵袭中生存,主要由于它有一个有效的抗氧化防御体系。这体系主要由抗氧化酶类,如超氧化物歧化酶(SOD)、过氧化氢酶(Cat)、谷胱甘肽过氧化物酶(GSH-Px),以及抗氧化剂,如维生素C、E和谷胱甘肽等组成。SOD起着第一道防线的作用,它能将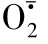 -歧化为H2O2,H2O2在Cat和GSH-Px作用下被分解成水及O2。抗氧化剂有防止脂质过氧化及蛋白质氧化变性的作用。可见红细胞的氧化与抗氧化作用处于一个均衡的状态,如果自由基产生过多或抗氧化体系有缺陷,都会导致红细胞氧化损伤。已知老化红细胞的抗氧化酶类的活性都明显降低,表明自由基氧化作用是老化红细胞膜损伤的重要因素。红细胞内的自由基,若不立即清除,长期积累能诱导膜脂及膜蛋白发生过氧化作用。膜脂质中含有许多不饱和脂肪酸,如花生四烯酸、亚麻油酸和亚油酸等,它们与自由基发生一系列的氧化反应,最后产生醛类化合物称丙二醛(malonyldialdehyde,MDA)。膜中不饱和脂肪酸遭受破坏,使膜的通透性增加(如Ca2+的透过量增加),流动性下降。扫描电镜下可见红细胞膜上出现约70Å大小的洞。脂质过氧化的终产物MDA,易与含氨基类化合物发生交联,形成Schiff碱。脂质和蛋白质都含有氨基,所以MDA与脂质及蛋白质交联,形成高分子化合物。
-歧化为H2O2,H2O2在Cat和GSH-Px作用下被分解成水及O2。抗氧化剂有防止脂质过氧化及蛋白质氧化变性的作用。可见红细胞的氧化与抗氧化作用处于一个均衡的状态,如果自由基产生过多或抗氧化体系有缺陷,都会导致红细胞氧化损伤。已知老化红细胞的抗氧化酶类的活性都明显降低,表明自由基氧化作用是老化红细胞膜损伤的重要因素。红细胞内的自由基,若不立即清除,长期积累能诱导膜脂及膜蛋白发生过氧化作用。膜脂质中含有许多不饱和脂肪酸,如花生四烯酸、亚麻油酸和亚油酸等,它们与自由基发生一系列的氧化反应,最后产生醛类化合物称丙二醛(malonyldialdehyde,MDA)。膜中不饱和脂肪酸遭受破坏,使膜的通透性增加(如Ca2+的透过量增加),流动性下降。扫描电镜下可见红细胞膜上出现约70Å大小的洞。脂质过氧化的终产物MDA,易与含氨基类化合物发生交联,形成Schiff碱。脂质和蛋白质都含有氨基,所以MDA与脂质及蛋白质交联,形成高分子化合物。
总之,老化红细胞膜脂质结构紊乱,骨架蛋白破坏,血红蛋白变性,膜蛋白-骨架蛋白-血红蛋白相互交联,导致膜变形性及稳定性下降,细胞逐渐衰亡,最终破溶或被吞噬细胞吞噬消亡。
(潘华珍 许彩民)
