AML患者达CR后应予缓解后治疗,若不进行缓解后治疗,患者多在6~9个月内复发。这是因为达CR后骨髓中仍存在相当数量形态学不能检测出的白血病细胞。缓解后治疗的目的是清除体内残留白血病,以减少复发,延长生存,甚至达到治愈。本阶段的治疗关键应该是开始要早(诱导缓解后立即开始),剂量强度应比诱导化疗更大(常用HD、IDAra-C为主的各种联合方案),或者还要加用诱导化疗期未用过的其他药物。
缓解后的治疗选择可以归纳为以下几种:①巩固化疗与诱导缓解治疗方案可以相同,也可不同;②常规剂量联合化疗巩固后予维持治疗(骨髓抑制相对较轻),延长治疗周期;③含HD-Ara-C的方案;④大剂量治疗,并予自体造血干细胞支持;⑤异基因造血干细胞移植。
化疗
早期的研究中多数患者接受了较诱导缓解治疗强度弱的巩固治疗,此后多继续维持治疗(但一般均达轻微的骨髓抑制),约10%~15%的CR患者达到治愈。后来,多数年轻患者接受了较集中的短期强化治疗,总的生存情况明显改善,20%~25%的CR患者取得长生存。现在大多数年轻患者接受了含HD-Ara-C的联合方案巩固强化。ECOG协作组比较自20世纪70年代以来不同时期对成人AML采取不同的缓解后治疗所达到的远期疗效,包括缓解后给予停药观察;长期小剂量维持化疗;常规剂量联合化疗巩固加长期小剂量维持化疗;含HD-Ara-C联合方案巩固强化后停药,不再加用维持治疗。以上四组患者的4年DFS率依次为0%、15%、20%和30%。证明强烈的缓解后治疗可以改善生存。
缓解后巩固强化的剂量和治疗周期如何掌握更有利于改善AML的疗效是十分重要、也是一个逐渐明了的问题。多数作者认为缓解后经足够强烈地巩固、强化治疗4~6疗程(全部治疗一般不超过缓解后6个月)之后,再给或不给维持治疗,两者的缓解生存率并无差别。前面提到的ECOG协作组资料,缓解后用AMSA+HD-Ara-C巩固1疗程和用标准剂量Ara-C + 6-TG维持治疗2年,4年无复发生存(RFS)率分别为27%±10%和16%±8%,也证明维持治疗无延长缓解的作用。中国医学科学院血液学研究所总结了20世纪90年代以后成人AML的治疗经验,结果也证实缓解后标准剂量化疗≥6疗程可以明显改善中位DFS和5年生存率。Ohno等却认为缓解后以标准剂量方案维持治疗12疗程比仅治疗4疗程的DFS明显要好,但强调维持治疗剂量应达到骨髓抑制。尽管AML缓解后维持治疗是否必要有争议,但充分的缓解后治疗可以改善无病生存率这一观点是一致的。
中、大剂量Ara-C可以提高细胞内Ara-CTP水平,达到更强的杀灭白血病细胞的目的,目前常用的是Ara-C 1~3g/m2,静脉输注3小时,q12h×6~8次。已有多家报道采用HD或ID-Ara-C单药应用或联合用药作为年轻AML的缓解后治疗,4年DFS率30% ~40%。常用于联合治疗的药物有蒽环类、AMSA、VP-16等。美国癌症与白血病协作组B(CALGB)在60岁以下的AML患者中进行了随机对照研究。均采用标准的DA3+7方案诱导缓解,随后随机分为三组进行4个疗程的缓解后治疗:A组HD-Ara-C 3g/ m2,q12h(输注3小时)×6次;B组ID-Ara-C 400mg/ (m2•d)×5d(连续输注);C组标准剂量Ara-C 100mg/(m2•d)×5d(连续输注),与蒽环类药物联合。中位随访4. 3年,4年DFS率分别为44%、29%、24%,HD-Ara-C治疗的相关死亡率为5%。美国东部肿瘤协作组(ECOG)的试验设计有所不同,将CR1的AML患者随机分为两组:A组予AMSA+ HD-Ara-C 3g/m2,q12h(输注1小时)×12次;B组给予2年的维持治疗。60岁以下的患者4年DFS率分别为28%和15%,HD-Ara-C治疗的相关死亡率为12%。但也有不同的观点,如英国医学研究委员会(MRC)AML10临床试验采用Ara-C剂量≤1g/m2的巩固治疗方案取得了DFS率和总生存(OS)率分别为43%、40%的疗效。美国西南肿瘤协作组(SWOG)在诱导缓解和缓解后治疗中均采用大剂量和标准剂量Ara-C与DNR联合治疗初治AML,比较两个方案的疗效发现:含HD-Ara-C的诱导方案毒性大,而CR率和生存期无改善。采用标准剂量方案诱导缓解的患者再随机给予标准剂量Ara-C或HDAra-C巩固,疗效无差异。
HD、ID-Ara-C的血液学和非血液学毒性均增加,老年AML患者由于脏器功能较差,使用HD-Ara-C的死亡率明显增高,缓解率和生存期并不比标准剂量Ara-C优越。因此,HD-Ara-C仅适用于治疗年龄<60岁的患者,老年患者即使应用HD-Ara-C也应相对降低剂量。迄今为止HD-Ara-C的最佳用药剂量、天数、疗程数(MRC AML12的资料认为缓解后巩固3疗程和4疗程的结果无差异)等仍不清楚。更加高效低毒的缓解后治疗方法方案还有待探索。
造血干细胞移植(HSCT)的应用
尽管70%~80%的AML患者化疗后可以达CR,但相当比例的患者依靠化疗是无法治愈的,这就要涉及干细胞移植的问题。干细胞移植主要分为自体干细胞移植、异基因干细胞移植。
预处理方案
根据对骨髓清除作用的强弱,预处理方案分为清髓性和非清髓性两类。
清髓性预处理方案按是否含全身照射(TBI)分为含TBI的预处理方案和不含TBI的预处理方案:①含TBI的预处理方案:TBI的总量一般为10~12Gy,多选择分次照射,照射剂量率一般在10cGy/ min以下。由于单用TBI还不足以消灭体内的瘤细胞,TBI必需和化疗药物合用。最常用的是环磷酰胺(Cy)60mg/(kg•d)×2d,此外还可用VP-16 (60mg/kg)、美法仑(140mg/m2)、白消安(Bu,12~16mg/kg)或Ara-C(24~36g/m2),高危复发患者在Cy+TBI的基础上还可适当加其他化疗药物。②不含TBI的预处理方案:此类方案不需放疗等特殊设备,还可避免TBI的严重毒副作用(如白内障、性腺受损、继发性肿瘤及儿童生长发育迟缓等)。据Wallerstein提供的材料,干细胞移植时几种常用的化疗药物最大剂量如下:Cy 7g/m2(分2~4天用药)、卡莫司汀(BCNU)1350mg/m2、VP-16 3500mg/ m2(一般分3天用)、美法仑180mg/m2、噻替哌1575mg/m2、Bu 16mg/kg(分4天用药)、米托蒽醌60~75mg/m2、卡铂2000mg/m2、顺铂200mg/m2。在各种预处理方案中Bu-Cy研究最多。
非清髓性的预处理方案其最佳组成尚在探索中。多数学者采用氟达拉滨25~30mg/(m2•d)× 4~6d,在此基础上加Cy[60mg/(kg•d)×2d]±兔抗人胸腺细胞免疫球蛋白[ATG 10~30mg/(kg•d)×3 ~4d]。也有学者采用Bu[4mg/(kg•d)×2d]或美法仑(70~90mg/m2)或Ara-C[1g/(m2•d)×4d]与去甲氧柔红霉素[12mg/(m2•d)×3d]取代上述方案中的Cy。另外还有低剂量TBI(2Gy)+环孢素等。
干细胞移植在AML中的应用
表1和表2分别列出了自体干细胞移植和异基因干细胞治疗成人AML的结果。
外周血干细胞移植(PBSCT)较骨髓干细胞移植(BMSCT)造血恢复快。美国西雅图血液系统恶性疾病(包括20%的AML)干细胞移植的资料表明PBSCT和BMSCT 2年DFS率分别为65%:45%(P= 0. 03),OS为66%:54%(P = 0. 06);治疗相关死亡率为21%:30%(P = 0. 24)。急慢性移植物抗宿主病(GVHD)的发生率无显著差异。
非清髓性干细胞移植的原理主要基于移植物抗肿瘤作用,在AML治疗中尤其适用于不适合经典异基因干细胞移植的患者(老年、身体状况差、疾病晚期等)。欧洲骨髓移植登记处(EBMT)报道69例 AML或MDS患者(移植时半数以上患者为复发/难治)的非清髓性干细胞移植的结果:全组患者的1年治疗相关死亡率、复发率、OS率分别为47%、30%、41%,CR期(包括CR1及多次复发再CR的患者)进行移植的患者分别为17%、21%、67%。Peggs等报道24例患者中位随访18个月的结果:无进展生存(PFS)率44%、OS率53%,其中CR1患者DFS率和OS率分别为57%和62%。
表1 自体移植治疗成人AML前瞻性研究的疗效(随访≥4年)
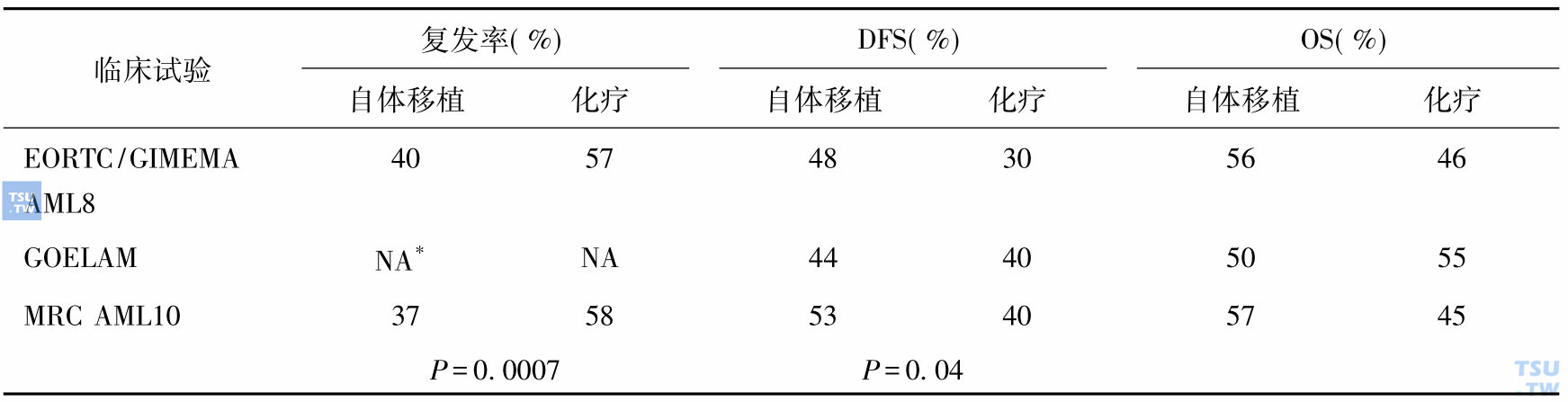
*未分析
表2 异基因移植治疗成人AML的研究结果(随访≥4年)
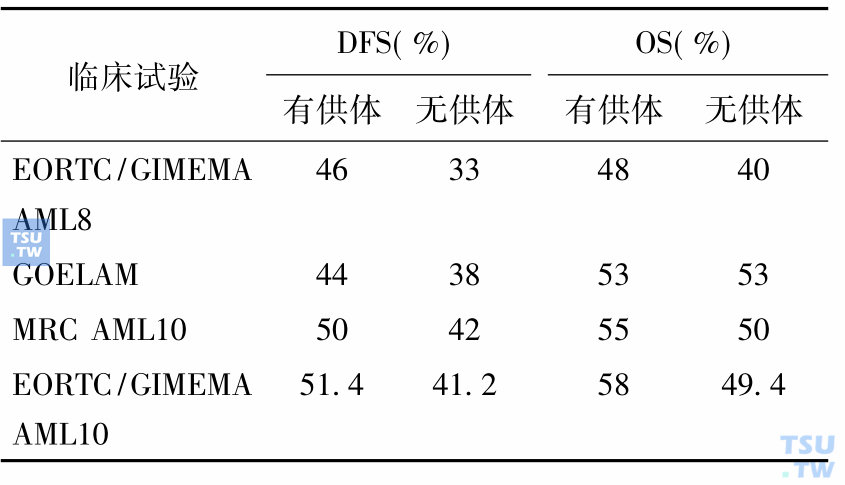
最近的研究认为单靠化疗成人AML即可取得5年OS率50%、DFS率40%的疗效,这已和异基因干细胞移植相接近,二者间的差异在逐渐缩小。对于预后良好的AML在CR1期已不主张进行造血干细胞移植。
