20世纪60年代初糖化血红蛋白的发现使糖尿病的基础生化方面的研究取得了重要进展,开始注意到机体内过高的血糖水平与蛋白质之间产生的非酶糖化反应及其产物具有不可忽视的病理生理意义。糖化蛋白的测定很快地建立了起来,并成为一种准确稳定监测糖尿病病情控制程度的有效手段。
很久以来,食品学家就注意到食物在加工及长期保存的过程中会产生一些棕黄色物质并使食品营养价值下降。1912年,Maillard证实氨基酸和还原糖可生成稳定的Amadori产物。Maillard并提出这类反应产物可能在糖尿病并发症中起作用。1948年,Patton和Hili指出由,还原糖和蛋白质上的游离氨基在不需要蛋白酶催化的直接反应中可产生蛋白质糖化终末产物(AGEs)。因此,这一非蛋白酶催化的直接糖化反应亦称为Maillard反应。Maillard反应发生在体外或体内蛋白质等物质的氨基与糖的醛基上,是一个极为复杂的过程。主要可分为三步(下图)。
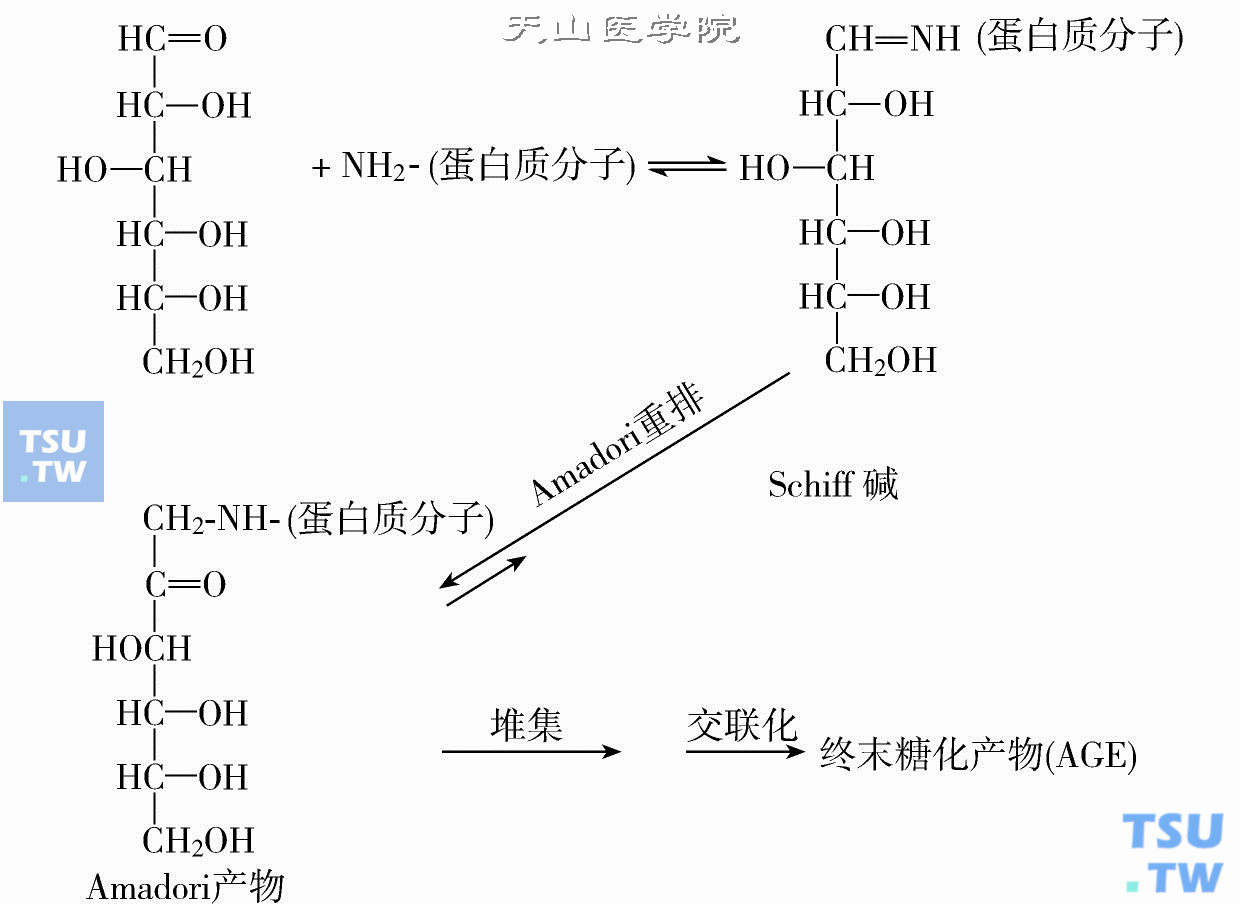
Mailard反应及糖化产物
一、生成Amadori产物
首先形成Shiff碱和aidosylamine的平衡产物,继之重排形成比较稳定的酮胺化合物——Amadori产物。这一步反应是非酶糖化反应中最重要的一步。因为:①形成的Amadori产物的可逆性很低;②这一反应生成Amadori产物是所有终产物的前体。
二、继发产物的生成
Amadori产物可进一步烯醇化被脱水或裂解生成继发产物。这步反应也是非酶催化下自动发生的,继发产物的反应活性较其前体更活跃。
三、多聚体生成
继发产物由交联所致多聚体生成,产生棕黄色的糖化终末产物。整个反应中生成的产物分成两大类即melanoidins与premelanoidins。melanoidins指Maillard反应中产生的不溶于水的产物;而premelanoidins指整个反应中除melanoidins之外的所有产物。整个Mailiard反应的速率与反应环境中底物的结构、浓度、温度及pH值相关。除底物浓度和反应温度外,底物的结构对反应速率很重要。蛋白质氨基不同,其反应活性就不一样,如胰岛素α-氨基团较ε氨基团更为活跃。
体外实验表明应用0. 3mmol(14C)acetaldehyde与2mmol人血白蛋白,室温20分钟后可见糖化产物生成。糖化产物生成占总反应物的30%。当2mmol甘氨酸与2mmol葡萄糖一起加热至90℃时,Amadori还原产物开始形成并在加热1小时达到高峰。蛋白质等物质的氨基无所不在,但在常见糖中仅部分配有醛基,加上这些糖是否配有醛基也是变化不定的。因此,AGEs的产生就不像想象的那么频繁。在常见的五、六碳糖中,与氨基反应活性依次如下:核糖>阿拉伯糖>甘露糖>半乳糖>葡萄糖。从化学性质上讲,葡萄糖是最不活跃的可与氨基起反应的六碳糖。但在人体内,特别是在患糖尿病的情况下,由于血糖水平显著升高,使Maillard反应倾向产物生成方向,AGEs大大增加,例如已被人熟知的糖化血红蛋白等。AGEs的化学反应过程表示它的生成条件简单,是非特异性的。AGEs可在体内、外环境下自然生成。
蛋白质糖化反应进行得较为缓慢,在机体中那些更换期长的蛋白质,如晶状体蛋白质、胶原蛋白质、弹性蛋白质及髓鞘蛋白质等的糖化就显得更为明显,其相关联的组织中,AGEs的增多和堆集,造成组织结构的形态发生了改变,生理功能上也起了变化。研究工作表明,那些更换期短的蛋白质,脂质的一些组成部分,核酸等都能发生Mailard反应而被糖化。例如磷脂酰乙醇胺,磷脂酰氨酸分子中都有游离氨基,均可被糖化生成AGEs。AGEs的稳定性表示它可在体内长期存留。蛋白糖化反应和其产物的两条特性提示我们注意:①非酶蛋白糖化反应是蛋白自发损伤的一种类型,在糖尿病血糖控制不佳状态时,这一反应加重而致蛋白损伤增加;②AGEs作为一种修饰蛋白质具有功能受损和对机体产生某些致病作用的可能性,特别是在其过量生成的情况下。
在AGEs形成的过程中,原蛋白质的溶解度降低,颜色逐渐加深、硬化,有的带有荧光。AGEs的结构非常复杂,很难搞清,它也并非单一的化合物。从由体内及体外所得到的AGEs碎片中了解到至少含有几种不同的结构形式,如2-(2-呋喃甲醛)-L(5)-(2-呋喃)-1-氢-咪唑(FFI),烷基-甲酰-二乙醛基吡咯(AFGP),羟甲赖氨酸(CML),pentosidine等。从这些化合物断裂的结构看,糖化反应中还掺杂着氧化过程。
四、非酶糖化反应中的氧化反应
在蛋白质非酶糖化反应的同时也伴有氧化-还原的反应过程,它与糖化反应之间关系密切,也相互影响,从而使糖化产物的结构变得多样化,促进分子间交联反应的进行。在葡萄糖与蛋白质进行糖化反应时,其Amadori产物中的碳水化合物部分发生着多种变化,可以脱氢变为烯二醇,进一步断裂出二碳或三碳的小分子,也可以变为二羰化物,继续进行酮氨缩合,而且在有氧的条件下,还可以释放出氧自由基,参与体内广泛的氧化过程。如这些氧自由基在超氧化歧化酶的作用下,可以转变为过氧化氢,进一步演变为更具氧化活性的羟自由基,进入氧化反应系统及脂质的氧化过程。但它们同时也受到体内的抗氧化系统及自由基清除物的制约。
非酶糖化过程中的这种氧化反应在体外的试验中可得到证实。果糖胶是一种初级蛋白质糖化产物,在测定糖尿病患者血中果糖胶的含量时,就能受到超氧化歧化酶的抑制;在试管中将葡萄糖与低密度脂蛋白共同保温孵育,随着时间的延长,试管中的糖化荧光产物及过氧化脂质的含量都相应地增加。笔者实验室也报道过银杏叶中提取的抗氧化物质可在体外抑制糖化白蛋白的生成。说明糖化及氧化反应是同时进行的。糖化-氧化反应的进行需要两个基本条件,一是必须有氧参加,二是需要有能转移电子的金属离子,如铁、铜离子等的存在。抗氧剂及金属络合剂都可以使反应受到抑制(下图)。
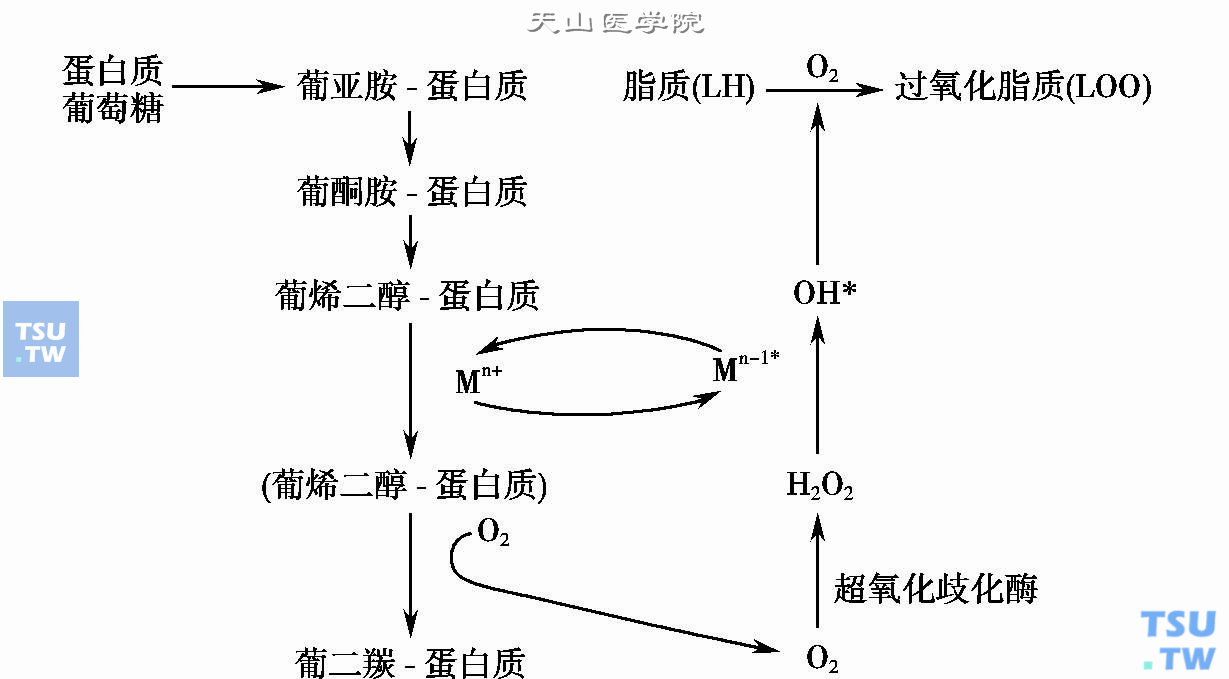
白质的糖化氧化反应
由于糖化-氧化反应所需的两种条件体内均具备,蛋白质糖化过程中又同时存在氧化过程,因而在高血糖状态下,体内氧自由基的水平升高,氧化反应增强,导致氧化-抗氧化系统的平衡受到破坏,引发病理生理方面的改变。通常糖尿病患者有较高的氧化低密度脂蛋白水平;高水平的氧自由基还可加速脂质的过氧化和对血管内皮细胞的直接损伤。另外,目前普遍认为氧化的低密度脂蛋白是引起血管硬化的病理生理基础,氧化的低密度脂蛋白生化反应性降低,易于被巨噬细胞吞噬,导致泡沫细胞的形成和堆积,使血管内膜受到破坏。但另一方面,糖化反应能够被抗氧化及金属络合剂所抑制,也为糖尿病并发症的预防和治疗提供了一条新的研究途径。已有不少的抗氧剂、自由基清除剂及金属络合剂,如硫辛酸、丙丁酚、卡维地洛等用于实验性糖尿病血管及神经病变方面的实验研究及临床观察,并取得一定效果。由此,可认为糖尿病并发症的发生与发展与糖化和氧化反应损伤均有关系。
