非ACTH受体介导性Cushing综合征(non-ACTH receptorinduced Cushing syndrome)的病因是非CRH/ACTH依赖性肾上腺皮质大结节增生(CRH/ACTH-independent macronodular adrenocortical hyperplasia,AIMAH),是肾上腺皮质表达异位激素受体所致的非CRH/ACTH依赖的肾上腺性Cushing综合征(CS)中的一种特殊类型。在不依赖CRH/ACTH情况下,其皮质醇合成和分泌增多的机制已经基本明了,自发分泌皮质醇的肾上腺增生组织受控于CRH/ACTH以外的异位激素受体(ectopic/aberant receptors)表达。目前发现,在特定的病理调节下,肾上腺皮质可表达很多异位激素受体,这些异位激素受体多属于G蛋白耦联受体类型,主要包括LH/ HCG受体、FSH受体、GIP受体、VIP受体、肾上腺素受体、去甲肾上腺素受体、TSH受体、血清素受体、血管紧张素受体、瘦素受体、胰高血糖素受体、IL-1受体等。只要存在异位激素受体相应配体(激素)的异常甚至正常刺激,即有可能发生AIMAH。
近年来,非先天性肾上腺皮质增生和肿瘤的发病机制有了许多进展,肾上腺增生引起的CS比以前想象的要多,其病因交杂,表型各异。首先,多数AIMAH独立存在,成为Cushing 综合征的特殊类型;其次,AIMAH可能是1型MEN或其他G蛋白病(如McCune-Albright综合征)的一种表现,有时可呈家族发病;第三,AIMAH可能与多种良性或恶性肿瘤并存,如胰岛素瘤、醛固酮瘤、胃肠胰内分泌肿瘤等。第四,AIMAH既有肿瘤的特征(如肾上腺大结节增生),也有非肿瘤的表现(如肾上腺增生不良);第五,异位受体诱发皮质醇分泌和CS发作,症状可轻可重,少数伴有雄激素或盐皮质激素过多表现。
AIMAH以非CRH/ACTH依赖性CS和肾上腺皮质增生为特征
异位激素受体介导的CS并非少见,临床主要表现为非CRH/ACTH依赖性高皮质醇血症。除患者有程度不等的CS表现外,血浆皮质醇升高,而ACTH降低或正常,尿皮质醇(尤其是游离皮质醇)排出过多。影像检查可见肾上腺增生,一般可发现单侧或双侧肾上腺结节,典型表现为AIMAH。
10%~40%的Cushing病患者伴双侧肾上腺增生,增生的肾上腺内存在1个或多个结节;肾上腺结节大,直径可达5~8cm。这些患者的年龄较大,病程较长。病理可见结节为分叶状,而结节与结节之间的组织亦见增生。长期ACTH刺激可致肾上腺结节形成,一些结节可能变为自主性分泌,因此应属于CRH/ACTH依赖性CS中的一种。值得注意的是,肾上腺组织增生一般用ACTH或GIP过度敏感来解释,但MAH的肾上腺组织对ACTH更敏感。有作者认为,GIP与肾上腺的结节形成有关,肾上腺对GIP的异常敏感表现为进食引起的血皮质醇升高。
非先天性肾上腺皮质肿瘤的病因已经基本阐明:①无翼型MMTV整合部家族(wingless-type MMTV integration sitefamily,WNT)是肾上腺皮质发育及肿瘤形成的重要信号通路;②抑制素A(inhibin)和肿瘤蛋白p53与肾上腺恶性肿瘤的形成有关;③多数肾上腺皮质增生和少数散发性腺瘤的发病机制涉及cAMP信号高表达;④肾上腺皮质癌的发病与IGF-2信号通路相关;⑤肾上腺肿瘤和其他肿瘤的常见原因是磷酸三酯酶基因缺陷。
凡能引起非CRH/ACTH依赖性CS的肾上腺皮质异位受体都属于G蛋白耦联受体,而且这些受体被激活后,受体后的G蛋白-cAMP信号增加均有促进细胞增殖分化和促进皮质醇合成分泌的作用。因此,它们的受体不同,但受体后信号转导的最终效果(即促进皮质醇合成与分泌)是一样的,即均作用于一共同的效应体——cAMP-反应元件结合蛋白(cAMP-responsive element-binding protein,CREB)。
双侧肾上腺皮质增生导致CS主要与遗传缺陷相关,并可分为若干种类型。AIMAH是一种复杂而不均一的临床综合征。多数患者的双侧肾上腺增生、伴多结节;少数为弥漫性增生而无大结节,偶尔表现为巨结节。平均发病年龄60岁左右,皮质醇分泌增多的原因是由于肾上腺异位表达G蛋白耦联受体。
双侧肾上腺皮质增生导致CS的遗传缺陷类型

注:BMAH:bilateral macronodular hyperplasia;双侧大结节性增生(大结节性肾上腺皮质病);MMAD:massive macronodular adrenocortical disease,大结节肾上腺皮质病(MMAD Ⅰ型);c-BMAH:childhood BMAH,儿童型双侧大结节性增生(MMAD Ⅱ型);ⅡMAH:CRH/ACTH-independent macronodular adrenocortical hyperpasia,非CRH/ACTH依赖性大结节肾上腺皮质增生;ippNAD:isolated primary pigmented noohlar adrenocortical disease,孤立性原发色素性结节性肾上腺皮质病;c-PPNAD:PPNAD associated with Carney complex,PPNAD伴Carney复合症;MAD:adrenocortical disease,肾上腺皮质病;iMAD:isolated MAD,孤立性肾上腺皮质病;AD:antosomal dominant,常染色体显性遗传,FPC:familial polyposis coli,家族性结肠多发性息肉;CNC:Carney complex,Carney复合症;HLRCS:hereditary leiomyomatosis and renal cancer syndrome,遗传性平滑肌瘤病伴肾癌综合征;MAS:McCune-Albright syndrome,Albright综合征;FH:fumarate hydratase,延胡索水解酶;GPCR:G-proteim coupled receptors,G蛋白耦联受体;GNAS:the G-protein stimulatory subunit(Gsα)gene,G蛋白刺激性亚基基因;MEN-1:multiple endocrine neoplasia 1,多发性内分泌腺肿瘤综合征;PDE:phosphodiesterase,磷酸二酯酶;PDE11A:the gene for PDE11A,PDE11A基因;PKA:protein Kinase A,蛋白激酶A,SDHx:suceinate dehydrogenase subunit,琥珀酸脱氢酶亚基。
Gsα/PKARIA突变导致皮质醇分泌过多
Gsα突变
很多内分泌激素、旁分泌激素及其他因子调节细胞的分化和增殖都是以G蛋白-cAMP为介导的。但各组织的调节机制有所不同,G蛋白-cAMP通路被激活后,多数组织的增殖受抑制,而一些内分泌腺细胞表现为增殖过度(如垂体的GH细胞和甲状腺细胞),它们分别在GHRH和TSH的作用下,通过cAMP促进靶细胞的分化和发育。因此,Gsα的失活性突变引起GH、ACTH、TSH抵抗和功能减退症。另一方面,正位(eutopic,entopic)或异位性(ectopic)GHRH/ ACTH分泌过多或Gsα亚基的活化性突变可引起组织增生,导致高功能性结节或CS。
PKARIA突变
Carney复合症(Carney complex,CC)为常染色体显性遗传性疾病。患者表现有心脏黏液病、斑点状皮肤色素沉着、多发性内分泌腺增生或肿瘤(GH瘤、甲状腺腺瘤、Sertoli细胞瘤),AIMAH、色素性施万细胞瘤(melanotic schwanomas)等,或伴有McCune-Albright综合征表现。但CC的病因不是Gsα突变所致,CC的遗传位点定位于2p16 和17q22~24。2p16含有1个原癌基因,而17q22~24存在杂合性丢失(LOH)。该位点含有一个cAMP依赖性蛋白激酶/调节亚基IA(PKARIA)。现认为该基因为CC的易感基因,PKARIA的杂合子突变导致CC。目前报道的突变类型为4~8号外显子的单个或多个碱基缺失,导致基因密码子的框架移动,提前出现终止密码子,蛋白激酶(PKA)分子被截短并丢失cAMP的结合结构域。
正常情况下,PKRIA抑制PKA的活性。但在CC患者中,按理PKARIA突变使PKA活性增加,肿瘤组织中的R1A 和R2B活性下降,而R2B亦未见代偿性增加。因而更可能的原因是PKARIA发生单体型功能不全(haploinsufficiency),在CC肿瘤组织中,基础状态下的PKA活性并无异常,只是在受到cAMP刺激后活性升高。此外,CC患者皮肤色素沉着可能是皮肤PKA活性增加,导致黑色素合成所致。以CS为例,G蛋白-cAMP途径活化导致内分泌肿瘤的病因可能涉及该信号通路中的几个环节(参见下图):①ACTH分泌过多(正位或异位);②Gsα活化性突变;③肾上腺皮质表达异位受体(如GIP、β-肾上腺素能受体、LH、FSH、5-HT、AVP等);④PKARIA的失活性突变。
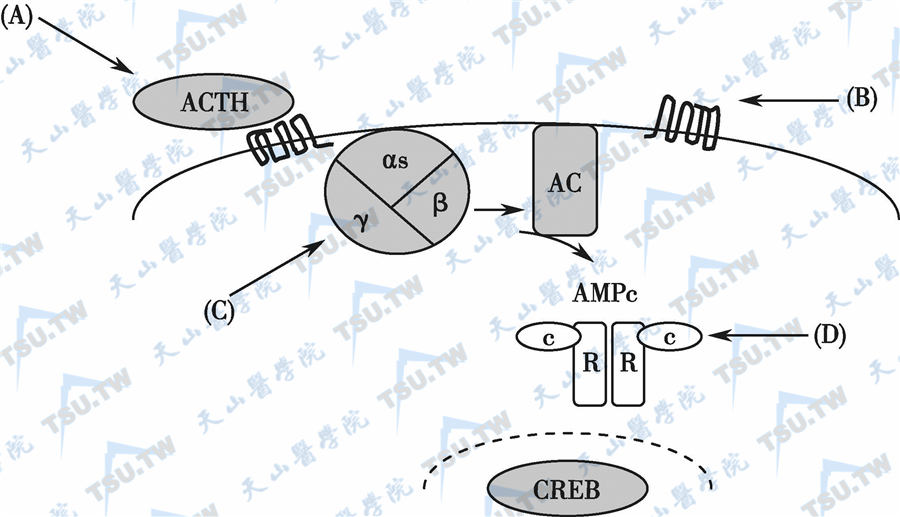
G蛋白-cAMP通路活化与Cushing综合征的病因关系
注:G蛋白-cAMP途径的活化可分为细胞外水平和细胞内水平两类。(A):细胞外ACTH过多主要是由于ACTH瘤或异位ACTH综合征所致;(B):肾上腺皮质表达异位的G蛋白偶联受体(如GIP受体,β-肾上腺素能受体,LH受体、AVP受体、5-HT受体等);(C):Gsα活化性突变,如见于McCune-Albright综合征;(D):PKARIA基因失活性突变,引起Carney复合症。AC:腺苷环化酶;C:催化亚基;R:调节亚基;GIP:葡萄糖依赖性促胰岛素多肽(glucose-dependent insulinotropic polypeptide);CREB:cAMP-反应元件结合蛋白(cAMP-responsive element-binding protein);AMPC:AMP催化亚基。
异位受体诱发皮质醇分泌和CS发作
现已明确,AIMAH是肾上腺皮质异位激素受体表达(aberrant expression of hormone receptors)所致,即均作用于一共同效应体——cAMP-反应元件结合蛋白(cAMP-responsive element-binding protein,CREB),并最终导致AIMAH。
异位LH/HCG受体表达
人类肾上腺皮质表达低水平的LH/HCG受体。血LH/HCG长期升高使某些肾上腺皮质肿瘤形成或增生分泌糖皮质激素。性腺和肾上腺皮质在个体发育上有密切联系:①两种组织均来源于胚胎尿生殖嵴和肾上腺-性腺原基(adrenal-gonadal primordium,AGP);②调节性腺和肾上腺发育过程的转录因子基本相同,如WT1、SF1、DAX-1、PBX1、CITED2和WNT4等;③两者均受下丘脑-垂体的长反馈调节;④分泌的激素均为类固醇物质;⑤在胎儿期,肾上腺和性腺的特异性基因呈交互表达(reciprocal expression)。例如,胎儿睾丸组织表达11β-羟化酶(CYP11B1)和21-羟化酶(CYP21A)及ACTH受体(MC2R),而胎儿肾上腺组织表达芳香化酶(CYP19A1A)、17-羟化酶(CYP17)和LH/HCG受体。组织特异性基因表达的上述交互性(reciprocity)在出生时停止,但在肾上腺发生肿瘤、间变或增生时,可重现这种交互性。
重现肾上腺-性腺特异性基因表达交互性的一般条件是:①肾上腺皮质在发育上残留了性腺功能;②肾上腺的促激素(ACTH和LH)分泌过多(Nelson综合征或先天性肾上腺皮质增生);在高浓度LH(卵巢切除或绝经后)作用下,性腺细胞出现转型分化(transdifferentiation),而肾上腺皮质细胞出现化生(metaplasia)。如果两种组织存在胚胎发育残余,则可能发生肾上腺皮质的促性腺激素反应性增生(gonadotropic-responsine hyperplasia)或性腺的肾上腺黄体瘤(adrenal luteomas,即卵巢鞘膜化生,thecal metaplasia)。
有些肾上腺瘤分泌性腺类固醇激素(LH反应性肾上腺肿瘤,LH-resoponsive adrenal tumors),可出现GPCR异位表达,其他类型的肿瘤(如醛固酮瘤、皮质醇瘤或雄激素分泌瘤)也分泌少的性腺类固醇激素。高水平的促性腺激素(绝经后、原发性性腺功能减退症、PCOS等)影响肾上腺皮质功能。老年人的血清皮质醇水平升高,而老年女性的升高程度(约10%)高于男性。女性绝经后,血清DHEAS呈一过性升高,可能与LH升高和肾上腺异位LH/HCG表达有关。
异位GIP受体表达
GIP依赖性CS的一般特点是:①肾上腺呈结节性增生,结节为多个,直径为1.4~7.8cm;②临床上有CS表现;③基础皮质醇低或正常,傍晚升高,不能被DXM抑制;④基础ACTH低,对CRH刺激无反应,ACTH无法测出;⑤进食引起皮质醇升高,静脉滴注葡萄糖等供能物质不引起此种变化;⑥静脉滴注GIP,血皮质醇升高的程度较滴注ACTH时升高程度明显;⑦取肾上腺皮质细胞进行体外培养,于培养液中加入GIP或ACTH,前者引起分泌皮质醇的反应较后者大;⑧用131I-胆固醇作肾上腺扫描检查,双侧肾上腺摄131I量相等;⑨部分患者用奥曲肽治疗有效。肾上腺皮质结节较大,无色素。肾上腺对GIP的反应过度,清晨血皮质醇降低,进食后明显升高,而血ACTH测不到,ACTH受体及其下游的相关基因表达被抑制。患者对外源性精氨酸或赖氨酸加压素的反应增强。一些患者口服西沙比利或甲氧氯普胺后,引起皮质醇生成过多,与5-羟色胺(5-HT)-4受体在肾上腺过度表达有关。
cAMP-依赖性信号途径异常是Carney复合症及原发性色素性大结节性肾上腺皮质病(primary pigmented nodular adrenocortical disease,PPNAD)的重要发病机制。蛋白激酶调节亚基1α(regulatory subunit type 1αof protein kinase A)由PRKAR1A基因编码,该基因突变见于多数Carney复合症患者,而磷脂酶11A(Phosphodiesterase-11A)基因(PDE11A)与-8B基因(PDE8B)突变常见于单纯性肾上腺皮质增生和CS及PPNAD患者。因此,PKA在肿瘤抑制中的作用已经阐明:PKA和(或)cAMP是肾上腺皮质增生的介导因子。
组织病理学检查见肾上腺为腺瘤样结节,含较多色素,结节来源于网状带,这说明网状带细胞也可表达GIP受体。肾上腺呈结节性增生的原因未明,左右两侧的增生反应和结节大小不一致,甚至摄取碘化胆固醇的功能也有明显差别。
OGTT试验示血浆皮质醇升高,但可被奥曲肽抑制。血浆ACTH降低,CRH兴奋后血浆ACTH和皮质醇升高(2~3倍)。在体外,肾上腺结节细胞对ACTH24和GIP均有兴奋反应(分泌皮质醇),说明皮质醇对ACTH分泌的抑制是不完全的。GIP依赖性CS对食物摄取的依赖性依食物种类不同而异,以口服葡萄糖最强,脂质饮食次之。蛋白餐或静脉注射葡萄糖无作用,对胰高血糖素、胰高血糖素样肽-1、胰岛素、TRH、GRH、AVP等刺激亦无反应。
异位AVP受体表达
AVP可通过其V3受体(V3R)激活下丘脑-垂体-肾上腺轴。一些ACTH分泌性垂体瘤对V2受体的特异性激动剂desmopressin有反应(正常人无反应)。应用该药后,ACTH和皮质醇分泌增多。Daidoh等发现,几乎所有的ACTH分泌瘤细胞都呈V3受体过表达,多种肿瘤还呈V2受体的异常表达。因此,desmopressin兴奋试验可用来鉴别ACTH瘤的病因,但其在非ACTH受体介导性CS发病中的确切意义不明。在AIMAH组织的实验中,AVP能诱导出较正常组织高得多的皮质醇分泌。用Vla受体的拮抗剂可完全抑制AVP的上述作用。患者在接受很少量的AVP (0.1U或0.3U静注)后,即见血浆皮质醇明显升高(ACTH无变化)。此外,CRH可促进Cushing病患者的AVP分泌,正常人或当患者治愈后却无这一反应,异位AVP受体介导的CS是否与此有关尚不明了。
在AVP依赖性CS中,肾上腺的AVP受体表达可能具有特殊性。首先,不同类型的CS的AVP受体表达有所不同。其次,垂体ACTH瘤细胞可表达V3(V1b)受体(支气管类癌细胞分化越好,V3受体表达越多,在AVP的作用下,可分泌ACTH)。第三,在肾上腺皮质肿瘤所致的非CRH/ACTH依赖性CS中,约1/3对AVP有反应。第四,正常肾上腺皮质和肾上腺肿瘤细胞均可表达V1RmRNA,一般腺瘤的表达量高于腺癌。所以,少数肾上腺皮质肿瘤的V1受体表达并非“异位”。
其他异位受体表达
除了上述的3种主要临床类型外,肾上腺皮质还可以表达其他异位激素受体,如TSH受体、β-肾上腺能受体、FSH受体、血清素受体4/5、前列腺素E1受体、血管紧张素受体、瘦素受体、胰高血糖素受体和IL-1 受体等。这些异位激素受体的表达可引起AIMAH而致单侧腺瘤。
