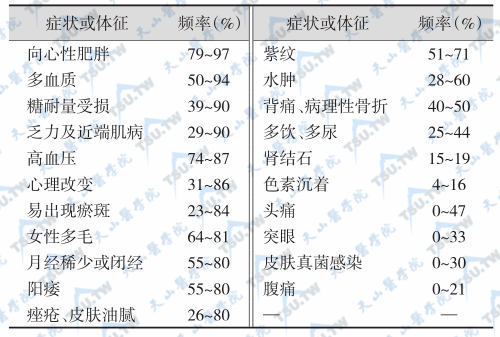
皮质醇增多症的症状表现主要是由于长期血皮质醇浓度升高所引起的蛋白质、脂肪、碳水化合物、电解质代谢紊乱,干扰多种内分泌激素分泌,机体对感染的抵抗力降低。ACTH分泌过多及其他肾上腺皮质激素过量分泌也引起相应的临床表现。主要临床表现的出现频率见下表。
成人皮质醇增多症(Cushing综合征)的主要症状和体征
过多皮质醇导致向心性肥胖/胰岛素抵抗/血脂谱异常
体脂重新分布和向心性肥胖
锁骨上区脂肪堆积和中心性肥胖是CS的早期特征性表现。多数CS患者为轻至中度肥胖,面部及躯干偏胖,但体重多在正常范围内。典型的向心性肥胖(centripetal obesity)是指面部和躯干部脂肪沉积增多,颈部粗短,四肢(包括臀部)正常或消瘦。满月脸(moon facies,颊部和颞部脂肪沉积)、水牛背(buffalo hump,颈胸段脊柱部位脂肪沉积和锁骨上窝脂肪垫)、悬垂腹(overhanging abdomen,腹部脂肪沉积)是CS的典型表现(下图);硬膜外腔脂肪沉积可引起神经损害。少数(尤其是儿童CS)呈均匀性肥胖,需与单纯性肥胖鉴别;有时患者无肥胖,其体重亦可能正常(可能与严重的骨盐丢失有关)。
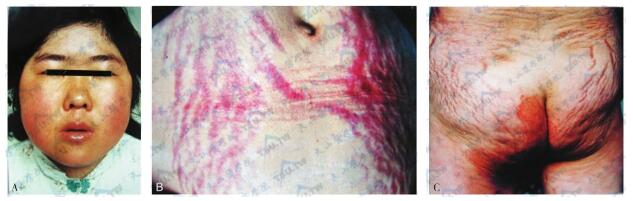
Cushing综合征患者的面部和皮肤表现
注:A:女性患者(29岁),ACTH依赖性Cushing综合征(垂体ACTH瘤),面部肥胖、多血质、多毛。B:同一患者腹部紫纹。C:同一患者臀部皮肤损害,皮下脂肪萎缩伴局部真菌感染及皮肤糜烂
肥胖是由于机体的热量摄入超过热量消耗所致。目前,向心性肥胖的原因尚不清楚。机体代谢率及热量消耗存在个体差异,遗传因素对腹内脂肪的影响大于皮下脂肪。近年来,与肥胖有关的基因研究主要集中在瘦素(leptin)基因、瘦素受体(leptin receptor)基因、β3肾上腺素能受体 (β3-adrenergic receptor,β3-AR)基因、过氧化物酶增殖体活化受体(peroxisome proliferator-activated receptor,PPAR)γ2基因、黑素皮质素受体(melanocortin receptor,MCR)基因、解耦联蛋白(uncoupling protein,UCP)基因等。中枢MC4R拮抗剂——agouti与瘦素存在“对话”现象(cross-talk),从而减弱瘦素的食欲抑制作用,导致肥胖。糖皮质激素和雄激素导致腹部脂肪沉积引起脂肪向心性分布;胰岛素促进脂肪合成。而高蔗糖饮食、吸烟、饮酒等均与向心性肥胖形成有关;此外,发生胰岛素抵抗者出现糖、脂肪、蛋白质代谢异常也可导致向心性肥胖。
肾上腺素分泌异常在脂肪异常分布中起着一定作用。儿茶酚胺兴奋β3-AR促进脂肪动员,还可通过UCP-1促进棕色脂肪氧化,棕色脂肪功能不全易发生肥胖。正常情况下,白色脂肪组织在脂肪增加时分泌的瘦素增多,血瘦素升高抑制下丘脑摄食中枢。脂肪代谢紊乱对心血管系统产生不利影响,是动脉硬化和冠心病的独立危险因子。
胰岛素抵抗
血皮质醇浓度升高促进食欲而使体重增加。皮质醇升高拮抗胰岛素作用,导致胰岛素抵抗和高胰岛素血症,胰岛素抵抗引起能量代谢异常。胰岛素的生理作用是促进脂肪合成,而脸部和躯干对胰岛素敏感,以脂肪合成占优势。皮质醇的生理作用是脂肪动员,四肢则对皮质醇敏感,以脂肪分解占优势,皮肤变薄,皮下脂肪减少,加上肌肉萎缩,四肢相对瘦小。血皮质醇升高和胰岛素抵抗共同作用导致机体脂肪重新分布,最终发展为向心性肥胖。
代谢综合征
CS和代谢综合征有许多相似之处,肥胖、胰岛素抵抗和高血压患者的血皮质醇增高,提示血皮质醇在代谢综合征的发病中起了重要作用。因为代谢综合征患者出生时的体重正常或为低体重,所以下丘脑-垂体-肾上腺皮质的功能异常在代谢综合征的发生中起了“程序化作用(programming effects)”,发生肥胖后,皮质醇增多使代谢综合征的病情进一步加重,脂肪细胞内的皮质醇作用因1型11β-羟类固醇脱氢酶(11β-HSD1)增多而扩增,加重胰岛素抵抗;而11β-HSD1抑制剂可降低脂肪细胞内的皮质醇水平,因而可能成为治疗代谢综合征的有效药物。
血脂谱异常
肝脏的脂蛋白合成增多,血胆固醇和甘油三酯升高。血脂谱异常又可进一步引起肥胖、胰岛素抵抗、血管内皮损伤和高血压。
过多皮质醇导致肌肉萎缩无力和皮肤病变
- 蛋白质合成减少与分解加速:CS患者蛋白质分解加速,合成减少,机体长期处于负氮平衡状态。肌肉萎缩以近端肌受累更明显,有些患者就诊时以此为突出表现。
- 皮肤宽大紫纹与痤疮:皮肤变薄,皮下毛细血管清晰可见,皮肤弹力纤维断裂和分离,形成宽大紫纹,加之皮肤毛细血管脆性增加,轻微外伤后出现皮下青紫瘀斑。与妊娠纹不同的是,CS所致皮肤紫纹呈红紫或蓝灰色外观,宽度大于1cm,常见于较年轻患者的腹部、大腿和乳腺,但皮肤紫纹很少见于50岁以上患者。伤口不易愈合,易脱发、皮脂分泌增多。手背部皮肤萎缩如“烟纸”外观(Liddle征)。“多血质”伴痤疮和多毛是女性CS患者的典型表现,但红细胞正常或降低。所谓“多血质”(polycythemia)是由于皮肤变薄和面部脂肪减少所造成的假象,与肥胖、高血压或红细胞增多症等引起的真性多血质有别。
- 皮肤色素改变:患者的皮肤色素稍深(CRH/ACTH依赖性CS)或变浅(非CRH/ACTH依赖性CS),明显而迅速的皮肤色素沉着主要见于异位CRH/ACTH分泌综合征和Nelson综合征;皮肤色素沉着或色素脱失是鉴别CRH/ ACTH依赖性与非CRH/ACTH依赖性CS的重要体征。皮质醇使皮肤色素脱失而ACTH促进皮肤色素沉着,因而异源性CRH/ACTH分泌综合征因肿瘤产生大量ACTH、β-LPH和N-POMC,故皮肤色素明显加深,具有鉴别意义。患者易合并皮肤感染,甲癣、体癣较常见。
过多皮质醇导致糖代谢异常与类固醇性糖尿病
高皮质醇血症使糖异生作用增强,对抗胰岛素的降血糖作用,易发展成临床糖尿病,约半数CS患者有糖耐量减低,约20%伴糖尿病(类固醇性糖尿病)。此外,CS可引起胰腺病变(如胰腺脂肪变),影响胰腺内分泌功能而加重糖代谢紊乱。与一般糖尿病相比,CS伴糖尿病者更容易发生高凝状态和血栓栓塞性病变。血液高凝状态可能与下列因素有关:①血脂谱异常;②血管内皮细胞代谢增强;③Ⅷ因子及VWF浓度升高。
过多皮质醇导致骨发育障碍/骨质疏松/骨坏死
长期慢性过量的糖皮质激素具有降低骨胶原转换作用,高皮质醇血症影响小肠钙的吸收,且骨钙动员,大量钙离子进入血液后从尿中排出。血钙虽在正常低限或低于正常,但尿钙排量增加,易并发肾石病(15%~19%)。患者多合并低骨量/骨质疏松,可致腰背疼痛、脊椎畸形、身材变矮及长骨病理性骨折,骨折的好发部位是肋骨和胸腰椎,椎体骨折引起脊柱后凸畸形和身材变矮,臂长>身高。糖皮质激素所致骨折有3个显著特点:①骨折愈合部位形成过度增生的骨痂;②大剂量长期使用(尤其是人工合成的)糖皮质激素易合并无菌性骨坏死,常发生于股骨头和肱骨头;③骨折伴尿钙增多和泌尿系结石。骨骼的非特异性炎症常与长期药理剂量的糖皮质激素导致无菌性坏死有关,其他类型的CS很少出现这种情况。CS所致的继发性骨质疏松在CS治愈后可完全或基本恢复。
儿童患者的线性生长(linear growth)受抑制,体重增加。过量皮质醇抑制儿童GH和TSH的分泌及作用,抑制性腺发育和甲状腺功能,对生长发育有严重影响。少儿期发病者生长停滞,青春期延迟;与同龄儿童相比,身材肥胖矮小;如伴脊椎压缩性骨折,身材更矮。CS生长发育障碍的原因可能与下列因素有关:①过量皮质醇抑制腺垂体分泌GH;②直接抑制促性腺激素分泌而抑制性腺发育;③影响某些细胞因子的表达。如白血病抑制因子(leukemia inhibitory factor,LIF)可抑制下丘脑-垂体-肾上腺轴功能。
过多皮质醇导致钾缺乏症与低钾血症
皮质醇有潴钠排钾作用。高水平的血皮质醇是高血压、低血钾的主要原因,加上去氧皮质酮及皮质酮等弱盐皮质激素的分泌增多,机体总钠量明显增加,血容量扩张,血压上升并伴有轻度水肿。11β-羟类固醇脱氢酶(11β-HSD)的生理作用是抑制肾脏11-羟类固醇激素活性,防止糖皮质激素与非选择性盐皮质激素受体(MR)结合而产生保钠保水排钾作用。皮质醇过量(尤其是皮质醇生成率过高)使肾脏2型11β-HSD被占用,表达出盐皮质激素的保钠排钾作用。尿钾排泄量增加,导致低血钾和高尿钾,同时伴有氢离子排泄增多而致代谢性碱中毒。严重而顽固的低血钾性碱中毒主要见于异位CRH/ACTH分泌综合征和肾上腺皮质醇分泌癌,其原因亦与大量皮质醇所表达的盐皮质激素保钠排钾作用有关,而与病变性质无明确联系。低血钾性碱中毒程度较轻,但异源性CRH/ACTH分泌综合征及肾上腺皮质癌由于皮质醇分泌显著增多,同时弱盐皮质激素分泌增加,因而低血钾性碱中毒的程度较严重,可作为Cushing病与异源性CRH/ ACTH分泌综合征的鉴别依据之一。
