糖尿病患者由于长期血糖升高,体内代谢紊乱,引起全身微循环障碍。全身性小血管和微血管病变是糖尿病常见的病理改变。眼底视网膜血管是最容易受损害的,即发生糖尿病性视网膜病变(diabetic retinopathy,DR)。糖尿病性视网膜病变的并发症是Von Jaeger(1856)首次描述的在糖尿病患者眼底可出现的特殊改变,以后有许多学者作进一步阐述,曾称为糖尿病性视网膜炎(Leber,1857)。学者们对本症进行了长期研究,了解其发展过程,认为不是炎症所致,遂称为糖尿病性视网膜病变(DR)。这是糖尿病中最严重的慢性并发症之一,也是糖尿病患者致盲的主要原因之一。由于其严重影响视功能并可导致失明的后果,应引起医生与患者重视。流行病学调查表明,大约有75%血糖控制不良的糖尿病患者,在发病15年内可导致糖尿病性视网膜病变的发生。
患病率
据世界卫生组织报道,目前全球糖尿病患者人数已超过1. 2亿,患病率大约为2. 8%。我国的糖尿病患病率也在不断上升,根据近二十年的不同省份、城市和地区的1. 5万~40万以上人群流行病学调查研究显示,糖尿病患病率在0. 67%~6. 4%。Annalisa等进行的随机抽样横断面研究方法,对4个国家160多个已诊断为糖尿病患者的糖尿病性视网膜病变的患病率及严重程度进行评估,其患病率最低为9. 16%,最高为32. 17%;其中增生性的最低发病率为19. 17%,而最高为31. 15%。我国对糖尿病性视网膜病变也进行了大量的临床研究,1998~2001年张春元报道住院糖尿病患者糖尿病视网膜病变患病率为67. 89%,何守志等1992~1994年对北京首钢职工糖尿病视网膜病变的调查显示,其患病率为17. 82%,1994~1995年王光璐等报道北京地区糖尿病性视网膜病变的患病率为9. 84%。
危险因素
病程
DR的出现与病程有关。1984年美国Klein等报道,糖尿病病程在15年以上的患者其视网膜病变高达77. 8%。国际糖尿病研究所M Cohen统计,2型糖尿病患者在初次诊断即有25%患者已有视网膜病变,美国Wisconsin糖尿病视网膜病变流行病学的调查(Wisconsin epidemiologic study of diabetic retinopathy,WESDR)显示,1型糖尿病DR患病率病程5年者为13%,10~15年占90%;2型糖尿病病程5年为24%~40%病程10~19年为53%~84%。我国的调查也显示了相似的结果。1977年上海眼耳鼻喉科医院统计了374例糖尿病患者视网膜病变患病率与病程的关系,病史在5年以下的患者为28%、6~10年为36. 4%,11~15年为58%,16年以上者为72. 7%。1986年北京周佩榕等调查幼年型和青年型糖尿病患者DR患病率为28%,其中病史4年以下者患病率仅为4%,10年以上者则为62. 5%。1998年广州吴京等调查糖尿病患者病程在5年以内的视网膜病变患病率为8. 3%。2004年冯启芳报道一组DR,糖尿病病程少于5年者DR患病率占42. 02%,5年以上发病率是88. 52%,其中增生型DR为21. 31%。2006年邹海东等报道确诊DR的患病率为27. 29%,其中单纯型的患病率为22. 99%,增生型4. 3%。有报道在糖耐量异常阶段的患者就可能有糖尿病视网膜病变发生,日本报道其患病率为1. 1%。
糖尿病类型
1型糖尿病较2型糖尿病患者DR发生早、病情重。其原因尚不清楚,可能与1型糖尿病多发生于青少年,其血浆中类胰岛素生长因子1(IGF-1)高,促进细胞的有丝分裂有关。
血糖水平
血糖较高或波动较大时可促使DR的发生和进展。大多数临床流行病学调查发现,血糖控制不良与DR的出现和严重程度有关。田俊华等报道糖尿病患者中有DR者HbA1c水平较非DR者高,且随着HbA1c水平增高DR发生呈增高趋势。提示HbA1c与DR的发生、发展有密切关系。糖尿病控制和并发症试验(diabetes control and complications trial,DCCT)研究组对1型糖尿病患者血糖控制与DR发生的关系进行研究,以HbA1c水平为正常或高20%区分DR控制的好坏的结果显示,血糖控制良好者(平均HbA1c≤6. 87%)DR发病率为9. 8%而90%无DR发生;而血糖控制不良者(平均HbA1c≥9. 49%)的DR发生率为57%而43%无DR发生,表明随着平均HbA1c的增高,DR的发生率增加,平均HbA1c增高是DR发生、发展的危险因素;HbA1c降低1%可使DR发生风险减少35%。2004年冯启芳报道一组糖尿病患者血糖水平与DR的关系发现,眼底正常组平均HbA1c为9. 13%,单纯型DR组平均HbA1c为10. 41%,增生型DR组平均HbA1c为13. 17%,表明血糖控制不良与DR的出现和严重程度有关。HbA1c控制在多少以下可起到预防作用有不同的建议,有学者报道为7. 0%,也有人提出在9. 0%以下即可起到预防或减少糖尿病性视网膜病变的发生与进展。
高血压
高血压是糖尿病性视网膜病变发生的危险因素。大多数研究认为血压与DR有相关性,糖尿病患者中有高血压者更容易发生DR,而且更严重。正常人视网膜对血压增高有自我调节和保护机制使血流量保持恒定,或在平均动脉压升高40%时血流量轻微增加。糖尿病患者血压增高可影响视网膜血流,导致视网膜血管的高灌注,损伤视网膜毛细血管内皮细胞加重DR。英国前瞻性糖尿病研究组(United Kingdom prospective diabetes study,UKPDS)对此进行了随机对照研究,严格控制组的血压小于20/11. 3kPa(150/85mmHg),控制不良组的血压小于24/14kPa(180/105mmHg),随访9年后前者较后者的DR发生风险减少34%。
眼部因素
糖尿病患者进行眼部手术可促进DR的发生且加快其发展,白内障手术中如果发生后囊膜破裂,或者进行玻璃体视网膜手术,均可能造成视网膜屏障功能的损害,使DR加速进展。有报道称,青光眼及高度近视的糖尿病患者DR患病率降低或病变程度较轻,其机制尚不清楚。
遗传因素
关于遗传因素与糖尿病患者视网膜病变发生、发展的报道较多。Rand等研究发现,HLA抗原和糖尿病性视网膜病变的发生及其发展关系密切,其中HLA-DR表现型4/0、3/0和增殖性视网膜病变的发生尤为紧密。美国DCCT研究小组也曾报道,发现家族性糖尿病成员中严重视网膜病变(包括黄斑水肿)也呈家族性群集发生。另有学者报道基因位置异常可能和糖尿病并发症的遗传易感性有关。以上结论虽然有待于进一步证实,但均说明进一步探讨遗传因素与糖尿病性视网膜病变病理机制的关系极为重要。
其他因素
包括妇女在妊娠期、蛋白尿及微量蛋白尿均可促进糖尿病性视网膜病变的发生。
发病机制
关于糖尿病性视网膜病变的发病机制,临床过程和多数已有的研究结果,提示视网膜微血管损害可引起视网膜的缺血、缺氧及新生血管形成等一系列病理改变。目前关于这方面的研究仍在继续深入探索。
长期高血糖使正常糖酵解过程受阻,葡萄糖不能经正常途径分解及激活山梨醇通路,使毛细血管周细胞内山梨醇堆积。高血糖也干扰肌醇磷脂的代谢,导致细胞内多种代谢紊乱,改变了毛细血管周细胞的生理作用,使毛细血管收缩力丧失,自身调节失常造成血液循环障碍。李维业等实验研究证实,视网膜毛细血管周细胞选择性丧失是DR最早期的组织学改变。国外学者也有报道,这种变化在其他视网膜血管性病变中未曾发现。周细胞的功能具有收缩性,可以调节通过该区与毛细血管床的血流量,由于周细胞的死亡,引起区域性视网膜血流量调节作用丧失并破坏毛细血管的完整性,还可引起内皮细胞的增生失控。毛细血管基底膜增厚也是糖尿病早期病理改变。基底膜的主要功能之一是分子滤过作用,基底膜异常可导致滤过作用改变和血清分子的异常通过,结果使血-视网膜屏障破坏。糖尿病性视网膜病变血管损害集中在血管壁,静脉以及直径为25~50μm的动脉血管均扩张,毛细血管闭塞及其所致的血管畸形扩张,导致微血管瘤形成。又因毛细血管闭塞,引起血管周围视网膜缺血,而缺血本身就可能作为刺激新生血管增殖的因子。
从血液流变学研究,糖尿病患者糖化血红蛋白增高,血液呈高凝状态,血液黏稠度增加。血小板聚集功能随DR的发生和发展有不断加强的趋势,并与生长激素水平增高导致血中第Ⅷ因子水平上升有较大关系。第Ⅷ因子由血管内皮分泌与红细胞凝集有关,还可促进血小板的集结和黏附作用,以致造成微循环功能紊乱,使血流减少,微血栓形成,致视网膜缺血,引起组织氧化作用降低,又促使缺血加重,影响视网膜的代谢。视网膜的血管反应是独特的,DR原发性刺激不在血管内,而存在于紧邻血管周围的神经和神经胶质组织内,它们比身体其他组织具有更高的代谢率,因此对血流和组织氧化作用需求更高,即使血液供应和氧化作用稍微降低,也将引起视网膜缺血及新生血管形成。最近有研究认为红细胞脂质过氧化,膜脂质成分改变是糖尿病性视网膜病变的病理基础之一。
生长激素分泌增多可抑制糖代谢,导致细胞内山梨醇积聚,增加糖尿病血管中糖蛋白和黏多糖的沉积,并加速血管硬化,促使视网膜血管微血栓形成而引起视网膜病变,故年轻糖尿病患者DR发展快且较严重。
微量元素镁、锌不足对DR也有影响。机体缺镁离子可影响视网膜组织的正常代谢,而致ATP生成减少。缺锌可影响红细胞代谢,使红细胞脆性增加,易于聚集形成微血管病变;缺锌也可使胰岛素合成与分泌更加不足,促使视网膜病变的发生与发展。
关子新生血管生长因子对糖尿病视网膜病变影响的研究发现,视网膜新生血管始于毛细血管无灌注区的边缘,故认为新生血管生长因子从缺血区产生,这是糖尿病性视网膜病变新生血管形成的重要机制。参与新生血管生长的因子有肝素结合生长因子(heparin binding growth factor,HBGF)、肿瘤坏死因子(tumor necrosis factor,TNF),转化生长因子(transforming growth factor,TGF)、成纤维细胞生长因子(fibroblastic growth factor,FGF)、血小板衍生生长因子(platelet derived factor,IGF)、胰岛素样生长因子(insulin-like growth factor,IGF)等。这些因子能刺激血管内皮细胞增生和迁移,促使细胞外基质的黏附及纤维血管膜的形成。
临床表现
在糖尿病性视网膜病变初期,视力一般不受影响,无眼部自觉症状。病情进展,可引起不同程度的视力减退、视物变形,或眼前有黑影飞动,眼前闪光感,如果病变到增生期可有新生血管大量出血至玻璃体甚至失明。
有些患者因为视力症状到医院经眼科医生检查后,发现有糖尿病性视网膜病变,然后再到内科或内分泌科详细检查才诊为糖尿病者也不少见。
部分2型糖尿病患者的典型糖尿病的“三多一少”症状不明显,没有引起重视;所以定期健康检查,若血糖浓度不正常,需到内科或内分泌科详细检查。如确诊为糖尿病除在内科或内分泌科治疗及定期复查外还要定期去眼科检查,做到早诊断、早治疗,保持并挽回有用的视力,避免失明、贻误终身。
眼底所见
糖尿病性视网膜病变随着病情轻重,眼底变化很复杂,根据新的国际糖尿病分级标准,即非增生性及增生性病变。下面是在糖尿病性视网膜病变所能见到的改变。
非增生性糖尿病性视网膜病变(NPDR)
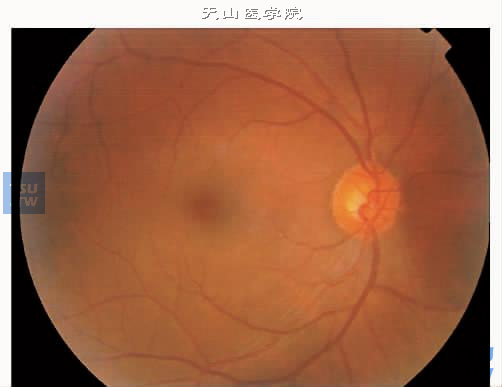
上图:正常眼底像
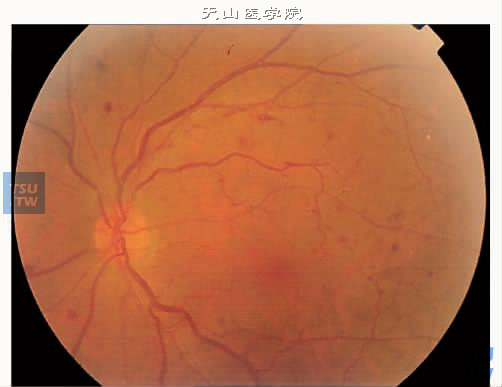
上图:非增生性糖尿病性视网膜病变Ⅰ期,视网膜静脉充盈,散在点状出血和微血管瘤
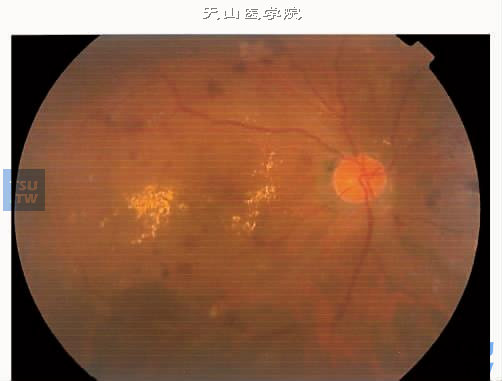
上图:非增生性糖尿病视网膜病变散在视网膜出血,后极部有黄白色硬性渗出。硬性渗出范围1DD以上,与黄斑中心凹的距离在500μm以内,为临床显著性黄斑水肿
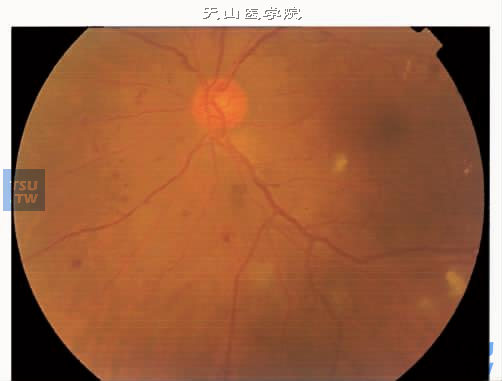
上图:非增生性糖尿病视网膜病变Ⅲ期,微血管瘤,点片状出血和棉絮状斑
1)微血管瘤:微血管瘤是检眼镜见到的视网膜上出现最早的病变。依照病情轻重微血管瘤数目多少不等,有时仅见到数个;微血管瘤大小不等,针尖大或稍大于附近小血管的直径,呈暗红色或红色,分散或簇状分布,边界清楚,位于视网膜深层,显微镜下可见微血管瘤的大小约20~100μm。它们位于毛细血管的一侧,另一侧则保持正常毛细血管管壁的结构,所以在毛细血管璧薄弱处呈小球形突出。微血管瘤瘤壁由基底膜、内皮细胞以及周细胞构成,呈囊样或柱样扩张,常分布在毛细血管异常区,如毛细血管扩张、闭塞、卷曲、内皮增生等处,随着病情加重,则任何部位的毛细血管,直到末梢小动脉或小静脉均可见到微血管瘤,而以黄斑部颞侧象限较多,微血管瘤存在的半衰期约数月到数年,也有经过一段时间后,颜色稍变淡,因此可与深层小出血鉴别,点状出血常于数周内吸收。
微血管瘤并不是糖尿病所独有的表现,在高血压、视网膜动脉硬化、视网膜静脉阻塞、视网膜静脉周围炎等患者眼底有时也能见到,但数目少,位于视网膜周边部;且在有病变的血管周围。
2)出血斑:多为圆形视网膜深层点状出血,边界不清,分布在后极部较多,可在几周内吸收,又可反复出血。应与微血管瘤鉴别,较重的患者同时有视网膜浅层线状或火焰状出血。
3)硬性渗出:为黄白色边界清晰的小斑点,为类脂质沉着。硬性渗出可来自血液循环中的血脂或来自变形的细胞,呈分散、簇状或环形分布,其中间有微血管瘤。如在黄斑部则可呈放射状排列。
4)软性渗出或称棉絮斑:是神经细胞轴突变性所致的局部缺血坏死。大小约1/4~1/3视乳头直径(disk diameter,DD),也有的达到1/2 DD,呈灰白色棉絮样,附近视网膜上可见微血管瘤,陈旧性渗出颜色较淡而薄,边界清楚。
5)视网膜血管的改变:
- 视网膜动脉硬化:糖尿病患者即使无高血压史,视网膜动脉硬化仍较同龄人明显。动脉反光带增宽,重者呈铜丝样,小动脉管径狭窄,有的闭锁呈白线,有的管壁有白鞘。
- 视网膜静脉:DR早期患者视网膜静脉可有轻度充盈,进展期和晚期患者静脉管径不匀,呈串珠样、梭形或呈球形扩张。这种静脉串珠样改变如果出现在两个象限以上,说明视网膜缺血严重,即将进入到增生期,也称为增生前期。
- 视网膜毛细血管:早期DR眼底所见可视视网膜毛细血管为正常,以后毛细血管的周细胞逐渐消失,内皮细胞增生,管腔逐渐闭塞,眼底出现棉絮斑,附近毛细血管代偿性扩张、小血管迂曲,动静脉之间或毛细血管间形成短路,称为视网膜内微血管异常(intraretinal microvascular abnormality,IRMA)。IRMA的出现提示视网膜缺血严重,是视网膜毛细血管及小动脉和小静脉对缺血的增生反应。有IRMA出现代表DR进入到增生前期。
增生性糖尿病性视网膜病变(PDR)
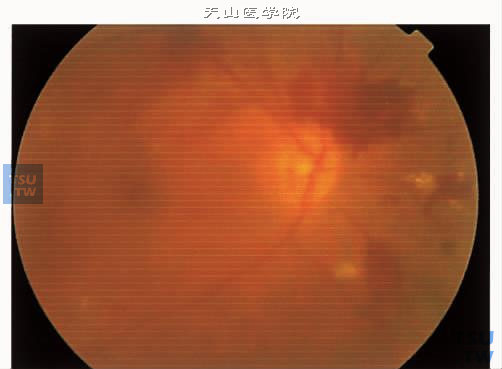
上图:增生性糖尿病视网膜病变Ⅳ期玻璃体积血,眼底朦胧,可见视网膜出血及硬性渗出
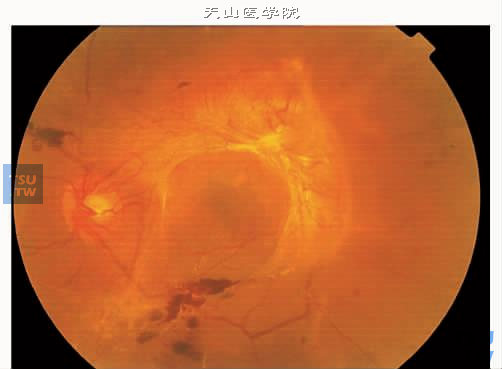
上图:增生性糖尿病视网膜病变Ⅴ期图中大片纤维增殖膜,片状视网膜出血
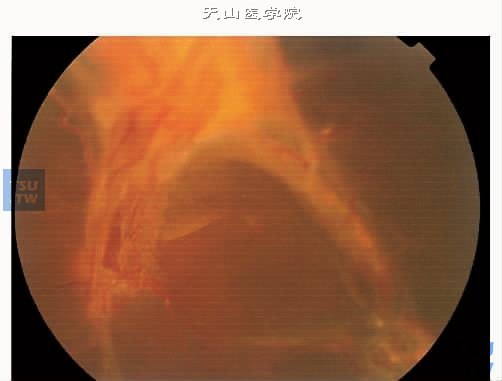
上图:增生性糖尿病视网膜病变Ⅵ期图中显示视乳头前机化牵拉性视网膜脱离
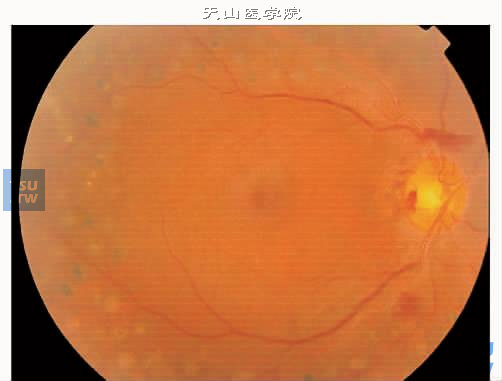
上图:增生性糖尿病视网膜病变全视网膜光凝治疗后视乳头上方和周围视网膜小片出血,视乳头上方小片视网膜前出血
糖尿病患者增生前期的视网膜改变如果没有得到及时治疗,病变将进入到增生期。新生血管的出现是进入增生期的标志。按新生血管的出现部位,分为视乳头新生血管和视网膜新生血管。
1)视乳头新生血管(neovessels on the disk,NVD):凡是在视乳头周围1DD范围内的新生血管都称为视乳头新生血管。发生NVD说明整个视网膜缺血严重。可以出现在视乳头的一个象限或整个视乳头,或累及到视乳头周围的视网膜。
2)视网膜新生血管(neovessels elsewhere,NVE):生长在视乳头周围1DD范围以外的任何部位的新生血管称为NVE。90%的NVE出现在视乳头周围6DD的附近,特别是沿着颞侧血管弓走行,以颞上支血管较多,且在动静脉交叉处附近并有纤维组织增生。到晚期,往往形成以血管弓为支架的环状的纤维增生,也可以在黄斑前增生呈膜状牵拉黄斑部发生移位变形,引起黄斑水肿和视力下降。有的学者对发展迅速、来势凶猛以及在视网膜上有广泛新生血管增生的严重增生型视网膜病变称为花卉样视网膜病变(florid retinopathy)。毛细血管闭塞和小动脉、小静脉闭塞是发生新生血管的主要因素。但年轻患者玻璃体牵拉及生长激素分泌异常,使新生血管生长更为旺盛。而在老年患者眼底有明显动脉硬化、患青光眼、视网膜中央动脉阻塞及高度近视等,则新生血管生长较少。
随着病情发展,新生血管及纤维组织增多,最后新生血管退行,留下纤维血管膜组织。这些纤维组织膜与玻璃体发生粘连。由于玻璃体脱离,牵引新生血管或视网膜静脉,以致破裂出血。出血处可在视网膜前面,出血量较大时可以进入玻璃体,致视力急剧下降至无光感和眼底无红光反射。
3)视网膜前出血:出血较多位于后极部视网膜内界膜下或视网膜前玻璃体膜之后。出血遮挡视网膜数片,大小不一,常呈半圆形或舟状。其上缘呈水平或稍凹下,可随头部位置改变而稍转动,呈暗红色。由于红细胞下沉,故上部为血清,颜色淡。出血需经几周或数月才能吸收。
4)玻璃体积血:当玻璃体内新生血管破裂或视网膜上新生血管及较大的血管破裂,出血进入玻璃体内,成为玻璃体积血。当出血量少时能朦胧看到眼底大血管,或仅见红光反射,如出血量多时则眼底无红光反射。出血停止后血红蛋白分解吸收,此过程非常缓慢。有的患者反复玻璃体积血,使玻璃体混浊机化,纤维条索加重。这些纤维组织上有丰富的新生血管,久后新生血管退行,机化条索收缩,遂引起牵拉性视网膜脱离。
糖尿病性黄斑病变
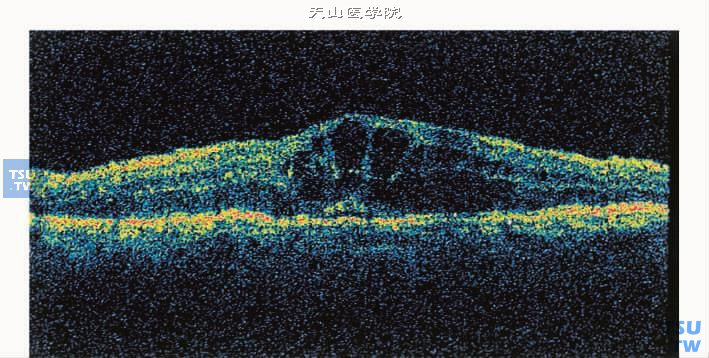
光学相干断层扫描(OCT)显示糖尿病性黄斑水肿,神经上皮层间多个囊腔,为囊样黄斑水肿
糖尿病性黄斑病变是中心视力减退的主要原因之一,其视力的减退不能用镜片矫正。在黄斑部可见到出血、微血管瘤、硬性渗出和棉絮样斑等在视网膜其他部位所见到的病变。由于黄斑部特殊的功能和特殊的解剖结构而单独表述。我国在1984制订糖尿病视网膜病变的分期标准中未将黄斑病变包括在内,但是临床上有的患者在视网膜的其他部位的糖尿病性改变并不严重,但是患者却有明显的视功能障碍。
- 局限性黄斑水肿:检眼镜可见局部黄斑部视网膜增厚,表现为视网膜的透明度下降,其下面的脉络膜血管走行看不清楚,成簇的硬性渗出或呈环状,环状渗出中央可见微血管瘤。
- 弥漫性黄斑水肿:由于微循环障碍,导致广泛的毛细血管渗漏,及因缺血导致的视网膜外屏障功能受损引起弥漫性渗漏增加,可有大量硬性渗出融合成环状或大片蜡样斑块,晚期可看到胆固醇结晶。
- 缺血性黄斑病变:在检眼镜下与弥漫性黄斑水肿不易鉴别,在荧光血管造影中可见到毛细血管拱环的破坏。
目前国际上已经将相干光断层扫描(optical coherence tomography,OCT)作为诊断黄斑水肿的必要工具之一,鉴于OCT对黄斑水肿的诊断价值和相对于传统检查方法的优势,有人提出将OCT检测结果作为诊断黄斑水肿的“金标准”。黄斑水肿类型:黄斑水肿患眼的OCT图像归纳为三种类型:视网膜海绵样肿胀、黄斑囊样水肿及神经上皮层脱离。海绵样水肿的特征是视网膜神经上皮厚度增加,呈海绵样肿胀外观;囊样水肿的特征为黄斑部视网膜神经上皮层间一个或多个囊腔的存在,呈圆屋顶外观;神经上皮层脱离特征为视网膜神经上皮层隆起,与色素上皮层间有暗反光区域存在。
糖尿病性视网膜病变的分期和分型
依照糖尿病性视网膜病变的轻重,历年来许多学者各有自己的分类法,如Wagener(1945)分类法、Duck-Elder(1967)分类法、Scott(1973)分类法、Little(1980)分类法、Aiellores(1981)分类法等,各有优缺点。中华医学会眼科学会于1984年第三届年会上通过了我国糖尿病性视网膜病变分期标准(下表)。
我国糖尿病性视网膜病变分期标准

2002年经国际上16个国家包括眼科和内分泌学科的31位学者,主要依据两个重要的循证医学临床研究:美国糖尿病视网膜病变早期治疗研究协作组(early treatment diabetic retinopathy study research grouup,ETDRS)和Wisconsin糖尿病视网膜病流行病学研究组共同制订了糖尿病视网膜病变严重程度分级和糖尿病性黄斑水肿(diabetic macular edema,DME)的严重程度分级,分为非增生性糖尿病视网膜病变和增生性糖尿病视网膜病变。严重程度分级见下表。
糖尿病视网膜病变严重程度分级
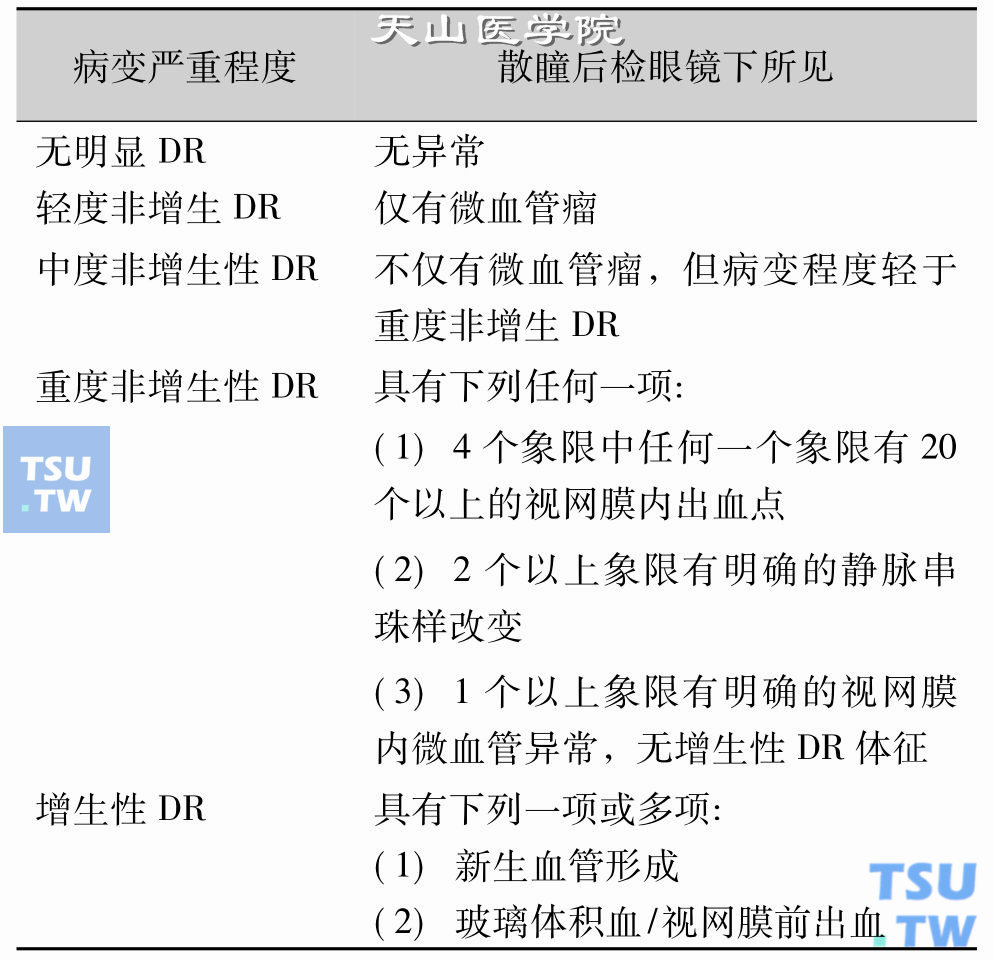
糖尿病视网膜病变严重程度分级

糖尿病视网膜病变的眼底影像学改变
眼底荧光血管造影术
眼底荧光血管造影术(funds fluorescein angiography,FFA)荧光血管造影观察视网膜血管的动态变化中,可见微血管瘤的数目比在检眼镜下见到的多。早期位于动脉侧,且多见于毛细血管闭锁区的周围,该闭锁区多位于后极部。微血管瘤充盈荧光后,呈亮点,即荧光小点,圆形、稍大于小血管的直径、边清,也有非常细小的或较大的,少数呈不规则形,边缘不清。微血管瘤在眼底各象限均可出现,包括视乳头的鼻侧和颞侧上、下血管弓之间,在黄斑部颞侧为多,拱环附近也有,但较少(图55-6,见书后插页)。另有少数微血管瘤在荧光造影中不显影,可能是因为微血管瘤内血流淤滞,形成血栓,或瘤体机化。出血斑为遮挡荧光,有时微血管瘤和小点状出血检眼镜下不易鉴别,荧光造影下如果为强荧光则为微血管瘤,反之为出血。硬性渗出不显影,也不阻挡背景荧光,但大片硬性渗出可呈现假荧光或弱荧光。棉絮斑表现为局限的无灌注的弱荧光区。荧光造影下可以清晰观察到视网膜内微血管异常(intraretinal microvascular abnormality,IRMA)。IRMA周围大都存在非灌注区和强荧光点。黄斑部可见到弥漫性强荧光以中心凹为中心的花瓣状强荧光。老年糖尿病性黄斑水肿的发生率,国内韩素义等报道在Ⅱ~Ⅳ期出现黄斑水肿者为86. 6%。在视乳头上的新生血管荧光充盈比视网膜血管早,说明此新生血管来源于睫状血管系统,晚期新生血管有大量荧光渗漏,局部形成强荧光。其他部位的新生血管随静脉充盈而充盈,晚期形成强荧光团。
吲哚菁绿脉络膜血管造影术
吲哚菁绿脉络膜血管造影术(indocyanine green choroidal angiography,ICGA) 与FFA相同,血管瘤也出现强荧光点和晚期的渗漏,中期可以出现弥漫性强荧光,造影晚期眼底后极部可见小叶斑片状的强和弱荧光的椒盐状外观。但是,有的血管瘤在ICGA不显影。Bisscholf和Flower对有糖尿病性视网膜病变的患者进行吲哚菁绿血管造影中显示:大部分增生性糖尿病视网膜病变和半数的非增生性糖尿病视网膜病变的患者可以有脉络膜的充盈迟缓;激光斑处毛细血管闭塞,呈现弱荧光。对毛细血管非灌注区ICGA不如FFA明显。由于吲哚菁绿的血浆蛋白结合率高,其荧光的强度只是FFA 的1/3,所以新生血管的高荧光渗漏不如FFA明显。
光学相于断层成像术
光学相于断层成像术(optical coherence tomography,OCT)光学相于断层成像是近些年新出现的医学影像技术,具备非侵入性、非接触和高分辨率,使用红外线作为探测光,其穿透性强,垂直分辨率可达10μm。不仅在眼底病中得到广泛应用,也用于青光眼等眼科领域,特别在黄斑部疾病上有其独特的优势。目前国际上已经将相干光断层扫描作为诊断黄斑水肿的必要工具之一。
糖尿病性黄斑水肿(diabetic macular edema,DME)时,视网膜失去原有的透明性,在水肿区视网膜色素上皮和脉络膜结构显得模糊不清。DME在直接检眼镜下可以看到,如果在裂隙灯前置镜下,由于看到的视野范围大,又有裂隙灯的双目镜下检查,有立体感,因此视网膜厚度的层次感更容易把握,而且可以看到是否有黄斑囊样水肿。如果存在轻度黄斑水肿时,肉眼下不易分清。Shahidi等证明,非接触性裂隙灯活体显微镜检查不能检测出平均厚度为正常1. 5倍区域的视网膜水肿。因此,对于早期的DME用前置镜检查往往容易忽视,需要借助于荧光造影检查。造影的晚期黄斑部有荧光渗漏,但是荧光造影不能对黄斑水肿进行定量检查。OCT对黄斑水肿的检查从形态上可以区分为以下几种:弥漫性神经上皮水肿、视网膜层间高反射(渗出)、囊腔样改变和黄斑区前牵拉,以及视网膜前膜等表现。通过OCT可以发现在前置镜和FFA下所难以发现的增厚的后部玻璃体对黄斑部的牵引,提示了增厚的后部玻璃体对黄斑部机械性的牵引也是糖尿病性黄斑水肿产生的原因之一,为手术治疗DME提供了理论依据。姚宜等研究显示,糖尿病早期FFA显示无DME改变时,黄斑区视网膜厚度已经较正常人增加,认为与DR初期阶段,糖代谢异常,刺激谷氨酸或乳酸释放,导致细胞内水肿有关。OCT检查发现视网膜层间高反射的硬性渗出多位于视网膜感觉层内,但同时也可见部分硬渗在视网膜下,有的发生视网膜浆液性脱离。OCT显示这样的水肿时,视力预后较差,视力下降一般低于0. 1,这种不可逆的视力下降与黄斑视细胞数减少,视细胞密度下降。通过OCT图像分析软件的储存和分析,能够对黄斑水肿进行追踪观察,并能够在黄斑水肿的治疗后进行复查以检测治疗效果。
眼电生理学的研究
Wanger(1985年)首先用视网膜电流图研究DR。近年来又有学者以图形视网膜电流图(pattern electroretinogram,P-ERG)对DR患者进行研究,P-ERG可反映后极部视网膜神经细胞的功能。Coupland认为b波振幅在DR背景期即较正常低,而潜伏期的改变,无显著性差异。陈豫川等研究b波振幅在DR出现前即检眼镜及荧光血管造影未出现异常时即有降低。
多焦视网膜电图(multi-focal electric retinogram,m-ERG)属于图形视网膜电图(P-ERG),与之不同的是m-ERG用伪随机的m序列的黑白翻转的六角形同时刺激视网膜的多个区域,分别获得多个区域的电生理反应波。而P-ERG所反映的是整个后极部视网膜的总和电生理反应。北京医院的研究发现m-ERG的P波潜伏期和振幅密度在非增生性糖尿病视网膜病变和增生性糖尿病视网膜病变有明显差异,表明视网膜的循环障碍加重,造成视网膜的功能下降。在存在黄斑水肿时,由于相对的缺血缺氧的存在,视网膜对光刺激的反应及电的传导减缓,也表现出潜伏期的延迟及振幅的下降。
颜色图形视诱发电位(pattern evoked potential,P-VEP)有黑白及彩色的,一般用蓝色图形检查。在DR的血管形态发生改变之前,即可出现光感受器和视神经系统功能异常,色觉异常是这种功能障碍的一种表现。蓝色P-VEP的P波峰潜时延长最为明显。主要是锥细胞和神经节细胞中蓝色敏感神经元的数量和传递蓝、黄对比信息的神经纤维最少。DR早期即可出现节细胞和神经纤维层变性。蓝色P-VEP的P波峰潜时延长与血糖浓度和病程均呈显著正相关。
振荡电位(oscillatory potentials,OPs)波起源于内层视网膜,与视锥、视杆细胞的功能有关。由于它对视网膜循环障碍特别敏感,当早期眼底及荧光血管造影尚未发现病变时,OPs波即可下降。陈豫川等报道明适应OPs总波幅在DR前期即开始降低,而暗适应OPs总波幅在DRⅠ期才出现降低。OPs波能早期发现DR,又能反映DR的进行性损害。梁小玲等报道OPs的频域和时域参数可作为评估DR不同病程和预后的客观指标。
孙勇等报道有DR的ICGA后期有改变的患者,ERG中OP3振幅较对照组下降、OP4潜伏期较对照组延长,明视α波振幅较对照组下降,暗视b波的潜伏期较无ICGA改变组延长,无ICGA改变组较对照组延长。由于ERG的α波起源于视网膜锥杆细胞层,OP3、OP4与视网膜暗视系统相关,这样的结果可能提示视网膜外层的感光细胞层较易受到代表糖尿病脉络膜病变的ICGA后期形态学改变的影响,同时视杆系统对这种变化较敏感。
视力预后与黄斑的形态学变化明显有关。OCT和多焦视网膜电图可提供客观标准,判定糖尿病黄斑水肿程度和预后。
以上研究证明,DR在出现血管病变前视觉细胞已有改变,节细胞与神经纤维层已有变性,眼电生理检查即有改变,可作为检查早期DR的方法之一。
治疗
全身治疗
- 积极控制糖尿病及控制饮食是治疗和预防糖尿病性视网膜病变的根本办法。能与医生密切配合,进行合理的药物治疗、适量的运动及严格控制饮食的患者,经长期随访,糖尿病性视网膜病变不加重,或者好转。
- 羟苯磺酸钙能降低糖尿病患者血液的黏滞性,改善微循环,长期或按疗程服用对糖尿病视网膜病变的微血管瘤、毛细血管的渗漏,有一定疗效。北京协和医院、北大人民医院和北京医院进行国产羟苯磺酸钙与导升明的临床验证中,其毛细血管和微血管瘤的渗漏在服药3~6个月后有明显减轻,治疗非增殖型糖尿病性视网膜病变有一定效果。
- 最近国外学者报道糖尿病晚期肾病患者严重贫血,用红细胞生成素(erythropoie-tin)治疗,可使视网膜病变的部分硬性渗出吸收,减轻黄斑部水肿,提高视力。
- 抗炎药物——阿司匹林的临床应用:阿司匹林属非甾体类抗炎药,其主要作用是消炎、止痛。在动物实验中发现阿司匹林可以预防早期的视网膜病变,但还没有大量的临床研究证实。有研究表明每日服用阿司匹林既不能增加也不能减少人类糖尿病性视网膜病变的发生和发展,同时与糖尿病患者玻璃体积血或黄斑水肿增加也无关。
- 糖代谢异常调节药物:高血糖引起的糖基化终末产物(AGEs)大量堆积导致视网膜毛细血管周细胞凋亡,从而导致DR的产生。氨基胍可以阻断AGEs的产生,还具有抑制毛细血管基底膜增厚和血管通透性增加的作用。
- 他汀类药物:最近研究发现,辛伐他汀可以延缓伴有高脂血症糖尿病患者视网膜病变的发展。血脂异常的2型糖尿病患者,口服阿托伐他汀显示可以降低临床显著黄斑水肿的硬性渗出及中心凹下脂质迁移,但是视力无明显改善。
- 蛋白激酶C(PKC)抑制剂:蛋白激酶C(protein kinase C,PKC)血糖升高时,PKC受体活性增加,引起组织缺氧导致VEGF表达增加,进而引起血管内皮细胞增殖,导致新生血管形成,促使血-视网膜屏障破坏,引起黄斑水肿。最近,有人随机选择了685例糖尿病患者,并做了34个月的随访,发现口服ruboxistaurinmesylate (LY333531)是一种PKCβ的特异性抑制剂可以有效减轻DR患者的视力下降和黄斑水肿。
脑垂体部分切除术
根据糖尿病性视网膜病变与生长激素有关的论点,脑垂体部分切除术对部分患者减轻视网膜病变的血管病变有一定作用,可以减少视网膜出血、水肿,导致新生血管萎缩,缓解血管病变。也可用放疗或电凝等方法破坏腺垂体达到治疗目的,但必须慎用。对少数因全身病情及眼底情况而不宜做光凝治疗者可考虑选用。
眼部治疗
一、光凝治疗
1)作用机制:①消除新生血管,减轻视网膜水肿,使异常的毛细血管闭塞,减少视网膜血流量;②破坏耗氧量大的视网膜感光细胞,促使氧的弥散,改善视网膜内层的供氧状态,阻止新生血管因子的表达;③视网膜血流改善后能改善视网膜自身的血流调解;④破坏视网膜色素上皮细胞,减少新生血管抑制因子的释放,减少新生血管的形成。
2)光凝疗法的适应证:①中度至严重的非增生性视网膜病变;②增生性视网膜病变;③继发虹膜红变;④继发新生血管性青光眼;⑤黄斑水肿。
3)光凝疗法的禁忌证:①眼底有广泛的纤维增殖;②荧光血管造影显示黄斑部位有明显的缺血性改变,光凝术后能加重黄斑水肿,甚至引起玻璃体大出血;③严重的肾病性或高血压性视网膜病变。
4)光凝的作用:光凝术后较大面积的视网膜被破坏,耗氧高的视网膜视杆细胞及锥体细胞被耗氧低的瘢痕组织所替代,因此光凝术后,该处视网膜变薄,有利于来自脉络膜血液循环的氧弥散至视网膜内层,从而改善视网膜的缺氧状态,以维持正常氧的张力。
5)治疗方法
- Ⅰ.播散性(全视网膜)光凝(panretinal photocoagulation,PRP):PRP是应用最广泛的治疗DR的方法,成为增生型DR的常规激光治疗方案,分次进行。
- a.标准PRP:血管弓外200~300nm光斑,周边部500nm,光斑间隔1~2个光斑,总量800~1500个,分3~4次进行。
- b.超全PRP:危险因素越多所需要的光凝治疗量越大。Reddy等统计了294只眼使用PRP治疗DR,光凝治疗量少的眼使用了500nm的光凝斑2600个,治疗量大的约6500个,分4~6次进行。
- c.轻型PRP:一是指光凝斑的密度及数量;另一个是指单个激光斑的激光功率强度。前者早在1991年ETDRS报告提出的轻播散性光凝方案为:光斑直径500nm,曝光时间0. 1秒,中度光斑反应,光斑总数400~650点,光斑间距≥1个光斑直径,范围距黄斑中心凹2个视乳头直径(DD)以外至赤道部,可以一次完成。
全视网膜光凝的副作用有暗适应下降,引起黄斑水肿和使原有的黄斑水肿加重,脉络膜新生血管等。因此,掌握治疗的方法和量是必要的,进行PRP时尽量分次进行,如有黄斑水肿应在PRP之前进行,可能减少黄斑水肿的发生和加重。
Ⅱ.格栅光凝(grid photocoagulation)或称棋盘格光凝:用100~150nm光斑,间隔1~2个光斑直径,曝光时间短,轻度光斑反应,适用于黄斑部弥漫性水肿病变。虽然格栅光凝可有效减轻水肿,但治疗本身有一定的风险:激光引起的视网膜脉络膜热损伤,误伤黄斑中心凹、旁中心暗点、脉络膜新生血管形成,对比敏感度下降等。
Ⅲ.局部光凝(focal photocoagulation)用100nm的光斑直接激光渗漏的微血管瘤和毛细血管,适用于局部微血管瘤或毛细血管渗漏的黄斑水肿。
近年来各种新的激光设备应用于DME的光凝治疗,如多波长激光技术的应用。多波长激光中的568. 2nm的氪黄激光成为DME激光的主要选择,氪黄激光的波长因不被黄斑部的叶黄素吸收,对视网膜神经上皮有保护作用。另外,将半导体二极管810nm微脉冲技术用于黄斑水肿的光凝治疗,由于是选择性视网膜色素上皮(RPE)光凝,应用在黄斑水肿治疗中与传统激光技术相比,具有有效而较少的副作用的特点,对中心视力有良好的保护作用。其优点在于,只要存在黄斑水肿和(或)临床有意义的黄斑水肿就可以实施光凝治疗而无需顾及在有DME时视力的好坏。810nm激光是非可见光,因此光凝治疗中没有光的刺激,又有微脉冲波的特点,功率输出呈间断性,很少产生痛感,增加了患者的耐受性,患者易接受并可重复治疗。
二、曲安奈德
曲安奈德(triamcinolone acetonide,TA)在玻璃体腔注射后可以起到抑制炎症反应,减轻血管渗漏。Larsson等比较了双眼患增生性DR的患者中一眼先行玻璃体内注射TA 4mg然后进行全视网膜光凝,而另一眼作为对照组单纯进行全视网膜光凝,经过9~12个月的随访,玻璃体注射TA眼的荧光渗漏面积、黄斑水肿都比单纯进行光凝眼轻,视力比治疗前轻度提高,而对照组则比治疗前有所下降。单独使用TA玻璃体内注射治疗黄斑水肿也获得了明显效果。TA玻璃体内注射的并发症主要有眼压升高、玻璃体积血、眼球穿通、视网膜动脉阻塞、白内障、视网膜脱离等,其中眼压升高最常见,通过局部和口服降眼压药物后一般能得到缓解。TA也可经Tenoen囊或球侧注射,也可以得到同样的效果。
三、抗新生血管因子
抗新生血管因子(vascular endothelial growth factor,VEGF):bevacizumab(avastin)是近年来出现的第二代人源化的抗新生血管内皮生长因子重组鼠单克隆抗体片段,对人VEGF所有亚型都具有特异性和亲和力。在DR的应用主要在几个方面:①糖尿病顽固性黄斑水肿的治疗,Haritoglou等进行了一项前瞻性的研究,51例局部光凝无效的弥漫性黄斑水肿的PDR患者在玻璃体腔注射avastin后12周,平均视网膜厚度从501μm± 163μm降至377μm±117μm,视力有所提高。②虹膜和视网膜新生血管的治疗,在一项45例的回顾性研究中,在26例视乳头新生血管渗漏的病例中有19例完全消退,在11例虹膜新生血管的病例中有9例完全消退。③玻璃体积血的治疗,玻璃体内注射avastin使新生血管消退从而促进积血吸收。④在玻璃体切割术前两周使用,使手术时纤维血管膜出血减少。
ranibizumab(lucentis)治疗:lucentis是avastin的部分抗体衍生而来的合成的人单克隆抗VEGF抗体片断,能够与所有类型的VEGF结合。玻璃体腔注射可以阻断DR患者视网膜血管通透性增加与新生血管的形成,且具有较高的安全性。可以明显降低糖尿病患者的黄斑水肿和提高患者的视敏度,北京医院眼科玻璃腔注射lucentis治疗黄斑水肿、视网膜新生血管、新生血管性青光眼及脉络膜新生血管膜显示,对新生血管的消退和改善视力上有较好的疗效。抗新生血管因子均需要重复治疗,其对DR的长期治疗效果有待于进一步临床观察来证实。
四、玻璃体视网膜手术
对DR的玻璃体视网膜手术的目的是清除玻璃体积血,恢复屈光间质的透明,松解增殖膜对视网膜特别是黄斑部的牵拉,使视网膜复位,保持一定的视觉功能。
1)玻璃体手术的适应证:
- 不易吸收的玻璃体积血,如果出血超过1个月不吸收就可以考虑手术。以往认为出血后3~6个月再考虑手术,根据美国糖尿病视网膜病变玻璃体切除研究组资料,1型糖尿病出血1个月后手术的视力较推迟至1年的视力预后有显著差异。2型糖尿病未见明显差异,但术前没有进行过激光治疗的患者应尽早进行手术。
- 浓密的黄斑前出血,及早手术可以减少黄斑前机化增殖,出血后的含铁血黄素对视细胞也有毒性作用。
- 牵拉性或合并有视网膜裂孔的视网膜脱离。
- 视乳头及黄斑部发生牵拉移位的。
- 进行性纤维血管增生,有纤维血管膜增生时,行激光治疗可能引起增殖膜的牵拉和由此而发生的牵拉性或合并视网膜裂孔。
- 黄斑水肿和脂样渗出。
玻璃体手术治疗黄斑水肿的机制包括:①去除玻璃体对黄斑区的机械性牵拉、消除玻璃体腔内的致病因子、给予有效和足够的视网膜激光光凝,促进水肿向玻璃体腔消散及灌注液的营养作用等方面。②还有学者报道完成玻璃体切除后切开视网膜取出其下面的硬性渗出物,王志军(2006)报道采用不切开视网膜的方法,术中除常规解除视网膜牵拉,加视网膜内界膜剥除并在重水下完成激光光凝,术后再用惰性气体充填也取得较好疗效。
2)疗效:黎晓新(1995)报道81只眼的玻璃体视网膜手术中视力改善占83%,不改善或下降的占16. 1%。不改善和下降的原因有:继发性青光眼、视网膜脱离、视神经萎缩和黄斑部牵拉性视网膜脱离。姜燕荣(2007)等报道554只眼术后视力改善,从术前视力≥0. 02的眼数占49. 1%,增加到术后的81. 6%,其中视力≥0. 1的眼数由术前的20. 2%增加到术后的52. 0%,总视网膜在位眼数91. 7%。马进等以mfERG为手段,对黄斑水肿术后局部视功能的演变进行动态监测和对照分析发现,随黄斑水肿的消退,视功能相应改善,两者存在显著的正相关性。有学者认为玻璃体术后,通过玻璃体腔视网膜从灌注良好区向缺血区转运氧的能力增强,同时认为视网膜可从玻璃体腔吸收氧,改善视网膜的血供。但有的学者认为术后黄斑水肿的消退是暂时性的。王志军(2006)报道术后FFA及OCT检查结果,提示术后视网膜微血管瘤数目明显减少或完全消失,渗漏和荧光素积聚较术前明显减轻或完全消退,OCT检查黄斑区视网膜厚度减轻。
五、视网膜冷凝疗法
对DR继发的新生血管性青光眼,如果不能进行眼底激光治疗,如瞳孔粘连不能散大进行激光治疗,或周边部激光无法达到的新生血管青光眼可以用视网膜冷凝。现在由于广角的激光视网膜镜的应用,激光范围已能达到眼底赤道部以前的周边部视网膜,所以应用视网膜冷凝已经较少。视网膜冷凝术后,能加重血-视网膜屏障的破坏,能加重玻璃体视网膜的增殖反应,可引起一系列急性炎症表现如球结膜充血、水肿、房水蛋白渗出含量增加等前部葡萄膜炎,重者有成形性渗出、前房积血等,还可出现局部缺血、白内障、脉络膜出血或脱离、视网膜脱离、黄斑水肿、视乳头水肿等并发症。如果患眼因新生血管性青光眼已失明,可以进行睫状体冷凝术,但是晚期可出现低眼内压、眼球萎缩,因此冷凝术要适当掌握冷凝时间和冷凝量不要过度。
预后
DR视功能的预后,非增生性比增生性的预后好。糖尿病患者一定要定期检查视力、眼底及眼底照相等,有条件时尚需定期做眼电生理检查。
PDR的新生血管在视乳头上者(NVD),如不进行适当治疗,则2~3年内将失明,因视乳头上无内界膜阻挡,新生血管容易长入玻璃体内而引起玻璃体积血。据统计玻璃体积血后一年内有1%的眼失明,1/3的眼永久性视力损害。当一眼失明后另一眼在短期内(50%在一年内由于增生性病变进展)也可能失明。美国统计糖尿病患者中失明人数比非糖尿病患者多25倍。Klein等统计成年糖尿病组中3%视力中等损害,1. 6%法定盲(视力≤0. 03)。韩丽荣(1992)统计114例204只眼,随诊6年,单眼失明36%(1. 06%),双眼失明20人(17. 5%)。最近Fong等报道5年随访视力严重丧失的主要原因是玻璃体积血,视网膜前出血;其次是黄斑水肿及色素改变,第三是视网膜脱离和新生血管性青光眼。
张承芬等认为糖尿病史20年以上血糖控制良好者,可长期保持正常眼底或Ⅰ期DR。Lee等认为大多数非增生型不发展成增生型,年龄较大有大血管病变者,增生型糖尿病性视网膜病变的患病率低。
