当糖尿病患者长期处于慢性高血糖状态时,可通过多种途径导致体内各种组织蛋白质的糖基化增强,活化多元醇旁路以及致微循环高灌注等而发挥其病理作用,使血管(包括大、小血管)壁上皮及神经组织受损,产生眼底病变、肾脏病变和神经病变等微血管慢性并发症以及动脉粥样硬化、高血压、冠心病、缺血性脑血管病和下肢缺血性血管病变等慢性并发症或合并症的危险性大大增加(下图)。20世纪90年代有几项大规模的临床研究均显示严格控制高血糖,使其接近正常水平是可以预防和延缓糖尿病慢性并发症或合并症的发生和进展的。
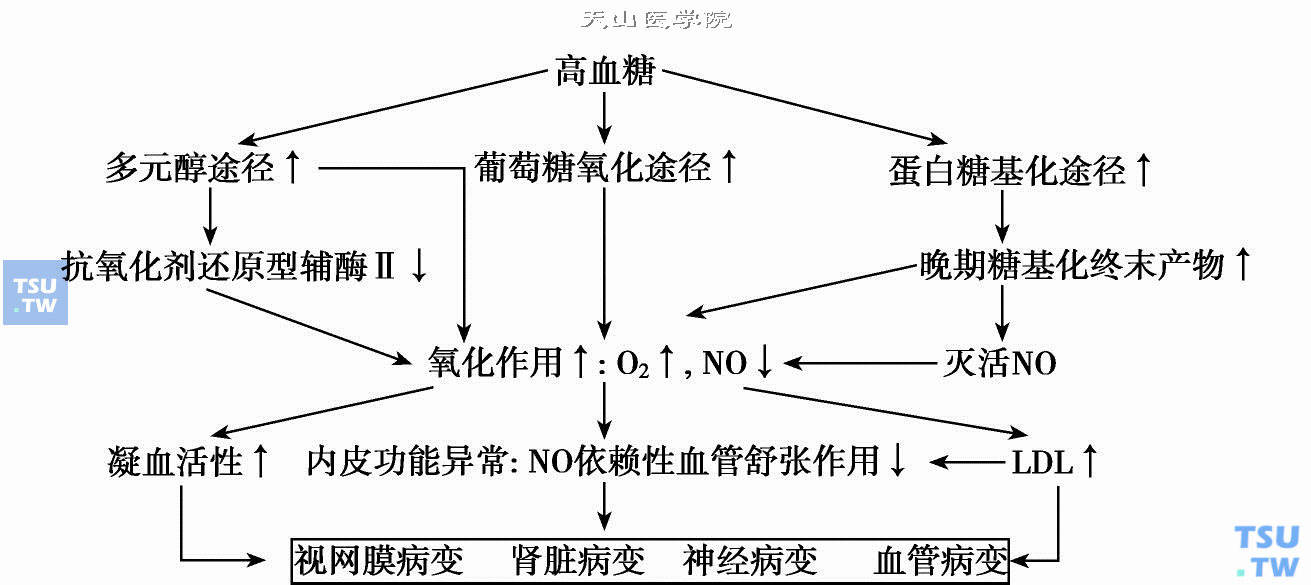
高血糖所致糖尿病慢性并发症的机制
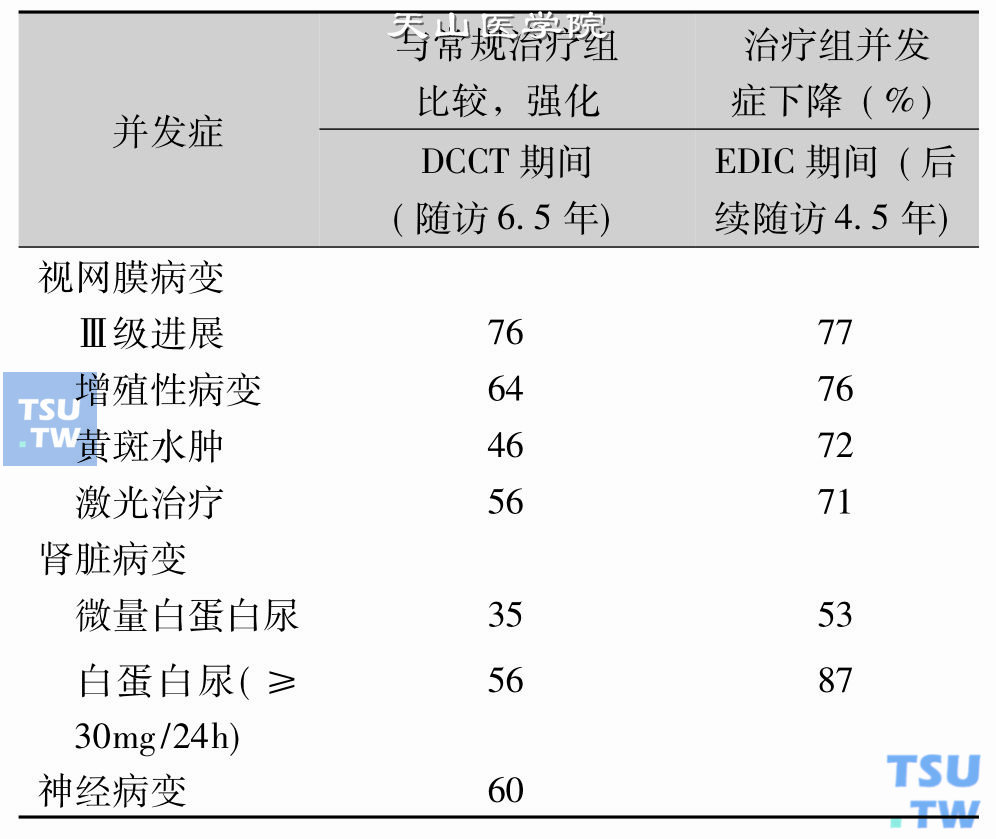
1993年美国糖尿病控制和并发症试验研究组(DCCT)报告的“糖尿病强化治疗对胰岛素依赖型糖尿病(1型)慢性并发症发生和发展的作用”的研究,平均随访6. 5年的研究结果证实,1型糖尿病患者经过胰岛素强化治疗使血糖控制在接近正常水平(HbA1c为6. 05%~7%),可有效地延缓糖尿病患者视网膜病变、肾脏病变和神经病变的发生与减慢其发展,但有发生低血糖的危险性和体重增加的副作用。后续的“糖尿病流行病学、干预和并发症研究(EDIC)”是对DCCT的研究对象进行长期随访项目,在DCCT结束后常规治疗组的患者大多数改为强化治疗,HbA1c均值也下降了大约1%;强化治疗组患者的HbA1c有所上升。经过5~7年的随访,两组患者的HbA1c水平几乎相似,但其视网膜和肾脏病变发生率的差别仍持续存在,甚至继续扩大,反映了血糖与并发症具有“惯性”作用,血糖降至较低水平时所产生的疗效似乎在血糖回升后仍继续存在,这种现象被称为“印迹”或“代谢记忆”(下表)。
DCCT和EDIC的研究结果
1998年发表的UKPDS对新诊断的2型糖尿病患者使用磺脲类降糖药物或胰岛素强化治疗,随访中位数10年(7. 7~12. 4年)的研究结果也显示,对新诊断的2型糖尿病患者经过强化治疗后均可降低其微血管并发症发生的危险,也可使低血糖的危险上升和体重增加。UKPDS同期进行的使用二甲双胍对新诊断的肥胖2型糖尿病患者强化治疗研究(中位研究期限10. 7年)的结论是:肥胖的2型糖尿病患者应用二甲双胍强化血糖控制降低了糖尿病相关终点事件的危险,并且更少出现体重增加和低血糖的发生。因此,二甲双胍可作为肥胖2型糖尿病患者的一线治疗药物(下表)。
UKPDS的主要结果

另外,1995年发表的日本的一项随机、对照、前瞻性对2型糖尿病患者使用胰岛素强化治疗6年的研究(又称Kumamoto研究)结果显示,每日多次注射胰岛素治疗,严格控制2型糖尿病患者的血糖,能够预防和延缓糖尿病性视网膜病变、肾脏病变和神经病变的发生和进展。从本研究中提示,预防糖尿病性微血管病变发生和恶化的血糖阈值是HbAlc<6. 5%,空腹血糖<6. 1mmol/L(110mg/dl),餐后2小时血糖<10mmol/L(180mg/dl)。但是,Kumamoto研究结果没有被西方国家视为2型糖尿病强化降糖有效的确切证据,部分原因是由于日本与非亚裔2型糖尿病患者之间存在体重差异,因而胰岛素需要量不同的缘故(日本患者胰岛素剂量大约为0. 2U/(kg·d),美国患者胰岛素的需要量大约为>0. 75U/(kg·d)。
近些年的研究发现,餐后高血糖与糖尿病心血管并发症或合并症的产生关系也密切。糖尿病干预治疗(diabetes intervention study,DIS)是一项为期11年对新诊断的2型糖尿病患者的研究,其结果显示:餐后高血糖是引起心肌梗死和使心血管事件的死亡率升高的一个危险因素,而空腹血糖水平却未显示出与心血管并发症的发生率及死亡率存在任何相关关系。巴黎前瞻性研究(Paris prospective study)同样证明,除了血浆TG、TC水平外,在死于冠心病的葡萄糖耐量低减(IGT)或2型糖尿病患者中,其葡萄糖负荷后2小时血糖水平显著升高。在2型糖尿病患者中于高血糖出现之前,心血管病变就有可能已经存在;并且当患者处于IGT阶段时,心血管病变的发生就已经开始。与健康对照组比较,IGT患者的颈动脉血管内膜及中层显著增厚,与2型糖尿病患者的动脉厚度相似,这表明在2型糖尿病发生之前其动脉粥样硬化性病变就已经发生。另一项研究表明(Helsinki policemen study),在年龄为30~59岁的糖尿病患者中,5年的冠心病死亡率与葡萄糖耐量试验中1小时的高血糖状态显著相关。在欧洲进行的DECODE研究其目的是评估降低餐后血糖的临床益处,共有25 384例(其中1275例已确诊糖尿病)研究对象参加,随访10年(中位数7. 3年)的研究结果显示,经年龄、性别、医院、总胆固醇水平、BMI、收缩压、吸烟等校正后,比较空腹血糖及OGTT的2小时血糖与总死亡率的相对危险度发现,当空腹血糖<125mg/dl,若2小时血糖升高,危险性增高;即使空腹血糖<110mg/dl,2小时血糖>200mg/dl的人群中,危险度呈跳跃式地增高了2倍。该研究进一步证实,OGTT的2小时血糖比空腹血糖可更好地预测心血管疾病导致的死亡。本研究结论是糖尿病死亡率增加与糖负荷后2小时血糖显著相关,而与空腹血糖水平无关;在任何空腹血糖水平,发生猝死的危险性随着餐后2小时血糖的升高而增加。因此,糖负荷后2小时血糖是预测高血糖相关死亡率的最重要指标。在亚洲进行的一项相似的DACODA研究,是评估空腹和餐后血糖对糖尿病诊断和心血管危险性的影响。该研究共纳入17 666例年龄在30~89岁的血糖异常(空腹血糖值及2小时血糖值)为研究对象,其结果显示,血糖异常与全因死亡危险、心血管死亡危险呈正相关;2小时血糖值与空腹血糖值进行比较,2小时血糖是全因死亡危险、心血管死亡危险更有效的预测因子;经过对空腹血糖进行校正后,负荷后高血糖与全因死亡率、心血管死亡率密切相关,即除外空腹血糖的影响,负荷后高血糖是上述两种死亡率独立危险因素;而当对2小时血糖进行校正后,空腹血糖水平与全因死亡率、心血管死亡率无关,即空腹血糖水平与全因死亡率、心血管死亡率相关联是基于混杂因素结果,其中2小时血糖即是其中的混杂因素。
餐后高血糖易引起糖尿病患者心血管并发症的机制尚不十分清楚。但已有研究表明,较高的餐后血糖水平有可能对血管壁的内皮细胞具有毒性作用而导致血管内皮细胞结构及功能异常,从而引起血管壁通透性增加,使循环血液中的物质如脂肪向血管壁内流入增加,这将加重动脉粥样硬化性病变的发生。餐后高血糖同样还可以使凝血酶的产生增加和活性增强,促使糖尿病患者发生血栓性病变的危险性增加。此外,餐后血糖水平的迅速增高可激活内皮细胞中的蛋白激酶C(PKC)尤其是蛋白激酶C-α,而这一激活过程可以刺激内皮细胞表面上黏附分子的表达,使黏附分子-Ⅰ(CAM-1)水平迅速上升,将使白细胞与内皮细胞之间黏附增强,这正是动脉粥样硬化病变形成的第一步。
另外,糖尿病患者的血糖漂移(波动)也与糖尿病血管并发症密切相关。有一组研究是比较使用NPH每天注射2次的常规治疗组与基础加餐前短效胰岛素强化治疗组的1型糖尿病患者发生视网膜病变的风险,经过9年的随访,常规治疗组HbA1c波动幅度较大(7%~9%),强化治疗组HbA1c波动幅度较小(7%~8%),若两组平均HbA1c按9%统计,视网膜病变的发生率前者是后者的2. 5倍。另一项试验是使用人脐静脉内皮细胞分别在正常葡萄糖环境(5mmol/L)、高葡萄糖环境(20mmol/L)及高(20mmol/L)与低(5mmol/L)每24小时交替1次的波动性高葡萄糖环境下培养7天和14天,观察细胞的凋亡情况发现,在高葡萄糖漂移的条件下,对细胞的毒性作用大于稳定的高血糖状态。血糖漂移对肾脏病变影响的研究发现,血糖漂移对肾小管间质的毒性作用大于稳定性高血糖状态。另外一项多中心、回顾性研究中,共纳入7049例危重患者,采取168 337个血糖值观察血糖漂移度对死亡率影响的研究中发现,血糖漂移度与死亡率成正相关。血糖漂移产生血管并发症的机制可能与血管内皮细胞暴露于漂移性高葡萄糖环境,通过蛋白激酶C依赖的激活系统,导致了ROS过度产生,增强氧化应激和前炎症因子,从而引发血管损伤的发生。
由此可见,无论从流行病学和基础研究或从临床实践都证实,严格控制高血糖至接近稳态的正常水平,同时尽量避免低血糖的发生,是可以降低糖尿病慢性并发症或合并症。那么,要控制好血糖必须掌握和执行糖尿病综合治疗的五项措施:糖尿病的教育,合理的饮食,适当地运动,必要的降糖药物的使用和糖尿病的病情监测。
按照IDF-WPR的亚洲-太平洋地区2型糖尿病政策组2005年(第4版)推荐的血糖达标要求,HbA1c≤6. 5%,空腹或餐前血糖为4. 4~6. 1mmol/ L(80~110mg/dl),餐后2小时血糖为4. 4~8. 0mmol/L(80~145mg/dl)作为达标标准。
